Внематочная система для физиологической поддержки преждевременно рожденного ягненка

Преждевременные роды на ранних сроках представляют собой главную причину неонатальной смертности и заболеваемости в развитых странах, что обусловлено различными сочетаниями недоразвития органов и ятрогенных повреждений. До настоящего момента усилия по продлению беременности с помощью внематочных систем достигли ограниченных успехов. В данной статье мы сообщаем о разработке системы, которая включает в себя контур безнасосного оксигенатора, связанный с плодом ягненка в области пуповины, где поддерживается замкнутый круговорот амниотической жидкости, точно воспроизводящей внутриутробную среду. В этом устройстве зародыши ягнят, степень развития которых эквивалентна крайней степени недоношенности человеческого плода, могут получать физиологическую поддержку сроком до 4 недель. У ягнят, подключенных к аппарату, сохраняется стабильная гемодинамика, нормальные параметры газового состава крови и оксигенации, а также поддерживается кровообращение в модифированной нами системе “мать-плацента-плод”. При соответствующей нутритивной поддержке у них отмечается нормальный соматический рост, созревание легких, а также развитие и миелинизация головного мозга.
Введение
В Соединенных штатах преждевременные роды на ранних сроках являются главной причиной младенческой смертности и заболеваемости, причем с данной проблемой связано более трети всех случаев младенческих смертей и половина случаев детского церебрального паралича. Достижения в области реанимации новорожденных повысили выживаемость и отодвинули порог жизнеспособности к 22-23 неделям гестации. Однако у младенцев, рожденных до 28 недели, достигнутая выживаемость была ассоциирована с высоким уровнем заболеваемости хроническими болезнями легких и другими осложнениями, связанными с недоразвитием органов. Фактически, за счет использования такого низкого порога жизнеспособности, общее число пациентов с тяжелыми патологиями, причиной которых явилась недоношенность, стало больше, чем десятилетие назад. Дыхательная недостаточность представляет собой распространенную и наиболее сложную проблему, поскольку нарушениям газообмена у недоношенных новорожденных способствует структурная и функциональная незрелость легких. Это состояние, известное как бронхолегочная дисплазия, в настоящее время рассматривается как связанное с остановкой в развитии легких, вторичной по отношению к преждевременному переходу от жидкой среды к вентиляции воздухом, что объясняет, почему даже малоинвазивные способы вентиляции у новорожденных не снижают частоту бронхолегочной дисплазии. Существует очевидная острая потребность в более физиологичных способах поддержки экстремально недоношенных новорожденных.
Концепция экстракорпоральной поддержки плода привлекательна, поскольку схожа с характерной плоду физиологией, согласно которой экстракорпоральный газообмен поддерживается плацентой. Однако успехи в разработке искусственной плаценты, которая являлась предметом исследований в течение более чем 50 лет, были ограниченными. Основными проблемами были прогрессирующая недостаточность кровообращения, развивающаяся из-за дисбаланса пред- и постнагрузки при воздействии на сердце сопротивления оксигенатора и систем поддержки кровообращения, использования открытых жидкостных инкубаторов, приводящего к контаминации и фетальному сепсису, а также проблем с доступом к пупочным сосудам, приводящих к сосудистому спазму . Для устранения этих препятствий мы разработали систему, в основе которой лежат три компонента: безнасосный артериовенозный контур, замкнутая жидкостная непрерывно обновляемая внутренняя среда и новая техника доступа к пуповинным сосудам. В этой статье мы демонстрируем, что жизнь экстремально недоношенных ягнят до 4 недель может поддерживаться в экстракорпоральном устройстве без развития видимых физиологических расстройств или полиорганной недостаточности. Эти результаты, как по продолжительности, так и по физиологическому благополучию, превосходят все предшествовавшие попытки поддержания жизни экстремально недоношенного плода.
Результаты
Пилотные исследования
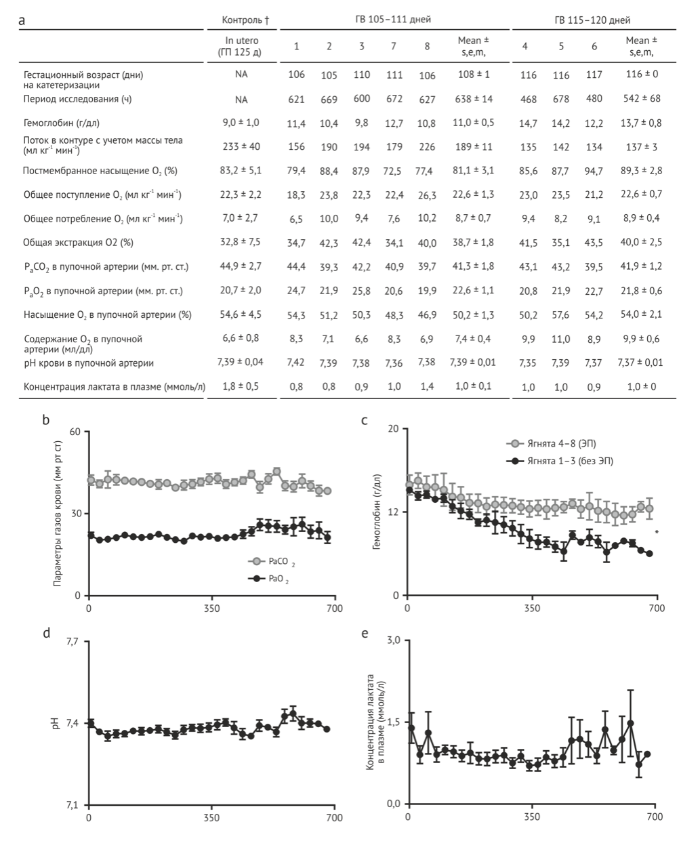
Была проведена серия пилотных исследований, позволивших определить возможные препятствия и осуществить последовательные изменения конструкции, что завершилось разработкой финальной версии устройства. Во всех пилотных исследованиях использовался безнасосный артериовенозный (АВ) контур, описанный ниже. Первоначальные изменения конструкции были связаны с жидкостной средой и нашим вариантом сосудистого доступа. В ходе наших пилотных исследований последовательно наблюдались стабильная гемодинамика и эффективный газообмен, которые достигались с помощью безнасосного АВ контура с широким диапазоном движений. Начальная серия экспериментов проводилась на ягнятах поздних сроков гестации (125-140 дни гестации; срок 1/4 145 дней) и с использованием открытой емкости, в которой поддерживалась непрерывная рециркуляция раствора электролита (имитирующего амниотическую жидкость) через микропористые фильтры. Чтобы избежать потенциального спазма пупочной вены, в качестве сосудистого доступа мы использовали сонную артерию (СА) и яремную вену (ЯВ) (Таблица 1, открытая СА/ЯВ). Эти исследования продолжались от 23 до 108 часов, но были ограничены сепсисом и связанными с катетером осложнениями. В результате была сконструирована вторая система, которая включала в себя полузакрытую емкость, где происходила не рециркуляция, а непрерывный обмен амниотической жидкостью (Таблица 1, полузакрытая СА/ЯВ). В усовершенствованном инкубаторе в течение 346.6±93.5 часов поддерживалась жизнедеятельность пяти экспериментальных животных с канюлями СА/ЯВ (сроком от 120 до 125 дней гестации), у которых отмечались заметные улучшения состояния в сравнении с находившимися в первоначальной конструкции. Важно отметить, что одно животное находилось в контуре в течении 288 часов (120-132 дни гестации) и успешно привыкало к спонтанному дыханию, делая шаг на пути к долгосрочной выживаемости, подтверждающий, что животные могут перейти к нормальной постнатальной жизнедеятельности после продолжительной внематочной поддержки. Однако сепсис остался осложнением у 3 из 5 ягнят, что послужило основанием для разработки замкнутого жидкостного контура (Biobag). С внедрением Biobag проводимые пилотные исследования имели целью применить нашу систему к ранним периодам гестации. Если рассматривать стадии развития легких, то ягнята 100-115 дней гестации находятся в средней и поздней каналикулярной фазах , которые биологически соответствуют преждевременно рожденному человеческому младенцу 22-24 недель гестации.
Однако, у ягнят с СА/ЯВ канюлями, гестационный возраст (ГВ) которых составлял 110 дней, отмечались стихание движений в контуре и прогрессирующий отек легких, которые развивались в течение первых дней. Малые движение в контуре были вызваны снижением перфузионного давления оксигенатора по причине более низкого среднего артериального давления у ягнят раннего ГВ, сочетающегося с повышенным венозным давлением в большом круге кровообращения у СА/ЯВ животных 110-дневного ГВ в сравнении с опубликованными значениями в контрольной группе, развивавшейся внутриутробно (давление в нижней полой вене 9.6±2 мм рт. ст. в сравнении с 4±2 мм рт. ст. соответственно) . Чтобы снизить нагрузку на правое предсердие, для венозного доступа мы решили использовать пупочную вену (ПВ), позволяющую имитировать нормальный венозный возврат в пуповине плода и улучшить ток оксигенированной крови через овальное окно . Во избежание спазма пупочной вены мы продвинули вперед канюлю катетера в положение, когда кончик располагается внутри фасции передней брюшной стенки. Катетеризация СА/ЯВ обеспечила стабильную поддержку пяти ягнят ГВ 106-113 дней на срок от 13 до 26 дней в Biobag (Таблица 1, Biobag, СА/ЯВ). У всех пяти ягнят отмечались долговременная стабильная гемодинамика, стабильные движения потоков и параметры оксигенации (СА/ЯВ группа на рис. 2). Однако, поток сквозь оксигенатор у СА/ЯВ ягнят был значительно ниже нормального физиологического потока через плаценту (70-120 в сравнении с 150-200 мл/кг/мин) , главным образом, из-за малого калибра сонной артерии. Ограничивающая проблема тока по каротидным сосудам послужила толчком к разработке окончательного устройства, позволяющего обеспечить дополнительную поддержку плода (Рис. 1, видео 1). Ниже описаны три компонента системы.
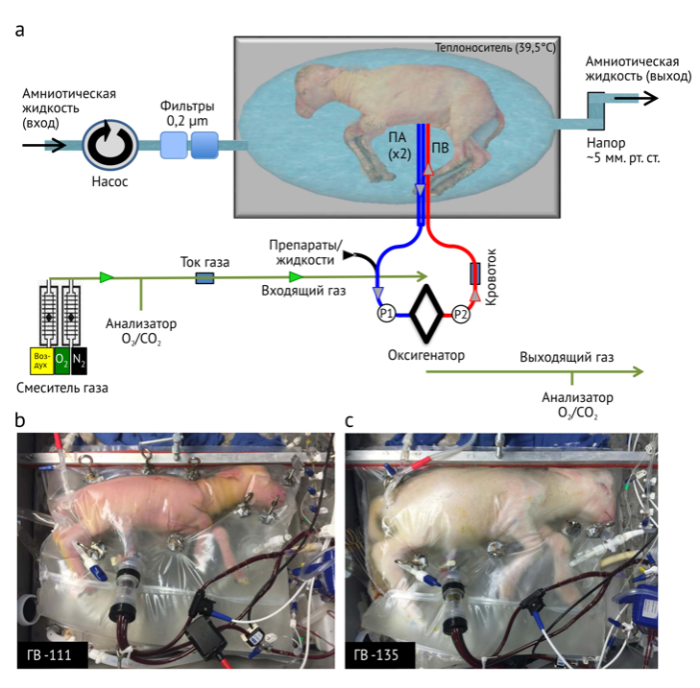
Безнасосный артериовенозный контур
С самого начала исследования мы пришли к выводу, что безнасосный контур (контур, в котором ток крови обеспечивается исключительно биением сердца плода) в сочетании с очень низким сопротивлением в оксигенаторе наиболее точно имитирует нормальную циркуляцию в системе плацента-плод. В большинстве наших исследований мы использовали малый объем, оксигенатор с почти нулевым сопротивлением и короткие сегменты трубок контура, минимизирующие площадь поверхности и объем первичного заполнения. Эта система сопоставима с объемом плаценты: отмечаемый объем плацентарного кровотока овец от 23,1 до 48,1 мл/кг . В большинстве исследований, используемых в этом отчете, использовался оксигенатор Quadrox-ID Pediatric (Maquet Quadrox-ID Pediatric Oxygenator: Maquet Cardiopulmonary AG, Rastatt, Germany), начальный объем которого составляет 81 мл. До этого у маленьких ягнят (от 0,5 до 1 кг) мы использовали модифицированный оксигенатор Quadrox Neonatal (Maquet QuadroxI Neonatal and Pediatric Oxygenator: Maquet Cardiopulmonary AG) с начальным объемом 38 мл. Таким образом, начальные объемы нашего контура для ягнят от 1 до 3 кг находятся в пределах нормального объема плацентарной крови. За все время разработки нашего устройства, за исключением описанных выше СА/ЯВ животных ранних сроков гестации, у всех животных отмечалась полная стабильность гемодинамики, без нужды в вазопрессорах или признаках прогрессирующего ацидоза или недостаточности кровообращения.
Замкнутая стерильная жидкостная среда
Для дальнейшего решения вопросов о стерильности, адаптируемости размеров и эффективности пространства и объема жидкости была разработана система “Biobag” — одноразовая, полностью закрытая система, в которой минимизированы объемы амниотической жидкости и которая может быть изготовлена индивидуально в соответствии с размерами и формой матки. Biobag состоит из полупрозрачной, сонолюцентной и гибкой полиэтиленовой пленки, позволяющей контролировать, сканировать и выполнять манипуляции с плодом по мере необходимости. Открываемая герметизируемая сторона была встроена для облегчения наблюдения за плодом во время катетеризации, а для размещения канюль, датчиков температуры и стерильных насосных трубок были спроектированы различные водонепроницаемые отверстия. После катетеризации Biobag герметизируется и переносится на мобильную поддерживающую платформу, которая обеспечивает регуляцию температуры и давления, основную и резервную жидкость, а также циркуляцию жидкостной среды. Разработка Biobag позволила решить проблему грубого загрязнения жидкости, а также исключить пневмонию как патологию легкого. В ходе последующих экспериментов, низкие уровни контаминации амниотической жидкости наблюдались только в тех случаях, когда требовалось повторное вмешательство в Biobag. Когда это происходило, контаминацию можно было устранить путем повышения скорости обмена жидкостью и ежедневного введения антибиотиков в емкость с жидкостью.
Доступ к пуповинным сосудам
Чтобы приблизить динамику потока к внутриутробной, катетеризации сонной артерии предпочли двойную катетеризацию пупочной артерии и одиночную пупочной вены (аббревиатура ПА/ПВ). Мы разработали технику катетеризации сосудов пуповины, которая поддерживает длину нативной пуповины (5-10 см) между кончиками канюли и передней брюшной стенки, что минимизирует возможность деканюляции и риск механической обструкции (Рис. 1b, c). Длина пупочных и венозных канюль только 2 см, большинство из них используется для фиксации катетеров, а потому граница раздела осуществляется конец в конец. Спазм пуповинных сосудов был устранен с помощью сочетания местного введения папаверина, атравматической оперативной техники и поддержания тепла, а также физиологического насыщения кислородом притока по пупочной вене при инициации движения в контуре. Biobag был модифицирован для размещения исключительно пуповинных канюль (Рис. 1b и видео 1).
Физиологическая экстракорпоральная поддержка плода
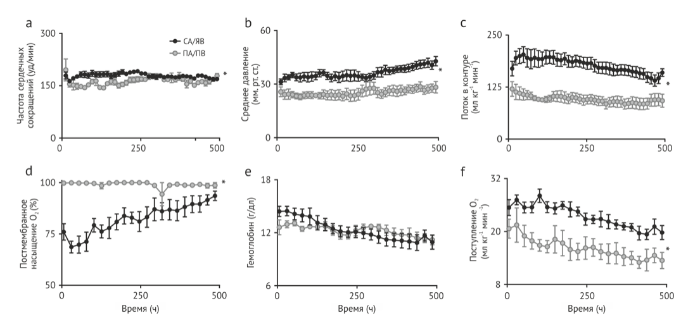
Наше устройство представляет собой сочетание контура безнасосного оксигенатора, закрытой циркуляции жидкости и доступа к Biobag и пуповине. Мы наблюдали 8 ягнят, у которых поддерживались стабильные уровни движения в контуре, эквивалентные нормальному плацентарному кровотоку. Мы наблюдали 5 плодов 105-108 дней гестации в течение 25-28 дней и 3 плода 115-120 дней гестации в течение 20-28 дней (Таблица 1, Biobag ПА/ПВ). Самый длинный период наблюдения составил 28 дней и был ограничен протоколами работы с животными, а не какой-либо нестабильностью, что позволяет предположить, что поддержка животных на ранних сроках гестации может осуществляться более 4 недель. Параметры гемодинамики и движений в контуре для всех восьми ПА/ПВ ягнят были обобщены на рис. 2 и непосредственно сравнивались с СА/ЯВ ягнятами. У ПА/ПВ ягнят были отмечены уровни циркуляции, сравнимые с нормальным плацентарным кровотоком (Рис. 2с, 150-250 мл/кг/мин) на протяжении всего периода наблюдения. Благодаря физиологическому движению потоков в контуре у ПА/ПВ животных, мы смогли поддерживать более низкую постмембранную сатурацию (Рис. 2d) с нормальной доставкой кислорода к плоду (Рис.2f) и уменьшением потребности в трансфузии (Рис. 2е) относительно СА/ЯВ ягнят. Обычно, чтобы предотвратить избыточную подачу кислорода, мы снижали начальную концентрацию кислорода в системе до 11-14%, насыщая азотом комнатный воздух.
Нормальная оксигенация необходима для физиологической метаболической поддержки, утилизации субстрата, а также для роста и развития. Рисунок 3а показывает расчетные параметры, относящиеся к доставке кислорода нашим ПА/ПВ ягнятам, как пяти на ранних сроках гестации (105-108 дни гестации), так и трем на поздних сроках гестации (115-120 дни гестации). Значения в обеих группах сопоставимы с ранее опубликованными нормальными значениями для плодов ягнят . В ходе исследования были предприняты усилия по поддержанию у плода нормального напряжения кислорода и давления углекислого газа путем обеспечения нормального поступления кислорода (Рис 3b). У СА/ЯВ ягнят отмечалось прогрессирующее снижение уровня гемоглобина (Hgb), что требовало переливаний крови взрослых в больших объемах (40 мл/кг в неделю) для поддержания доставки О2. Мы предположили, что, вероятно, это связано с малой продукцией эритропоэтина в печени плода, обусловленной супра-физиологическим содержанием О2 в постмембранной ЯВ крови . Последующие эксперименты с первыми тремя ПА/ПВ животными продемонстрировали снижение потребности в трансфузии (10 мл/кг в неделю), что, вероятно, было обусловлено более низким РаО2 в ПВ крови. Последним пяти ПА/ПВ животным ежедневно вводили эритропоэтин, который замедлял прогрессирование анемии или устранял ее (6 мл/кг в неделю), а также у последних трех животных полностью устранялась необходимость в переливании крови (Рис. 3с). Во всех исследованиях у плодов отмечались нормальные значения рН (рис. 3d) и уровень лактата (рис. 3е).
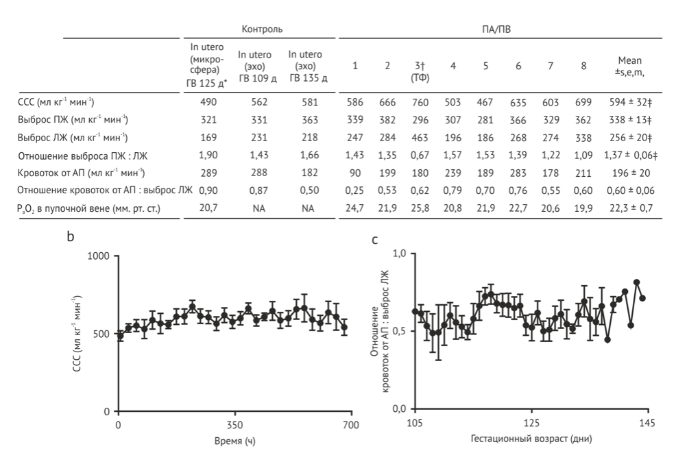
Ежедневная эхокардиография подтвердила физиологичность сердечных выбросов и поддержание нормальной циркуляции у плода во время наблюдения ПА/ПВ с почти нормальным током в артериальном протоке (Рис. 4 а-с), проходимостью и током через венозный проток, а также шунтированием справа налево через овальное окно . Сократительная способность сердца соответствовала норме, а размеры камер и полых вен могли использоваться как индикаторы статуса общего объема, позволяющего регулировать подачу жидкости. Опытный фетальный кардиолог (J. R.) провел обзор всех данных эхокардиографии и согласился с тем, что сердечная функция оказалась нормальной во всех отношениях.
Рост и созревание органов
Нутритивная поддержка, обеспечиваемая контуром, основывалась на поглощении субстрата поздних сроков гестации и, следовательно, преимущественно состояла из углеводов и аминокислот со следами липидов. Наша стратегия в отношении СА/ЯВ и ПА/ПВ ягнят заключалась в титровании декстрозы и аминокислот до уровней глюкозы в плазме крови (40 мг/дл) и мочевинного азота в крови (30 мг/дл), что позволяло избежать осмотического диуреза и/или гиперосмолярного состояния. Толерантность к субстрату, как правило, коррелировала с доставкой кислорода, но при относительно большей доставке кислорода ПА/ПВ ягнята переносили физиологические уровни доставки субстрата (Рис. 5а) и демонстрировали рост, сравнимый с контрольной группой (Рис. 5b, c). В качественном смысле, при длительном наблюдении отмечались явные рост и созревание. Животные открывали глаза, становились более активными, совершали нормальные глотательные и дыхательные движения, у них росла шерсть и они, очевидно, занимали больше пространства внутри емкостей (Рис. 1b, с). Добавление инфузий инсулина у двух последних ягнят улучшало утилизацию субстрата и позволяло увеличить калорийную нагрузку при дальнейшем усилении роста плода.
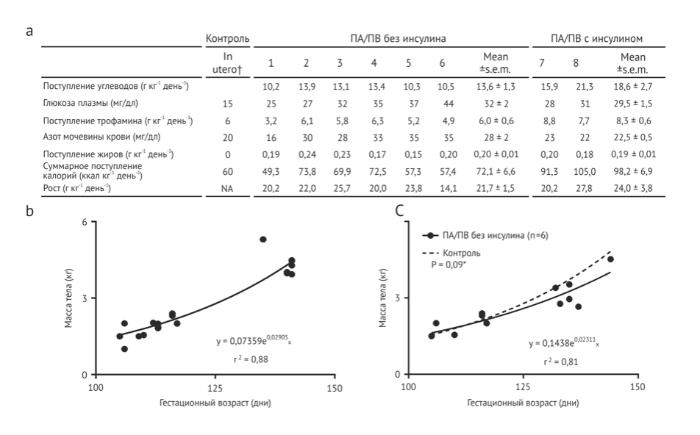
В качестве идентификатора созревания органов в нашей системе мы оценивали созревание легких у ПА/ПВ ягнят с помощью детального морфометрического анализа (Рис. 6 а-е), гистологической оценки (Рис. 6 f-i), анализа сурфактанта протеина В (Рис. 6 j, k) и анализа функций после рождения (Рис. 6m). Легкие ягнят 106-113 дней гестации находятся в переходе от средней к поздней каналикулярной фазе развития , которая биологически эквивалентна таковой у преждевременно рожденного младенца человека, гестационный возраст которого 23-24 недели . Морфометрический анализ демонстрирует прогрессирование от каналикулярной к саккулярной стадии развития легких, соответствующее развитию нормальных ягнят такового возраста в контрольной группе (Рис. 6 а-е). С функциональной точки зрения ягнят легко вентилировать после удаления их из контура, что почти сопоставимо извлеченным путем кесарева сечения и немедленно подключенным к аппарату вентиляции контрольным ягнятам, ГВ которых составляет 141 день (Рис. 6m). Метаболические параметры, которые отражали функции органов и нутритивный статус, были удивительно стабильны, несмотря на известный вклад материнского организма в функционирование печени и почек (Таблица 2). Исследования уровней билирубина и тесты функций печени продемонстрировали лишь очень мягкое повышение показателей, которые остались в пределах нормального диапазона.
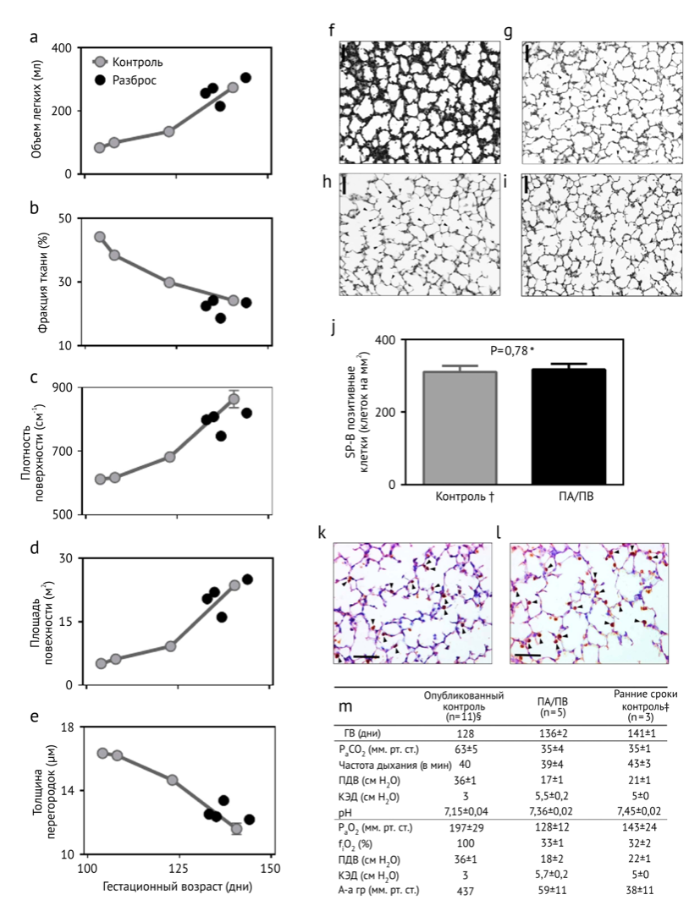
У ПА/ПВ животных также оценивались рост и развитие головного мозга. За период наблюдения мозг был совершенно нормален. У экспериментальных животных, в сравнении с развивающейся внутриутробно группой контроля того же возраста, никаких различий в соотношении веса мозга и тела не отмечалось (Рис. 7а). Для оценки созревания головного мозга мы проанализировали толщину мозговых извилин, которая также не отличалась от контрольной группы (Рис. 7b). Сообщалось, что двудольный диаметр является показателем роста мозга, а кривая роста ягнят, поддерживаемого нашей системой, была аналогична ожидаемой, соответствующей расчетам по весу (Рис. 7с) . Поскольку эффекты экзогенного инсулина на развитие головного мозга неизвестны, животные, получавшие инсулин, были исключены из тех, кому проводилась оценка роста головного мозга (n=2). При секционировании головного мозга мы не наблюдали никаких признаков кровотечения или инфаркта ни у кого из ПА/ПВ животных (n=5). Наконец, для оценки ишемического повреждения и целостности головного мозга у выживших ягнят в 6-месячном возрасте были получены постнатальные Т1-, Т2- и диффузионно-взвешенные МРТ-изображения (Рис. 7d). Несмотря на использование СА, не было отмечено ишемии или структурных дефектов. Чтобы подтвердить эти данные на гистологическом уровне, мы выполнили рутинное окрашивание гематоксилином и эозином критических областей головного мозга (Рис. 8а) и, поскольку белое вещество особенно чувствительно к ишемическому повреждению, исследовали критические области головного мозга ПА/ПВ животных путем денситометрии участков окрашенного миелина . В анализируемом мозге плотность миелина не различалась (Рис. 8 b-d). Кроме того, невропатологи из двух разных учреждений, не знающие, какая из тканей относится к группе контроля, а какая к исследованию, не идентифицировали каких-либо гистологических признаков ишемии, инфаркта или демиелинизации.
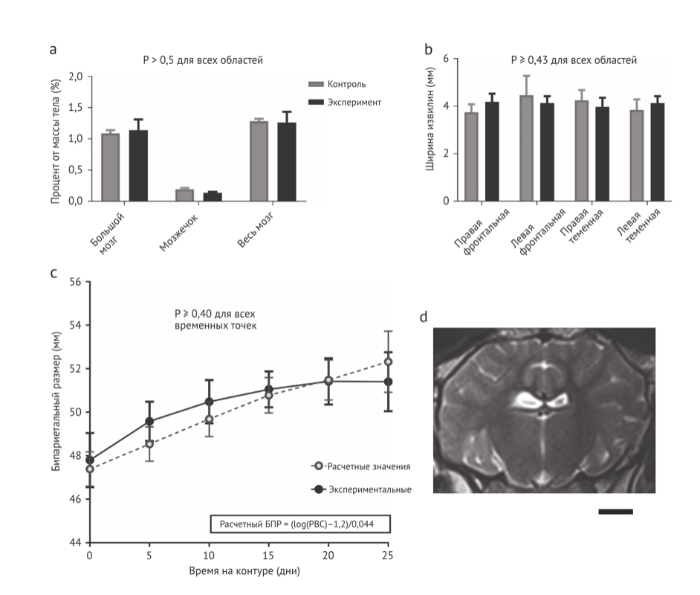
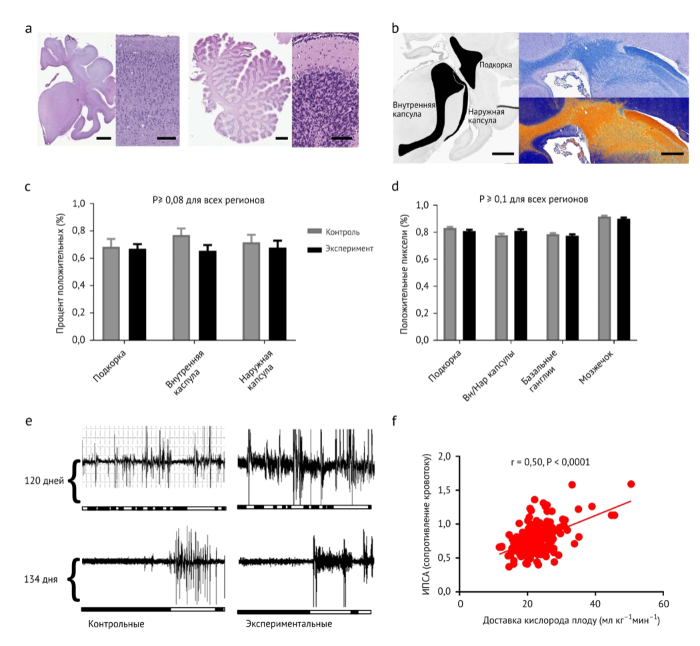
По общему функциональному уровню у ПА/ПВ животных отмечались нормальная или повышенная активность, циклы сон/бодрствование, прерывистое дыхание и глотание, признаков дистресса плода не отмечалось. Дыхательные движения плода отмечались регулярно, в течение всего периода инкубации. В качестве одного из показателей неврологического развития мы сравнили окулярную электромиографию (ЭМГ) двух хронически катетеризованных плодов ягнят с двумя ягнятами тех же сроков гестации, находившимися в системе. Прогресс развития от фрагментированных до консолидированных циклов сон/бодрствование между двумя гестационными возрастами проявлялся как in utero, так и у экспериментальных животных (Рис. 8е). Наконец, хотя непосредственной оценки перфузии головного мозга не проводилось, постоянно измерялся показатель пульсации средней мозговой артерии, который коррелировал с доставкой кислорода (Рис. 8f), что соответствует нормальной ауторегуляции мозгового кровотока. Объединив наши наблюдения с нормальным сердечным выбросом, доставкой кислорода и циркуляцией крови у плода, мы считаем, что наши ограниченные данные обнадеживают в отношении мозговой перфузии и развития мозга. Однако, стоит отметить, что существуют значительные различия между созреванием головного мозга у плода ягненка и человека, наиболее значимым из которых является раннее созревание зародышевого матрикса у ягненка (70 дней) . Таким образом, риск внутричерепного кровоизлияния не может оцениваться на данной модели . Кроме того, долгосрочное неврологическое наблюдение в нашей модели затруднено из-за сложностей с выживаемостью новорожденных ягнят и ограниченностью оценки их неврологических функций. Таким образом, любые выводы о неврологическом развитии ограничены
Обсуждение
Безнасосный контур, питаемый сердцем плода, не является новой концепцией и был первоначальным подходом многих исследователей . К преимуществам относятся простота, отсутствие индуцированного насосом гемолиза и возможность некоторой ауторегуляции движения крови в контуре. К недостаткам безнасосных систем относятся сердечная недостаточность, развивающаяся из-за нарушения баланса постнагрузки в случаях, когда контур/оксигенатор имеют супра-физиологическое сопротивление, или потенциальная сердечная недостаточность с высокой фракцией выброса в случаях, когда оксигенатор имеет субфизиологическое сопротивление. Большинство попыток ограничивалось субфизиологическим движением потоков в контуре и быстрой декомпенсацией гемодинамики, несмотря на использование вазопрессоров и принятия других мер . Недавно Miura et al. сообщили о выживании ягнят на безнасосном параллельном контуре в течение заранее установленного 60-часового лимита. В этом отчете указано, что гемодинамика животных оставалась относительно стабильной. Однако для снижения тока крови через контур были необходимы внешние регуляторы потока, а при гистологическом исследовании отмечалось повреждение белого вещества головного мозга. Многие исследователи присоединили насосы к артериовенозным системам, чтобы устранить ограничение субфизиологического потока в безнасосных системах. Хотя большинство попыток были кратковременными и приводили к нарушениям кровообращения, у двух плодов ягнят была достигнута выживаемость длительностью до 543 часов. Однако для достижения этого результата животные нуждались в диализе, непрерывном парализе, имели отеки и в некоторых случаях дыхательную недостаточность. Технология половолоконных пластин позволила создать оксигенаторы, имеющие минимальное сопротивление, что позволило нам использовать нашу безнасосную систему. В отличие от предыдущих исследований, на всех этапах разработки нашей системы мы не отмечали ни одного случая сердечной недостаточности у наших развивающихся ягнят (105 дней гестации и далее). Фактически, в контуре развивался низкий уровень сопротивления в тех случаях, когда использовался доступ к пуповинным сосудам, что соответствовало некоторой ауторегуляции потока крови.
Основной проблемой у недоношенных новорожденных является внутричерепное кровоизлияние, наводящее на мысль о целесообразности использования антикоагулянтов в экстракорпоральных поддерживающих системах. Мы использовали значительно сниженные в сравнении с традиционной экстракорпоральной мембранной оксигенацией (ЭКМО) дозы гепарина для поддержания времени активации свертывания в диапазоне 150-180 с. Мы относим сокращение дозы гепарина к снижению площади поверхности нашего контура и включаем покрытия, связанные с гепарином, во все компоненты, контактирующие с кровью. Вероятно, в будущем появятся покрытия, в основе которых не лежит гепарин, что будет еще безопаснее. В то же время имеются данные о том, что кровоизлияние в зародышевый матрикс у экстремально недоношенных детей связано с вентиляцией с положительным давлением, использованием инотропных препаратов и другими вмешательствами. Таким образом, физиологическая поддержка в экстракорпоральной системе без вентиляции или давления может самостоятельно снижать вероятность кровотечения, затрудняя прогнозирование взаимосвязи нашей системы и внутричерепного кровоизлияния.
Критической особенностью нашей системы является закрытая жидкостная среда с непрерывной циркуляцией. Она имеет много преимуществ, наиболее важным из которых является сохранение заполнения легких жидкостью и нормальное сопротивление глотку, необходимое для поддержания нормального давления в дыхательных путях, а также роста и развития легких . Кроме того, жидкостная среда поддерживает защитный барьер, отделяющий плод от внешнего мира. Наконец, внутриутробное заглатывание амниотической жидкости помогает поддерживать гомеостаз плода и потенциально является дополнительным путем питания. Хотя в этом исследовании мы используем простой раствор электролитов, амниотическая жидкость содержит множество трофических факторов и других компонентов, которые могут быть полезны для плода. Важной темой нашего текущего исследования является разработка оптимальной для использования в устройстве “амниотической жидкости”. Непрерывный обмен жидкости, который используется для удаления отходов и поддержания стерильности, аналогичен физиологическому обороту амниотической жидкости. Скорость обмена жидкостью может быть увеличена для устранения любой произошедшей контаминации, и с появлением Biobag мы не отмечали никаких клинически значимых инфекций. К недостаткам жидкостной среды относятся ограниченный доступ к плоду лиц, осуществляющих уход (т. е. физическое обследование, анализ крови, мониторинг гемодинамики), загрязнение внутренней среды в случае необходимости такого доступа и отсутствие быстрого доступа в случае возникновения чрезвычайной ситуации. В нашей системе имеется возможность детального изучения плода с помощью ультразвука, который превосходит физический осмотр и позволяет получить доступ к контуру при любой потребности в сосудистом доступе (мониторинг гемодинамики, анализ крови и поддержание жидкости/питания). Включены стерильные порты, обеспечивающие доступ при необходимости устранения мекония и других манипуляциях, а также клиническое устройство, которое можно быстро открыть в случае, если потребуются реанимационные мероприятия.
Дополнительным возникающим недостатком является восприятие родителями того, что их плод находится в “сумке”. Важно учитывать, что сравнение осуществляется с крайне недоношенным младенцем на вентиляции и в инкубаторе. Мы считаем, что родители будут уверены в том, что плод находится в относительно защищенной и физиологичной среде. Разрабатываемое клиническое устройство будет иметь множество функций, которые позволят родителям поддерживать связь с плодом – ультразвук, темнопольную камеру, позволяющую визуализировать плод в его малоосвещенной среде, а также способность транслировать плоду звуки материнского сердца и живота. Потому мы считаем, что преимущества намного превосходят недостатки воздействия на плод традиционного ухода, который осуществляется за недоношенным ребенком в палате интенсивной терапии.
Наконец, пуповина предполагает единственный физиологический сосудистый доступ для экстракорпоральной поддержки плода. Использование сонной или любой другой периферической артерии не обеспечивает нормального плацентарного кровотока. Кроме того, другие уровни доступа предполагают оперативное вмешательство на плоде для введения и удаления канюли, требуют стабилизации канюли во избежание гибельной деканюлизации и вызывают озабоченность по поводу обеспечения мозгового кровотока или других структур в зависимости от используемого сосуда. Хотя многие исследователи использовали пупочные сосуды, большинство из них, чтобы избежать спазма пупочных сосудов, использовало центральный сосудистый доступ . В отличие от овец или коз, размещение артериальных катетеров у плода человека невозможно и, вероятно, опасно из-за извилистого хода пупочных артерий и необходимости использования крупных канюлей. Напротив, мы стремились использовать естественную устойчивость пуповины к окклюзии, разработав конструкцию “концевого адаптера” для нашей пупочной канюли, который имеет очень короткие канюли и возможность их прикрепления к пуповине. Это позволяет избежать раздражения сосудистой сети или турбулентного потока на конце канюли, что может вызвать сосудистый спазм, эрозию, образование аневризмы или тромбоз. Также конструкция обеспечивает свободно протяженную пуповину между канюлей и плодом, предотвращая возникновение деканюлизации или позиционной окклюзии. В результате, в ходе наших испытаний, мы смогли устранить седативный эффект и поддержать гораздо более стабильные потоки.
В последнее время был разработан альтернативный подход к АВ-насосным и безнасосным системам, в которых используется вено-венозная ЭКМО с притоком в контур через наружную яремную вену и оттоком через пупочную вену. Они позволяют поддерживать экстремально недоношенных ягнят в относительно стабильном физиологическом состоянии на срок до 1 недели , со средним движением в контуре 87.4±17.9 мл/кг/мин. Они также отметили необходимость введения вазопрессоров в течение первых 3 дней, седативный эффект во время исследований и закрытие венозного протока с развитием асцита и плеврального выпота при вскрытии. В дополнение, пять из девяти ягнят умерли в течение 1 недели из-за ассоциированных с катетером осложнений или аритмии. В отличие от этого, в нашей замкнутой жидкостной среде используется эндотрахеальная трубка, заполненная амниотической жидкостью, которая повторяет динамику нормальных дыхательных движений плода. С дальнейшим развитием вено-венозная система ЭКМО сможет предложить альтернативу поддержке недоношенных детей, особенно после вагинального родоразрешения, как защиту от дыхательной недостаточности.
Клиническое применение этой технологии требует дальнейшего изучения и подтверждения безопасности, а также усовершенствования и повышения качества работы самого устройства. Хотя здесь мы сообщаем о применении нашей системы у биологически эквивалентных недоношенных ягнят, плод 105-дневного ягненка значительно больше (1,0-1,5 кг), чем экстремально недоношенный младенец после рождения (видео 5). В пилотных исследованиях на эквивалентных по размеру, но менее зрелых ягнятах (ГВ 85-95 дней, 480-750 г) мы не обнаружили никаких ограничений, ассоциированных с калибром пупочных сосудов или потоками оксигенации, что подтверждает техническую возможность канюляции ПА/ПВ этого размера. Мы наблюдали свидетельства слишком большого потока (300-350 мл/кг/мин) у наших гуманизированных ягнят ранних сроков гестации, приводящего к отекам и ограничению наших экспериментов на срок от 5 до 8 дней. В противоположность более зрелым и развитым эквивалентам ягнят, никаких признаков ауторегуляции потока в контуре не наблюдалось. Это предполагает, что существует тонкий баланс между адекватным и избыточным током в контуре, а способность компенсировать чрезмерный ток и супра-физиологическое давление в правом предсердии может зависеть от зрелости плода. Поскольку скорректированный по массе сердечный выброс и размер пупочной артерии практически идентичны и плодов ягненка, и человека, мы полагаем возможным размещать 8-10 канюль в пупочные сосуды человека. Мы разработали канюли для быстрого размещения и предполагаем возможность канюлировать пуповину человека и инициировать поток в контуре в срок <2 минут, находящийся в пределах временного промежутка, который является критическим для процессов оксигенации головного мозга плода . Это возможно, по крайней мере, первоначально, благодаря модифицированной процедуре “EXIT” в 50-60% случаев родов на крайне малых сроках, которые возможно предусмотреть и разрешить путем кесарева сечения. Введение процедуры EXIT потребует центральной экспертизы и введения дополнительного риска, а также явится потенциалом для долгосрочной, опосредованной гистеротомией, заболеваемости матери, и все эти риски будет необходимо включить в ненаправленное консультирование перед процедурой. Возможность размещения младенца в системе после вагинального родоразрешения или для устранения контаминации после случая или в случае хориоамнионита останется на уровне опыта, но станет важна, если позволит предотвратить или обратить вспять спазм сосудов или заражение.
Исходной клинической целевой группой для подобной терапии, вероятно, станет 23-25-недельный экстремально недоношенный новорожденный. В настоящее время заболеваемость и смертность в этой популяции, по-видимому, оправдают общую нуждаемость в этой технологии в случае, если в клинических испытаниях будет уменьшено количество драматических исходов. Будущие разработки могут позволить лучше прогнозировать преждевременное рождение младенцев и генетически прогнозировать младенцев с высоким риском смертности и заболеваемости, обусловленной преждевременными родами . Это, в свою очередь, позволит стратифицировать риск потенциальных пациентов и улучшить отбор пациентов, которым пойдет на пользу данная процедура. Важным моментом является то, что размещение в системе не станет препятствием стандартному ведению экстремально недоношенных детей. Например, останутся возможными введение пренатальных глюкокортикоидов, а также быстрый переход к стандартной неонатологической помощи недоношенным в случае, если система не оправдала себя. До 22-23 недель гестации имеются вероятные физиологические и технические ограничения, которые увеличивают риск и снижают потенциальные преимущества этой терапии. Нашей целью является не расширение существующих пределов жизнеспособности, а предложение альтернативы для улучшения исходов у тех новорожденных, которые нуждаются в реанимационных мероприятиях и уходе в отделении реанимации новорожденных. Наконец, смысл этой технологии выходит за рамки клинического применения у экстремально недоношенных новорожденных. Потенциал для применения в лечебных целях может включать лечение задержки развития плода, возникшей в результате фетоплацентарной недостаточности или выхаживание недоношенных с угрозой преждевременных родов после фетальных вмешательств или фетальной хирургии. Эта технология может также обеспечить возможность ранней коррекции и терапии до начала легочного дыхания детей, страдающих врожденными пороками сердца, легких или диафрагмы. Многие вмешательства, связанные с фетальной фармакологией, генотерапией или лечением стволовыми клетками, можно было бы облегчить, устранив возможность воздействия материнского организма и обеспечив прямую доставку терапевтических агентов к изолированному плоду.
В заключение, наша система предлагает интригующую экспериментальную модель для разрешения фундаментальных вопросов, касающихся роли матери и плаценты в развитии плода. В настоящее время достигнута долгосрочная физиологическая поддержка плода, отделенного от системы “мать-плацента-плод”, что позволит изучить относительный вклад этого органа в созревание плода.
