Научные основы открытия молекулярных механизмов, контролирующих циркадные ритмы.

Нобелевская премия по физиологии и медицине в 2017 году была вручена Джеффри Холлу, Майклу Ройзбашу и Майклу Янгу за открытие молекулярных механизмов, контролирующих циркадные ритмы. Циркадные ритмы задаются внутренними биологическими часами, определяющими наступление дня и ночи и оптимизирующими физиологические и поведенческие реакции организма. Хотя способность живого организма адаптироваться к смене дня и ночи была давно известна, существование внутренних циркадных часов окончательно был подтверждено лишь в XX веке. В 1971 году Сеймур Бензер и Рональд Конопка выделили мутантов плодовой мухи дрозофилы, которые демонстрировали отклонения в нормальном 24-часовом цикле развития куколки и локомоторной активности. Экспериментально было определено, что мутации затрагивают один и тот же ген, позже названный геном per. Десять лет спустя Холл и Ройзбаш, работая совместно в Брандейском университете, и Янг из университета Рокфеллера изолировали и выделили ген per. Однако, определение его структуры и аминокислотной последовательности не помогли сразу пролить свет на молекулярный механизм циркадных ритмов. Ряд открытий, в том числе идентификация Холлом, Ройзбашем и Янгом других генов, работающих совместно с геном per, в конечном итоге привели к формированию такого понятия как транскрипционно-трансляционная обратная связь (Transcription-Translation Feedback Loop (TTFL)). Согласно данному механизму, транскрипция гена per и его партнёра гена timeless подавляется продуктами их собственной генной активности — белками PERIOD (PER) и TIME-LESS (TIM), что создает условия для независимого колебания уровня экспрессии соответствующих генов. В то время механизм транскрипции не был до конца понятен, и потому самоподдерживающийся циркадный механизм TTFL представлялся новой парадигмой. Дальнейшие изыскания выявили ряд взаимосвязанных циклов обратной связи транскрипции и трансляции, сопряжённых со сложной сетью реакций. Они включают регулируемое фосфорилирование белка и распад компонентов TTFL, сборку белкового комплекса, ядерную транслокацию и другие посттрансляционные модификации, создающие колебания с периодом примерно в 24 часа. Циркадные колебания в пределах отдельных клеток по-разному изменяются в ответ на модулирующие ритмогенные сигналы и контролируют различные физиологические параметры, такие как фазы сна, температуру тела, секрецию гормонов, артериальное давление и обмен веществ. В новаторских исследованиях Холла, Ройзбаша и Янга был выявлен важнейший физиологический механизм, объясняющий циркадную адаптацию, и его ключевая роль в здоровье человека и развитии патологии.
Как работают циркадные ритмы?
Ключевой особенностью живых организмов на Земле является их способность адаптироваться к окружающей среде. В разных географических точках присутствуют разные условия среды, и живые организмы для повышения шансов на выживание адаптируются к тем воздействиям, которые преобладают в их зоне обитания. Однако, повсеместно, вследствие вращения Земли вокруг своей оси, присутствуют значительные изменения освещённости и температуры в течение астрономических суток. Для адаптации к подобным переменам большинство организмов выработали внутренние биологические часы, которые предугадывают дневные и ночные циклы и помогают им оптимизировать физиологические процессы и поведенческие реакции. Этот ежедневный внутренний ритм известен как “циркадный”, от латинских слов “circa” означающего “вокруг”, и ”dies” означающего “день”. Циркадные ритмы являются очень древним элементом, закрепившимся в ходе эволюции. Они обнаруживаются у различных форм жизни от одноклеточных цианобактерий и простейших до всех многоклеточных организмов, включая грибы, растения, насекомых, грызунов и людей. Циркадную систему образуют такие элементы, как автономный 24-часовой генератор ритма или осциллятор, устанавливающий или настраивающий связь внутреннего ритма с внешними раздражителями (так называемыми цайтгеберами или времязадавателями), такими как свет, и выводные механизмы, обеспечивающие своевременное планирование физиологических процессов.
От ритмов к часам
Сведения о том, что поведение и физиологические процессы живых организмов находятся под влиянием суточного режима, задокументированы давно. Принято считать, что первые данные появились по результатам наблюдений за движениями листьев и цветков у растений. Например, листья мимозы закрываются ночью и открываются с наступлением дня. В 1729 году французский астроном Жан Жак д’Ортуа де Майран поместил мимозу в темноту и отметил, что листья продолжают ритмично открываться и закрываться в соответствующее время суток, что указывает на эндогенное происхождение суточного ритма (Рис. 1). Спустя почти 200 лет немецкий физиолог растений и пионер исследований циркадного ритма Эрвин Бюннинг искусно подсоединил листья бобового растения к кимографу (прибору для записи механических колебаний) и зафиксировал движения листьев во время стандартных циклов дня и ночи, а также при условии постоянного освещения. Он заметил, что ритм движения листьев оставался неизменным. На ближайшие десятилетия стали актуальны споры о том, регулировали ли циркадное поведение у растений и животных эндогенные часы, или этот ритм являлся лишь простой реакцией на внешние раздражители. В конце концов, в XX веке существование эндогенных циркадных часов стало признанным фактом.
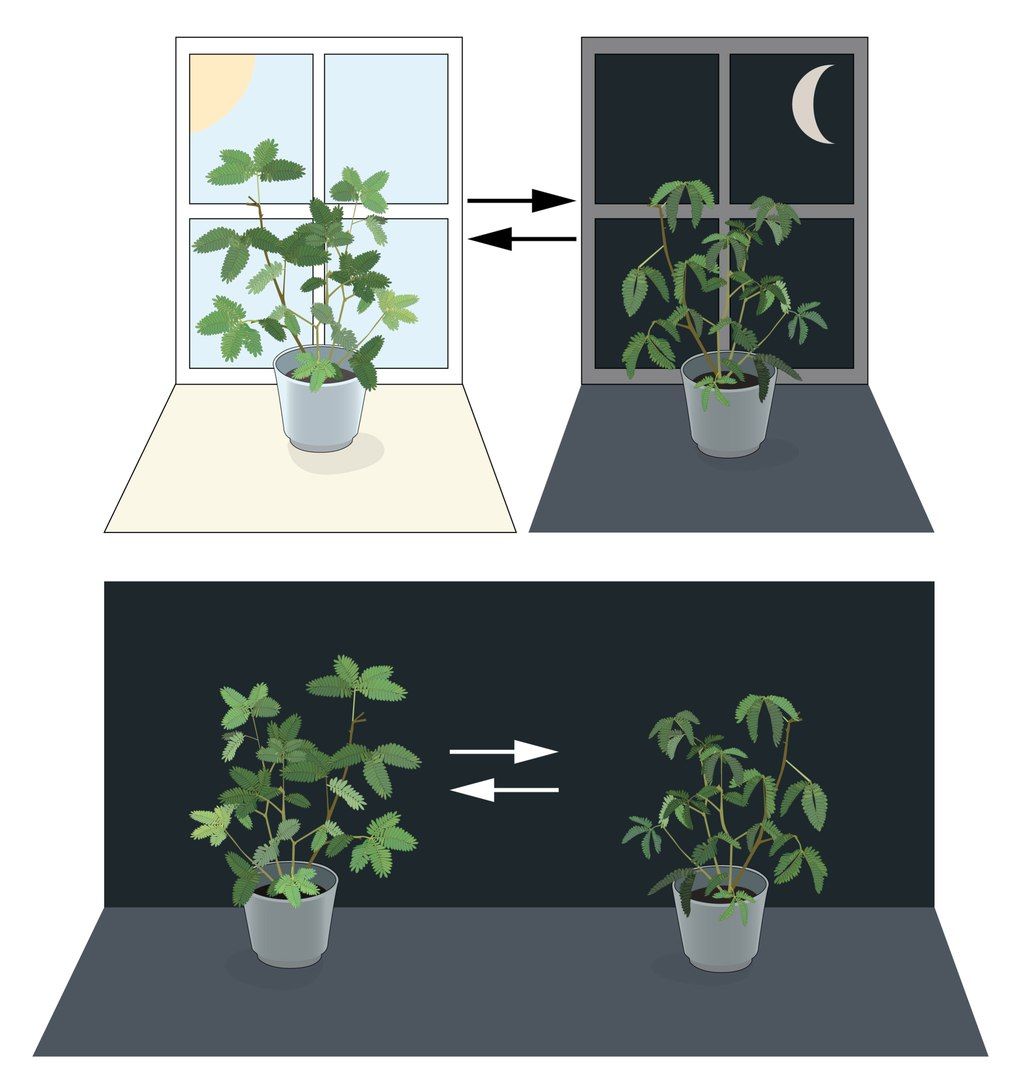
Наследование циркадных ритмов и генов биологических часов
Со временем, помимо периодических движений листьев, были обнаружены и иные важные физиологические проявления, контролируемые внутренними часами, а наследование циркадных ритмов стало рассматриваться как результат естественного отбора. Классические исследования Эрвина Бюннинга в 1930-х годах показали, что циркадные ритмы в растениях могут быть унаследованы даже от родительских особей, подвергавшихся нециркадному световому воздействию, и что скрещивания между сортами с разными периодами дают растения с промежуточными циклами. К середине 1960-х годов сложилось организованное сообщество ученых-хронобиологов, изучающих биологические часы, и стала оформляться цельная концепция генов биологических часов.
Примерно в это же время Сеймур Бензер и его ученик Рональд Конопка, работая в Калифорнийском технологическом институте, приступили к исследованиям по выявлению мутантных плодовых мух с изменёнными циркадными фенотипами. В отличие от некоторых генетиков и специалистов по поведению того времени, Бензер твёрдо верил, что на конкретные поведенческие реакции может влиять действие отдельных генов и что это можно продемонстрировать, изолируя организмы с нестандартным поведением, несущие мутации в конкретных генах. Используя классическую стратегию химического мутагенеза, Бензер и Конопка выделили три разных вида мутантных мух, демонстрировавших отклонения в стандартном 24-часовом цикле развития куколки и локомоторной активности (Konopka and Benzer, 1971).
Один мутантный вид был аритмичным, у другого был более короткий период продолжительностью 19 часов, а третий имел более длинный цикл — 28 часов. Картирование генов с использованием известных в то время маркеров позволили примерно локализовать все три мутации в одной и той же области Х-хромосомы плодовой мухи. Тесты на комплементацию позволили установить, что все три мутации затрагивают один и тот же ген, позже названный геном per. Исходя из этого, Бензер и Конопка предполагали, что мутантный вид с аритмичным циклом несёт в себе нонсенс-мутацию, которая инактивирует ген, а мутанты с более длинными и короткими периодами имеют миссенс-мутации, которые каким-то образом меняют функцию продукта гена на противоположную. Будущие исследования показали, что эти предсказания были верными.
Хотя Бензер перешёл к работе по другим направлениям, Конопка продолжил изучение локализации гена per, чтобы с большей точностью отобразить его расположение на хромосоме. Однако, ген per не был молекулярно клонирован и секвенирован до середины 1980-х годов, когда это удалось сделать Джеффри Холлу и Майклу Розбашу из университета Брандейса и Майклу Янгу из университета Рокфеллера (Bargiello and Young, 1984; Bargiello et al., 1984; Reddy et al., 1984; Zehring et al., 1984). Тогда ген биологических часов был выделен, и была определена его молекулярная структура. Но ни конкретная идентификация гена, ни клонирование и секвенирование его комплементарной ДНК не указывали на молекулярный механизм циркадных часов.
Цикл обратной связи транскрипции-трансляции
В годы, последовавшие за клонированием гена per, было предложено несколько моделей, объясняющих то, как его белковый продукт PER может функционировать для обеспечения циркадных колебаний. Была предложена модель “мембранного градиента”, в которой PER играл роль насоса для создания градиента, который спадал бы за счёт светочувствительных каналов при достижении порогового значения. В другой модели белок PER был представлен как протеогликан, который соединяет клетки, тем самым облегчая образование межклеточных связей через щелевые контакты.
Прорыв был наконец достигнут с подтверждением наличия PER-антител. Первым результатом стало определение 24-часового колебания концентрации PER-белка в нейронах головного мозга мух с максимальным значением в ночное время (Siwicki et al., 1988). Для иРНК, кодируемой геном per, также были выявлены суточные колебания концентраций в клетках мозга мух, что указало на зависимость цикличности белка PER от цикличности иРНК гена per. Интересно, что пик уровня иРНК гена per наблюдался ранней ночью, за несколько часов до пика концентрации белка PER (Hardin et al., 1990). Значим тот факт, что ген per с миссенс мутацией был не способен обеспечить циклические колебания концентрации иРНК гена, но белок PER дикого типа смог восстановить циклическую экспрессию иРНК. Исходя из этих наблюдений, родилась модель саморегулируемой отрицательной обратной связи, при которой накопление белка PER приводит к ослаблению экспрессии иРНК гена per (Hardin et al., 1990). Впоследствии было обнаружено, что белок PER относится к нуклеопротеинам и перемещается между ядром клетки и цитоплазмой с определённой заданной периодичностью, подтверждая идею о том, что он является регулятором транскрипции (Liu et al., 1992).
В последующем исследовании Янг обнаружил ген timeless, вспомогательный ген, влияющий на циркадные ритмы (Myers et al., 1995; Sehgal et al., 1995). В серии последовательных экспериментов лаборатория Янга выявила, что уровни иРНК гена timeless также обладают 24-часовым периодом колебаний, и что TIM может напрямую присоединяться к PER, влияя на его локализацию в ядре и концентрацию, блокируя распад PER (Gekakis et al., 1995; Sehgal et al., 1994; Vosshall et al., 1994). Важно отметить, что цикл экспрессии гена per был нарушен у мух с мутацией гена timeless, и наоборот, циркадные циклы в экспрессии гена timeless были расстроены у особей с мутантным геном per. (Sehgal et al., 1994, 1995). Эти результаты позволили окончательно обозначить концептуальные рамки TTFL как механизма обеспечения циркадных ритмов через ауторегуляцию генов биологических часов (Рис. 2А). В то же время пока не был окончательно ясен механизм транскрипции, что давало почву для существования различных теорий.
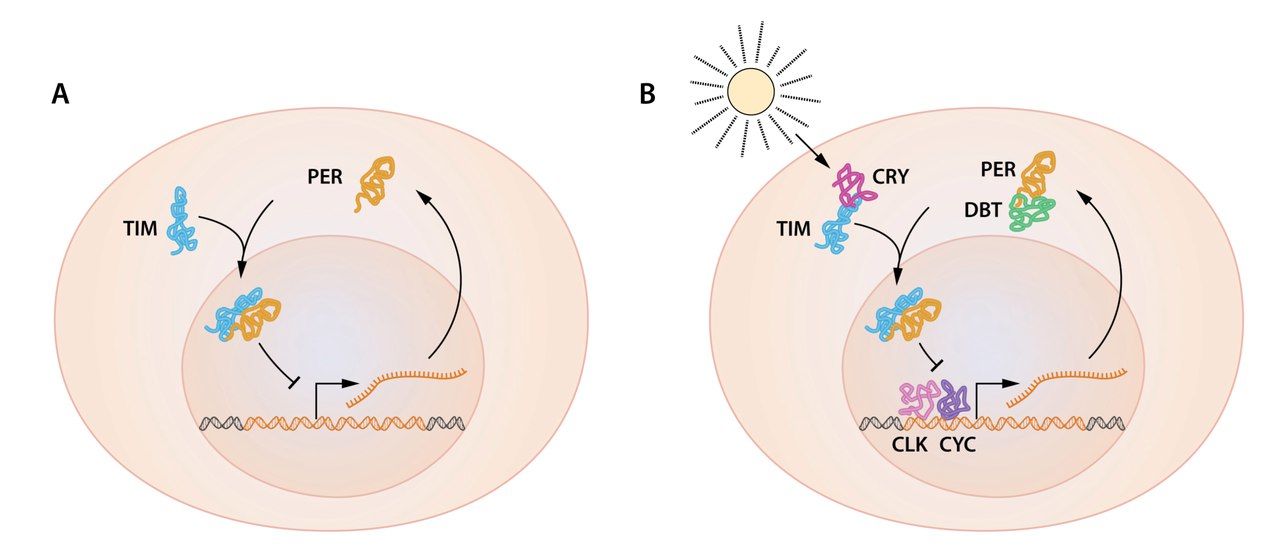
b | Вспомогательные белки необходимы при регуляции колебаний гена per. TIM белок, кодируемый геном timeless, также осциллирует и взаимодействует с белком PER. Это взаимодействие имеет критическую важность для накопления в ядре белка PER и репрессии гена per. DBT-белок кодируется геном doubletime. DBT представляет собой протеинкиназу, которая фосфорилирует PER, приводя к его разрушению. DBT-опосредованный распад белка PER обуславливает задержку между накоплением мРНК гена per и его продуктом. CLK и CYK, кодируемые часовыми генами и цикл-генами, являются двумя факторами транскрипции, которые активируют ген per.
Очевидно, что открытие самоподдерживающегося механизма TTFL является совершенно новой парадигмой. Однако, принцип, по которому активировалась транскрипция генов per и timeless, оставался неизвестным. Этот вопрос разрешился с обнаружением часового и цикличного генов (Allada et al., 1998; Rutila et al., 1998). Часовой ген был впервые идентифицирован у мышей Джозефом Такахаси (King et al., 1997). Взаимодействующие друг с другом продукты часового гена CLOCK (CLK) и CYCLE (CYC) содержат основные домены ”спираль-петля-спираль“ (bHLH) и связываются с определёнными участками соответствующих генов, тем самым положительно регулируя их транскрипцию. В последующих исследованиях было выяснено, что TIM и PER выступают как отрицательные регуляторы активности CLK, замыкая таким образом циркадную петлю обратной связи (Darlington et al., 1998).
Современные рабочие модели циркадных молекулярных часов чрезвычайно сложны и включают в себя множество дополнительных компонентов, способствующих стабильности и циркадной периодичности (Hardin, 2011). Важно отметить, что, поскольку реакции транскрипции и трансляции, как правило, являются быстрыми, то для совершения 24-часовых колебаний основной механизм транскрипционно-трансляционной обратной связи должен осуществляться с существенной задержкой. Это достигается обширным комплексом реакций, включающих в себя регулируемое фосфорилирование белков и распад компонентов TTFL, сборку белкового комплекса, ядерную транслокацию и другие посттрансляционные модификации (Hardin, 2011). Ключевые данные, проливающие свет на основополагающий механизм такой задержки, были получены после открытия Янгом гена doubletime, кодирующего протеинкиназу DOUBLETIME (DBT), которая, в свою очередь, фосфорилирует PER и увеличивает скорость его распада (Price et al., 1998). Добавочные белки объединяют сигналы извне, которые могут влиять на внутренние часы (рисунок 2B). К примеру, свет может активизировать белковый продукт криптохромного гена (CRY) и способствовать его связыванию с TIM, что приводит к протеасомному распаду последнего (Ceriani et al., 1999; Emery et al., 1998). С наступлением утра TIM распадается, благодаря чему PER может быть фосфорилирован DBT и впоследствии расщеплён.
Циркадные ритмы у других организмов
Механизмы TTFL также лежат в основе работы циркадных ритмов и у других многоклеточных организмов, включая людей. Некоторые гомологи ключевых часовых белков дрозофил, включая CLK и PER, играют аналогичную роль в циркадных часах млекопитающих (Papazyan et al., 2016). И хотя растения в основном используют факторы транскрипции, которые не гомологичны присутствующим у дрозофил, TTFL является универсальным базовым принципом (Nohales and Kay, 2016). Тем не менее у цианобактерий был найден другой тип циркадных колебаний, который зависит не от транскрипции, а от последовательности реакций фосфорилирования белка (Tomita et al., 2005). Примечательно, что циркадный ритм может быть воспроизведен in vitro с использованием очищенных часовых белков цианобактерии и АТФ (Nakajima et al., 2005). Независимая от транскрипции осцилляция, вызванная гиперокислением пероксиредоксина, также была описана в эукариотических клетках, в том числе и в эритроцитах человека (O’Neill et al., 2011; Ray and Reddy, 2016). Физиологическая обоснованность таких TTFL-независимых механизмов осцилляции неизвестна. Тем не менее эти результаты свидетельствуют о том, что в клетках млекопитающих могут работать альтернативные механизмы генерации циркадных колебаний.
Подгонка и синхронизация биологических часов
Циркадная программа регулируется как на центральном, так и на периферическом уровне. У млекопитающих центральный водитель ритма, функционирующий как основной управляющий элемент циркадных часов, расположен в супрахиазматическом ядре (SCN) гипоталамуса. Сетчатка генерирует сигнал об уровне освещённости и передаёт эту информацию в SCN, которая синхронизирует свои собственные нейронные клеточные часы. Центральные часы регулируют циркадные ритмы по всему телу посредством гуморальных факторов и периферической вегетативной нервной системы. Однако способность к экспрессии циркадных генов широко распространена по всему организму, и большинство периферических органов и тканей могут в изолированном состоянии производить циркадные изменения своих физиологических параметров (Balsalobre et al., 1998). Таким образом, циркадная система животных напоминает скорее часовой магазин, а не отдельные часы. Это сделало актуальным вопрос о том, какое количество часов можно эффективно синхронизировать (Mohawk et al., 2012).
Периферические часы могут синхронизироваться как с помощью SCN, так и с помощью сигналов внешней среды, таких как режим питания, физическая активность и температура. Периферийные часы в разных тканях контролируют соответствующие физиологические параметры — синтез глюкозы, метаболизм липидов и секрецию гормонов (Panda, 2016). В свою очередь, эти параметры функционируют как калибровочные сигналы для часов в тканях по всему телу, возвращаясь в конечном счёте к SCN. Таким образом, циркадная система организма представляет собой сеть взаимосвязанных осцилляторов и цепей обратной связи. Контакт между центральными и периферическими часами, а также различные способы воздействия на них внутренних и внешних сигналов — это активная область исследований, открытая для новых свершений.
Циркадная биология и здоровье человека
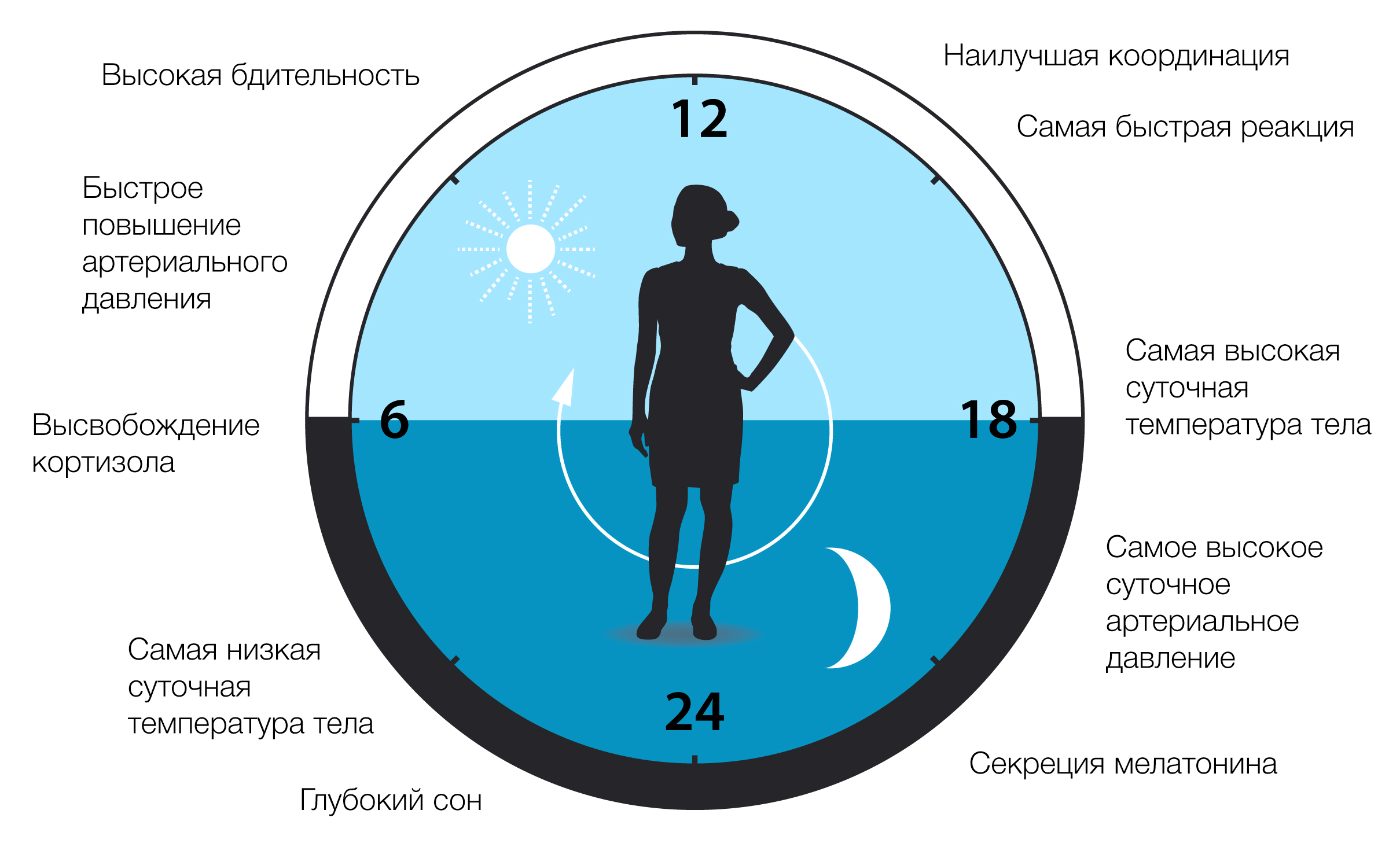
Хронобиология влияет на многие аспекты нашей физиологии. Например, циркадные часы участвуют в регуляции режима сна, пищевого поведения, секреции гормонов, артериального давления и температуры тела (Рис. 3). Молекулярные часы также играют важную роль локально во многих тканях. Абляция часовых генов на животных моделях вызывает аритмичную секрецию таких гормонов, как кортикостерон и инсулин (Son et al., 2008). Часовые гены также оказывают серьёзное влияние на обмен веществ посредством контроля глюконеогенеза, чувствительности к инсулину и системных колебаний уровня глюкозы в крови (Panda, 2016). Сон жизненно необходим для нормальной функции мозга, а дисфункция циркадной системы ассоциируется с расстройствами сна, а также с депрессией, биполярным расстройством, когнитивными функциями, механизмами формирования памяти и некоторыми неврологическими заболеваниями (Gerstner and Yin, 2010). В редких случаях нарушения в фазах сна связаны с мутациями в циркадных генах, что приводит к преждевременным или задержанным циклам сна-бодрствования. (Patke et al., 2017; Toh et al., 2001). Исследования показали, что хроническая рассинхронизация между нашим образом жизни и ритмом, заданным нашими эндогенными циркадными часами, может быть связана с повышенным риском различных заболеваний, включая рак, нейродегенеративные заболевания, нарушения обмена веществ и воспаление. Предпринимаются усилия по разработке подходов в хронобиологии и фармакологических решений для коррекции периода, фазы или амплитуды циркадных часов для улучшения здоровья человека (Hirota and Kay, 2015).
Выводы
Открытие самоподдерживающихся циклов обратной связи транскрипции/трансляции в качестве центрального компонента молекулярного механизма, с помощью которого часовые гены контролируют циркадные колебания в клетках и тканях, легло в основу новой парадигмы в нашем понимании того, как организмы подстраиваются и адаптируются к регулярным ежедневным переменам в окружающей среде, таким как уровень освещённости. Плодотворные открытия трёх лауреатов, проливающие свет на фундаментальный физиологический механизм, позволили циркадной биологии превратиться в обширную и динамично развивающуюся область исследований, имеющую важное значение для нашего здоровья и благополучия.
