Лечение болезни Паркинсона в 2017 году
Болезнь Паркинсона (БП) считается одной из наиболее вариабельных и сложных нозологий, встречающихся в клинической практике. Основой терапии данного заболевания является долгосрочное назначение дофаминомиметиков и предшественников дофамина, однако оно требует постоянной калибровки дозы и, по возможности, дополнительного лекарственного, психотерапевтического и хирургического лечения. Кроме того, БП проявляется множеством как моторных, так и немоторных нарушений, что может усложнять ее диагностику и лечение.
Диагностика и мультидисциплинарный подход к терапии
Недавно диагностические критерии БП были расширены и теперь учитывают также аносмию, запоры и нарушения фазы быстрого сна — проявления болезни, наступающие в самые ранние сроки и обычно предшествующие классическим симптомам в виде ригидности, тремора и шаркающей походки. Также к симптомам БП были отнесены тревожность, депрессия, апатия, расстройства функции мочевого пузыря и другие немоторные проявления. Отметим, что Управление по контролю за пищевыми продуктами и лекарствами США (FDA) одобрило радионуклидную визуализацию с использованием транспортеров дофамина как метод дифференциальной диагностики БП от эссенциального тремора, однако эти методы редко используются из-за своей дороговизны.
Современный мультидисциплинарный подход к лечению БП включает в себя ЛФК, эрготерапию, логопедические занятия, улучшающие речь и глотание, методы нейропсихологии, психологическое консультирование и социальную реабилитацию. Пациентам с БП требуется постоянный мониторинг сопутствующих заболеваний: гипертонической болезни, сахарного диабета, сердечной недостаточности и т.д. Пациенты с БП имеют повышенные риски остеопороза и меланомы, следовательно, должны проходить скрининг минеральной плотности костей согласно гериатрическим рекомендациям и ежегодную онкодерматологическую проверку. В последние годы отмечается тенденция к расширению системы паллиативного лечения для улучшения помощи как пациентам, так и персоналу или родственникам, которые о них заботятся.
Существенную эффективность показало использование в терапии физических упражнений, в том числе аэробных, силовых нагрузок и тай чи.
Фармакологическая терапия
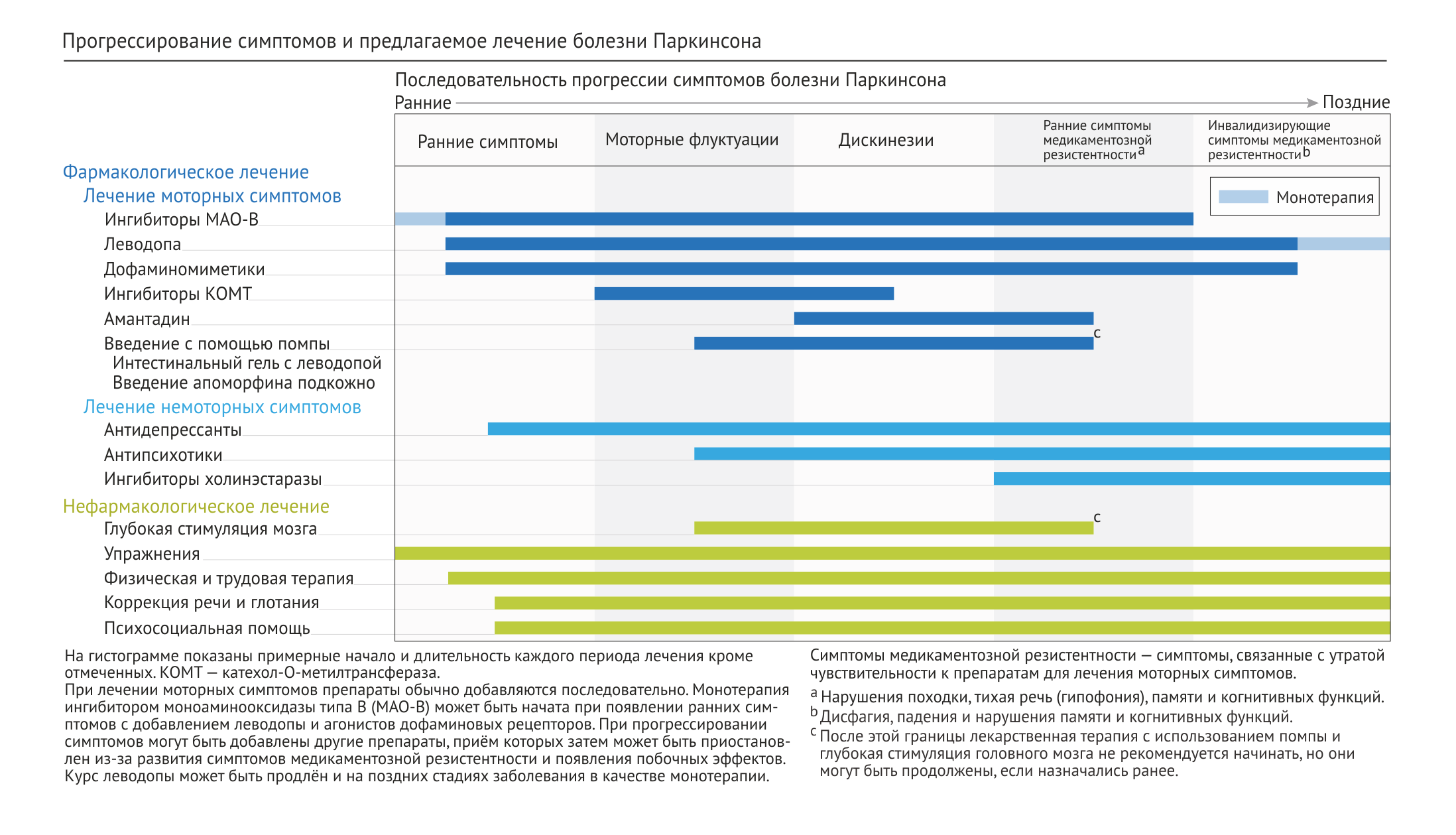
Два десятилетия дебатов о раннем использовании леводопы создали ощутимую неопределенность в отношении начала лечения. Результаты двух клинических испытаний позволяют предположить, что не следует откладывать назначение препарата. Леводопа показала себя как безопасное и эффективное лекарственное средство, а его назначение оправдано непосредственно после постановки диагноза. Агонисты дофамина, ропинирол и прамипексол, также демонстрируют безопасность и эффективность, однако их использование в 2‒3 раза увеличивало риск развития расстройств контроля над импульсами. Последнее несколько снизило энтузиазм в отношении раннего назначения агонистов дофамина, особенно в отсутствие возможности постоянной корректировки дозы и интервала принятия препаратов, что необходимо для устранения побочных эффектов в виде дискинезии и моторных флуктуаций.
Современных клиницистов особенно интересуют два основных вопроса о лечении недавно выявленной БП — каким препаратам отдавать предпочтение в начале лечения болезни и какие средства могут замедлить прогрессирование болезни. В недавнем исследовании, охватившем 800 пациентов с БП, ингибитор МАО-В селегилин не замедлял прогрессирования БП, но замедлял снижение клинических эффектов леводопы и облегчал двигательные проявления болезни. Разагилин, новый ингибитор МАО-В, был протестирован в недавнем испытании с отложенным стартом с участием 1176 пациентов. Результаты оказались противоречивы: только пациенты, принимавшие препарат в дозе 1 мг (но не 2 мг) достигли результатов, указывающих на замедление потери моторных функций. Таким образом, препарат не достиг критериев замедления прогрессирования БП.
В обзоре Общества Расстройств Движения (MDS) рекомендует назначать один из многих дженериков либо брендовых препаратов из группы ингибиторов МАО при ранней БП для облегчения начальных двигательных проявлений и замедления снижения клинических эффектов леводопы. Ингибиторы МАО-В в низких дозах можно безопасно комбинировать с антидепрессантами.
Леводопа — препарат короткого действия (с периодом полувыведения 1‒2 часа), вводимый в комбинации с карбидопой. Вероятность возникновения леводопа-индуцированных дискинезий в большей мере зависит от дозы препарата и продолжительности заболевания, нежели от времени начала лечения препаратом. У половины пациентов, получающих леводопу в течение 5 лет, развивались моторные флуктуации и дискинезии. Эти эффекты можно облегчить путем корректировки дозы и интервалов приема препарата, а также назначением ингибиторов МАО-В или катехол-о-метилтрансферазы, хотя последние могут в дальнейшем увеличить проявления дискинезии. В нескольких рандомизированных исследованиях была показана эффективность амантадина в отношении связанных с БП дискинезий.
Агонисты дофамина, такие как прамипексол и ропинирол, имеют более долгий (до 6‒8 часов) период полувыведения и реже вызывают дискинезии, однако они менее эффективны в отношении двигательных проявлений БП. Если судить по публикациям за период последних трех лет, то в широкую практику вошло использование комбинации низких доз леводопы и агонистов дофамина на ранних стадиях БП, чтобы извлечь максимальную выгоду из синергического эффекта, избежав дозозависимых побочных проявлений. Агонисты дофамина на основе алкалоидов спорыньи (например, бромокриптин) в настоящее время не рекомендуются к назначению больным БП из-за своей способности вызывать фиброз клапанов сердца и пневмофиброз. В случае трудностей с приемом или усвоением пероральных дофаминергических препаратов можно назначать подкожное введение апоморфина. .
Опыт многих исследователей показывает, что немоторные проявления БП оказывают не меньшее влияние на качество жизни больных, чем двигательные симптомы. Последние рекомендации MDS указывают на необходимость облегчения таких симптомов БП, как депрессия, деменция, психотические проявления, запоры и гиперсаливация. В меньшей степени, но тем не менее важным MDS называет лечение следующих проявлений: ортостатической гипотензии, сексуальной дисфункции и апатии. Клозапин, кветиапин и пимавансерин могут бороться с психотической симптоматикой, не ухудшая моторной функции у пациентов с БП.
Глубокая стимуляция головного мозга и инфузионная терапия
Ещё одним прорывом в лечении болезни Паркинсона при проявлении тяжёлых моторных симптомов является глубокая стимуляции головного мозга (ГСГМ) . Клинические испытания показали, что ГСГМ эффективна при лечении тремора, дискинезии, моторных флуктуаций и в период отены дофаминомиметиков и предшественников дофамина. Глубокая стимуляция субталамического ядра и бледного шара одобрены FDA. Проведены рандомизированные исследования с участием 251 пациента, в результате которых были показаны положительные стороны использования ГСГМ на ранних стадиях и у молодых пациентов, особенно у пациентов с моторной флуктуацией. В 2015 году FDA одобрила использование геля, в состав которого входит энтеральная суспензия кардидопа/леводопа. Эта лекарственная форма может быть введена напрямую в тонкую кишку с использованием внешнего медицинского насоса, предоставляющего выбор для пациентов с тяжёлыми проявлениями устойчивых к медикаментозному лечению моторными флуктуациями.
Персонализированная терапия
С 2017 года подход к лечению пациентов с болезнью Паркинсона подразумевает персонализированную терапию и внимание изменениям симптоматики. Клиницисты должны быть компетентны в диагностике кластеров моторных и немоторных симптомов, а также в составлении исчерпывающей симптом-специфичной стратегии, которая может стать причиной вовлечения специалистов из разных сфер, включая неврологов, нейропсихиологов, психиатров, нейрохирургов и специалистов реабилитационных служб. Клиницисты должны также осознавать, что болезнь Паркинсона является динамичным заболеванием, поэтому схемы лечения должны меняться вместе с прогрессированием болезни и сменой кластеров симптомов. Комбинация медицинского лечения с упражнениями и, в некоторых случаях, с хирургическим вмешательством может улучшить качество жизни большинства пациентов с болезнью Паркинсона и превращать потенциально инвалидизирующее заболевание в пригодное для жизни состояние.