Молекулярные основы эпителиально-мезенхимального перехода и его роль в развитии и метастазировании опухоли.

Случалось ли вам когда-нибудь желать себе обладания каким-нибудь сверхъестественным умением? Например, становиться невидимым или проходить сквозь стены? Думаю, многие не раз грезили в детстве о том, какие ловкие штуки могли бы проворачивать, будь у них какая-то эдакая способность, ставящая на порядок выше нашего мира, подчинённого обыденным устоям и правилам. Вероятно, клетки нашего организма тоже не все хотят быть такими же, как большинство, и при определённых обстоятельствах обзаводятся новыми способностями, действительно отличающими их от остальных. Но чем может обернуться такая эгоистичность для целого организма? Как вариант — зарождением опухолевого очага и стремительным распространением клеток, которые уж точно больше не серая масса, а целая гетерогенная популяция, настоящие бунтари, лишённые альтруизма и любви к своим собратьям по организму. И в сегодняшнем посте речь поведём именно о том, каким образом клетки одного типа могут принимать иную форму и какое место это событие занимает в развитии и распространении опухоли.
Под эпителиально-мезенхимальной трансформацией (ЭМТ) понимается процесс, при котором покоящиеся эпителиальные клетки теряют свои межклеточные контакты и принимают мезенхимальную форму. Они приобретают способность к миграции через базальную мембрану, а значит, могут по кровеносному или лимфатическому руслу попасть в любые сколь угодно отдалённые от своего исходного местонахождения ткани, где путём обратной трансформации в эпителиальные клетки (мезенхимально-эпителиальный переход) формируют новые структуры. Физиологически этот процесс играет значимую роль при заживлении ран и в ходе эмбрионального развития организма. Так, например, ЭМТ лежит в основе формирования сердца, закладки большинства краниофациальных структур, а также скелетных мышц и периферической нервной системы. Да и вообще, ни один организм не разовьётся дальше стадии бластулы, не будь эпителиально-мезенхимального перехода. Однако в то же время данное явление находит своё место и в контексте патологической физиологии. ЭМТ способствует прогрессии опухолевых заболеваний за счёт того, что озлокачествленные эпителиальные клетки получают способность к проникновению в сосудистое русло, то есть, им открывается прямой путь к метастазированию. Также эпителиальные клетки, претерпев ЭМТ, могут быть задействованы в фибротических процессах: чрезмерная продукция белков внеклеточного матрикса фибробластоидными клетками может вести к функциональным нарушениям той или иной ткани.
Хотя уже в конце XIX в. эпителиальные и мезенхимальные клетки были известны как два основных типа клеток, а процесс перехода между этими двумя типами был описан в 1908 г., эпителиально-мезенхимальный переход как таковой был идентифицирован как самостоятельный процесс впервые лишь в 1982 г. Вскоре после этого было обнаружено, что если инкубировать эпителиальные клетки в среде, в которой были культивированы фибробласты, то эпителиоциты разобщаются и превращаются в мигрирующие мезенхимальные клетки. Поначалу фактор, определённый как ответственный за данную трансформацию, получил обозначение “scatter factor”, а позднее был назван фактором роста гепатоцитов (HGF), поскольку была обнаружена его роль в качестве митогена для клеток ткани печени, участвующего в регенерации печени. В экспериментах in vitro было указано на то, что HGF опосредует ЭМТ посредством активации тирозинкиназных рецепторов c-Met, кодируемых протоонкогеном. Помимо HGF и другие факторы роста осуществляют вклад в индукцию ЭМТ путём стимуляции тирозинкиназных рецепторов (как in vitro, так и in vivo), как, например, фактор роста фибробластов (FGF), инсулиноподобный фактор роста (IGF), эпителиальный фактор роста (EGF). Кроме того, большое значение придаётся трансформирующему фактору роста бета (TGF-β), который берёт на себя ключевую роль в инициации и поддержании ЭМТ как в процессе эмбрионального развития, так и при опухолевой прогрессии. Часто перечисленные факторы действуют синергетически, усиливая эпителиально-мезенхимальный переход.
Характеристика пусковых факторов и вовлечённых сигнальных путей имеет огромное значение, поскольку трансформационный процесс рассматривается непосредственно как терапевтическая мишень в контексте разработки лекарственных препаратов, направленных на борьбу с фиброзами и инвазивными опухолями. Целесообразным было бы ингибировать и пути сигнальной передачи, которые наряду с ЭМТ способствуют также ангиогенезу.
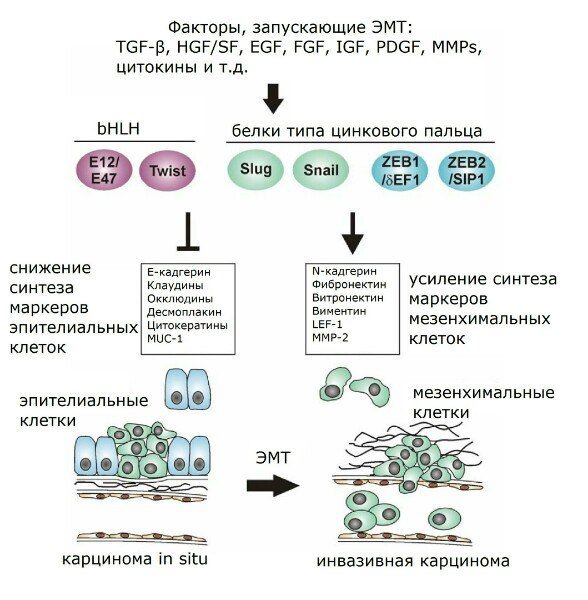
Рисунок 1 | Факторы, запускающие ЭМТ.
Итак, в ходе ЭМТ эпителиальные клетки теряют свою апикобазальную полярность и приобретают фибробластоподобный фенотип. Вследствие потери контактов с соседними клетками эпителиоциты высвобождаются из системы межклеточных связей в организованной эпителиальной ткани. После реструктуризации актинового цитоскелета клетки могут мигрировать через экстрацеллюлярный матрикс, что опосредовано тем, что на этой стадии клетки в состоянии синтезировать характерные мезенхимальные белки, дающие возможность устанавливать клеточно-матриксные связи. Также клетки вырабатывают матриксдеградирующие протеазы, разрушающие базальную мембрану и облегчающие тем самым инвазию трансформированных клеток в кровеносное и лимфатическое русло. Давайте остановимся теперь на каждом пункте чуть подробнее.
Плотные контакты (tight junctions), связывающие клетки в эпителиальных тканях, служат для поддержания целостности ткани, обеспечивают взаимодействие клеток друг с другом, а также выполняют барьерную функцию, принимая участие в регуляции проницаемости эпителия путём ограничения парацеллюлярного транспорта, и придают клеткам полярность благодаря своей организации преимущественно в апикальной области (zona occludens). Формируются плотные контакты за счёт трансмембранных белков окклюдинов и клаудинов, которые связываются с актиновым цитоскелетом через внутриклеточные белки, как например, ZO-1 (zona occludens protein 1). Адгезионные контакты (adherens junctions) представляют собой гомодимерные межклеточные контакты, характеризующиеся связью через классические кадгерины (находятся в зависимости от ионов кальция; типичные примеры — Е-кадгерин, N-кадгерин). Пронизывающие мембрану кадгерины связаны, опять же, с внутренней стороны с цитоскелетом посредством бета- и альфа-катенинов и винкулина или плакоглобина. Десмосомы, распределяющие силы напряжения по всему объёму ткани, противостоят разрывам и смещениям, то есть, важны для стабилизации ткани. Десмосомы соседних клеток связаны друг с другом за счёт трансмембранных десмосомальных кадгеринов (десмоколлины и десмоглеины), а также скреплены с кератиновыми волокнами с помощью цитоплазматических партнёров — плакоглобина и десмоплакина. Десмосомы и адгезионные контакты классификационно причисляются к заякоривающим соединениям, а плотные контакты — к запирающим.
Таким образом, при утрате того или иного соединения какой-либо клетки с окружающими содержание соответствующих контактных белков резко снижено. По этой причине эти белки годятся для трансформационного статуса эпителиальных клеток. Например, в качестве маркеров ЭМТ нередко используются многие из уже упомянутых белков — ZO-1, бета-катенин, Е-кадгерин, а также цитокератин. Снижение экспрессии или функциональной активности Е-кадгерина является крайне важной информацией о развитии опухоли, поскольку наблюдается в канцерогенезе множества злокачественных опухолей и связано с индукцией ЭМТ, а потому представляется и весьма существенным признаком инвазивного роста опухоли. Ослабление адгезионных контактов осуществляется как путём передислокации Е-кадгерина из цитоплазматической мембраны в цитоплазму, так и опосредованно через генетическую регуляцию. Белки типа цинкового пальца Snail и Slug препятствуют транскрипции Е-кадгерина, зацепляясь на специальном сайте связывания промотора гена Е-кадгерина (Е-бокс, Enhancer Box). Также Snail и Slug регулируют активацию TGF-β через Smad3. Кроме того, FGF и HGF оказывают влияние на межклеточные контакты через активирование Slug. Slug (но не Snail) принимает участие и в ЭМТ-ассоциированном заживлении ран, что совпадает с данными по различиям экспрессии гена Slug, полученными в исследованиях культуры иммортализованных нетуморогенных кератиноцитов линии НаСаТ и линии человеческих эпителиоцитов почек НК-2: если в культуре НаСаТ TGF-β индуцировал синтез только Slug, то в ренальных эпителиоцитах контроль был сосредоточен именно на белке Snail.
Среди прочих факторов, оказывающих влияние на экспрессию Е-кадгерина, хотелось бы упомянуть EF1 (энхансер-связывающий фактор гамма-кристаллина), SIP1, c-Fos. EF1 и SIP1 могут управлять как транскрипцией генов белков Smad, так и, аналогично белкам Snail и Slug, напрямую взаимодействовать с промотором гена Е-кадгерина и, блокируя экспрессию Е-кадгерина, провоцировать развитие инвазивного фенотипа клетки. Эктопическая экспрессия c-Fos, например, в эпителии молочной железы, может вести к трансформации. Вообще, при кратковременной активации c-Fos потеря апикально-базальной полярности могла бы быть обратима, однако в этом случае аутокринное воздействие продуцируемого TGF-β становится инструментом поддержания ЭМТ. Так, в клетках линии НаСаТ к началу ЭМТ наблюдалась опосредованная через ERK (extracellular signal-regulated kinases) стимуляция трансформирующим фактором роста бета эктопической активности c-Fos.
Также с промотором гена Е-кадгерина способен связываться белок семейства bHLH (basic helix-loop-helix) E2A. В норме Е2А транскрипционно неактивен и представлен в виде димеров с белками ингибиторами дифференцировки (ID). В культивируемых на микроносителях эпителиальных клетках ID2 и ID3 оказываются целью воздействия TGF-β и ВМР7 (bone morphogenetic protein 7, костный морфогенетический белок): TGF-β сдерживает экспрессию ID2, вследствие чего активируется Е2А, который снижает транскрипцию гена Е-кадгерина; а ВМР7 проявляет себя антагонистически, повышая экспрессию ID2 и защищая тем самым эпителиальные клетки от трансформирующих влияний.
Важным регулятором ЭМТ как in vitro, так и in vivo проявил себя также относящийся к белкам bHLH фактор транскрипции Twist, эктопическая экспрессия которого становится причиной снижения транскрипции опять же Е-кадгерина, альфа-, бета- и гамма-катенинов. Также Twist способствует активности таких мезенхимальных маркеров, как фибронектин, виментин, альфа-гладкомышечный актин (alpha-SMA), N-кадгерин. А некоторые прочие факторы транскрипции, кроме регуляции прочности адгезионных контактов, оказывают влияние и на другие характеристики ЭМТ. Так, ID2 может препятствовать синтезу alpha-SMA; SIP1 регулирует экспрессию виментина, а в некоторых типах клеток наряду с белком Snail повышает экспрессию матриксной металлопротеиназы 2 (ММР-2); Snail может влиять на ряд существенных для ЭМТ генов (было обнаружено в клетках меланомы), среди которых гены ММР-2 и малых G-белков семейства Rho (RhoA).
Разобравшись с потерей межклеточных контактов, обратимся к тому, в чём же заключается реструктуризация цитоскелета. Для эпителиальных клеток в связи с их полярностью характерен так называемый пояс актина, волокна которого участвуют в создании адгезионных и плотных контактов, являя собой мощное дополнение периферическому актину, также задействованному в поддержании межклеточных соединений. В мезенхимальных клетках актин, напротив, представлен в виде филоподий (толстые пучки актина, цилиндроподобно вытянутые в сторону передвижения клетки), ламеллоподий (тонкие сети на переднем конце клетки, инициирующие движение клетки вперёд; придают клеточной мембране характерный внешний вид) и стрессовых волокон (пучки коротких актиновых филаментов с добавлением миозиновых филаментов; простираются параллельно продольной оси тела клетки и, сокращаясь, тоже продвигают клетку вперёд), которые поддерживают миграцию клеток. Актиновые стрессовые волокна связаны со внутренней поверхностью цитоплазматической мембраны посредством интегринов и фокальных адгезионных комплексов, имеющих в своём составе структурные белки (талин, винкулин, альфа-актинин) и некоторые протеинкиназы (например, FAK — киназа фокальных контактов). Полимеризация актина находится под контролем белков семейства Rho, куда относятся, к примеру, Rho, Rac и Cdc42, которые, приобретая активированную форму, инициируют образование как актиновых стрессовых волокон, так и адгезионных комплексов: Rac опосредует формирование ламеллоподий, Cdc42 принимает участие в образовании филоподий. Таким образом, при запуске ЭМТ белки семейства Rho представляют собой наиважнейшие целевые структуры для влияния TGF-β.
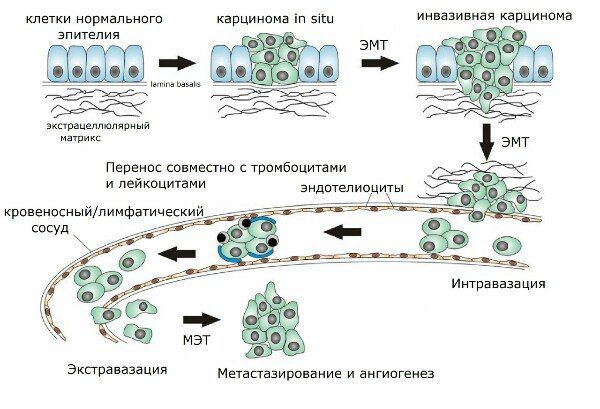
Рисунок 2 | Этапы метастазирования.
После того, как произошло переформирование внутриклеточных актиновых структур, клетка может приступать к миграции сквозь джунгли внеклеточного матрикса. Для этого ей необходимо умение образовывать новые контакты между собственными интегринами и белками матрикса. Интегрины оснащены специальными участками для связывания с матриксными белками, и благодаря RGD-последовательности интегрины распознают белки матрикса. Кроме чисто механического связывания, трансмембранные интегрины могут подвергаться контролю по типу inside-out-signalling: например, внутриклеточные киназы, связываясь с внутриклеточными участками интегринов, могут изменять их внеклеточные участки для связывания с лигандами. Но и наоборот, связывание интегринов с лигандами ведёт к внутриклеточному каскаду взаимодействий, следствием которого может быть активация FAK или белков Rho.
Ещё одна важная черта, характеризующая нормальные эпителиальные клетки — связь с базальной пластинкой посредством гемидесмосом. В ходе эпителиально-мезенхимальной трансформации клетки эпителия отделяются от базальной пластинки и начинают разрушать коллаген IV, ламинин, нидоген, из которых она построена. Для этой цели клетки вырабатывают матриксные металлопротеиназы ММР-2 и ММР-9. Структура всех ММР во многом сходна. Поначалу все ММР синтезируются как неактивные предшественники — Pro-MMPs, которые затем активируются после ферментативного отщепления продомена (эти продомены почти у всех ММР представляют собой консервативные последовательности, в которых присутствует цистеин, ответственный за связывание цинка в активном центре протеазы; поэтому только в отсутствие продомена цинк беспрепятственно связывается с активным центром и активирует протеазу). Также ММР обладают субстратспецифичными связывающими мотивами, на чём основано их разделение на подгруппы.
После такого краткого пробега по основным этапам ЭМТ хотелось бы завершить пост и после прочтения предложить вам ознакомиться с замечательным переводом Медача, посвященным эпителиально-мезенхимальной пластичности и её роли как регулятора опухолевой прогрессии. Перевод читать тут: vk.cc/6AwriY
Источники:
- Epithelial-Mesenchymal Transitions in Development and Disease
- CDK5 is essential for TGF-β1-induced epithelial-mesenchymal transition and breast cancer progression
- Behrens et al.: The role of E-cadherin and scatter factor in tumor invasion and cell motility.
- Ras and TGF-beta cooperatively regulate epithelial cell plasticity and metastasis: dissection of Ras signaling pathways.
