Обмен нуклеотидов
Нуклеотиды являются вездесущими компонентами жизни, участвуя в большинстве биохимических реакций. АТФ является энергетической валютой клетки, производные аденина служат коферментами, циклические нуклеотиды цAMФ и цГМФ играют роль вторичных мессенджеров. Наконец, нуклеотиды — это мономерные звенья РНК и ДНК.
Пути биосинтеза нуклеотидов служат мишенью для противоопухолевых и некоторых антибактериальных препаратов, а нарушения в путях их катаболизма ловят ступни в капкан.
Строение нуклеотидов
Нуклеотиды состоят из трех компонентов: азотистого основания, пентозы и фосфата. Нуклеотид без фосфата называется нуклеозидом. Азотистые основания — это производные пурина и пиримидина (рис. 1).
Рисунок 1. | Главные азотистые основания. Некоторые названия отражают историю открытия этих соединений. Гуанин был выделен из перуанского гуано (птичьего помета), тимин — из тимуса быка, аденин — из поджелудочной железы. Урацил получил свое название от мочевой кислоты, из которой его пытались синтезировать. Б. Структурная формула нуклеотидов. В дезоксирибонуклеотидах OH-группа при 2’-углероде замещена на H.
В ДНК и РНК пуриновые основания одинаковые — аденин и гуанин, а пиримидиновые разные: в ДНК тимин, в РНК урацил и в обеих цитозин. Дезоксирибонуклеотиды, образующие ДНК, содержат 2’-дезокси-D-рибозу, а рибонуклеотиды РНК — D-рибозу. Термин «нуклеотид» может обозначать как рибо-, так и дезоксирибоформы.
Биосинтез пуринов
Синтез пуринов de novo сложен и энергозатратен, поэтому в физиологических условиях пул пуринов поддерживается в основном за счет путей их реутилизации (исключение составляют быстроделящиеся клетки). Всасывание нуклеотидов из пищи мало, так как почти все остатки нуклеиновых кислот катаболизируются эпителием тонкой кишки.
Аденин и гуанин образуются из общего предшественника — инозината (IMP). Пуриновое ядро постепенно собирается на остатке 5-Фосфорибозил-1-пирофосфата (PRPP). Все четыре атома азота происходят из аминокислот: два из глутамина, один из аспартата и один из глицина (рис. 2–4).
Рисунок 2. | Синтез пуриновых нуклеотидов de novo: часть 1, образование пуринового кольца инозината. После стадии ③ R обозначает 5-фосфо-D-рибозильную группу. Снизу изображено происхождение атомов пуринового кольца.
Зависимость синтеза пуринов от фолатов на стадиях 3 и 9 означает, что ингибиторы метаболизма фолиевой кислоты являются непрямыми ингибиторами синтеза пуринов, а значит, и ингибиторами деления клетки.
Рисунок 3. | Биосинтез AMP и GMP из IMP.
Регуляция этого пути сложна и мало изучена. Известно, что AMP, GMP и IMP ингибируют его по механизму отрицательной обратной связи. В недавних исследованиях [1] было показано, что шесть ферментов биосинтеза пуринов собираются в пуриносому, являющую собой новый уровень организации ферментов.
Рисунок 4. | Обзорная схема синтеза пуриновых нуклеотидов.
Реутилизация пуринов
Свободные пуриновые основания постоянно высвобождаются в клетке в процессе катаболизма нуклеотидов, и их большая часть повторно используется для синтеза нуклеотидов в более простом пути, нежели синтез de novo.
Один из таких путей настолько прост, что состоит из одной реакции, катализируемой аденозинфосфорибозилтрансферазой: Аденин + PRPP → AMP + PPi
Свободный гуанин и гипоксантин реутилизируются в похожем пути под действием гипоксантин-гуанин-фосфорибозилтрансферазы. Мутация гена вышеназванного фермента вызывает синдром Лёша — Нихена. Это сцепленное с мужским полом заболевание, манифестирующее в раннем возрасте и характеризующееся деформирующим артритом и неврологическими нарушениями. Мальчики с синдромом Лёша — Нихена плохо ориентируются в пространстве, очень враждебны и склонны к саморазрушению вплоть до откусывания себе пальцев.
Биосинтез пиримидинов
Если при синтезе пуриновых нуклеотидов азотистое основание кусочек за кусочком собирается на остатке рибозилфосфата, то при синтезе пиримидинов к рибозе оно присоединяется уже в готовом виде (рис. 5).
Рисунок 5. | Синтез пиримидиновых нуклеотидов. Стадия 1: Синтез карбамоилфосфата. 2: Конденсация аспартата и карбамоилфосфата с образованием N-карбамоиласпартата. 3: Внутримолекулярная конденсация, катализируемая дигидрооротазой с образованием шестичленного гетероцикла (дигидрооротата). 4: Окисление дигидрооротата до оротата. 5: присоединение к оротату рибозо-5-фосфата (PRPP). 6: Декарбоксилирование оротодилата до уридилата. Ферменты 5 и 6 стадий образуют комплекс и называются УМФ-синтазой.
Источник: Campbell M. K., Farell S. O. Biochemistry
Мутации гена UMPS, кодирующего УМФ-синтазу вызывают оротацидурию — редкое (описано лишь 20 случаев) аутосомно-рецессивное заболевание, проявляющееся тяжелой мегалобластной анемией, задержкой развития вследствие дефицита пиримидиновых нуклеотидов и повышенным содержанием оротовой кислоты в моче.
Нуклеозидмонофосфаты превращаются в нуклеозидтрифосфаты под действием нуклеозидмонофосфаткиназ и нуклеозиддифосфаткиназ. Последние необычны тем, что являются неспецифичными ни по основанию, ни по пентозе.
Цитидилатсинтетаза образует цитидилат из UTP.
Прежде чем описать синтез тимидилата, необходимо упомянуть об образовании дезоксирибонуклеотидов, так как его синтез de novo возможен только из дезоксирибонуклеотидного предшественника.
Образование дезоксирибонуклеотидов
Строительные блоки ДНК образуются из соответствующих рибонуклеотидов непосредственным восстановлением 2’-углеродного атома рибозы с образованием 2’-дезоксипроизводного. Реакция катализируется рибонуклеотидредуктазой, ее субстраты — нуклеозиддифосфаты, в ней также участвуют тиоредоксин и тиоредоксинредуктаза.
Рисунок 6. | Восстановление рибонуклеотидов до дезоксирибунклеотидов.
Регуляция рибонуклеотидредуктазы весьма необычна и служит для поддержания баланса четырех нуклеотидов, необходимых для синтеза ДНК. Каждая субъединица имеет 2 типа регуляторных центров: один центр регулирует активность (ATP +, dATP-), второй влияет на субстратную специфичность. Например, если со вторым центром связывается ATP или dATP, фермент начинает отдавать предпочтение восстановлению UDP или CDP, а когда UTP и СTP становится слишком много, возвращается к ADP. ATP выступает главным стимулятором восстановления всех рибонуклеотидов, а dATP в больших концентрациях выключает фермент.
Биосинтез тимидилата
Непосредственный предшественник тимидилата — dUMP. Превращение катализируется тимидилатсинтазой и сопряжено с окислением метилентетрагидрофолата до дигидрофолата (рис. 7).
Рисунок 7. | Синтез тимидилата.
Источник: Campbell M. K., Farell S. O. Biochemistry
Синтез тимидилата является мишенью некоторых противоопухолевых препаратов. Так, в химиотерапии используется ингибитор тимидилатсинтазы — фторурацил (вернее, его метаболит FdUMP), ингибитор дигидрофолатредуктазы — аминоптерин и структурный аналог фолата — метотрексат. Потребность раковых клеток в нуклеотидах гораздо выше, чем у нормальных клеток, поэтому они более чувствительны к ингибиторам биосинтеза тимидилата.
Катаболизм нуклеотидов
Катаболизм пиримидинов
С помощью нуклеотидазы и фосфорилазы от пиримидиновых нуклеотидов отщепляются фосфаты и рибоза, а оставшиеся свободные азотистые основания подвергаются дезаминированию и гидрированию (рис. 8).
Рисунок 8. | Катаболизм пиримидинов. Источник: Campbell M. K., Farell S. O. Biochemistry
Пути распада пиримидинов ведут главным образом к NH4+ и далее к мочевине.
Катаболизм пуринов
Пуриновые нуклеотиды теряют свои фосфаты под действием 5’-нуклеотидазы.
Аденилат превращается в аденозин, который дезаминируется аденозиндезаминазой (ADA) с образованием инозина, который гидролизуется нуклеозидазой до гипоксантина и рибозы. Ксантиноксидаза окисляет гипоксантин до ксантина и затем до мочевой кислоты. (рис. 9)
Рисунок 9. | Катаболизм пуриновых нуклеотидов. Общий метаболит катаболизма пуринов — ксантин. Превращение ксантина в мочевую кислоту катализирует ксантиноксидаза. В правом верхнем углу изображена аденозиндезаминаза (ADA)
У большинства млекопитающих мочевая кислота окисляется до более растворимого соединения — аллантоина, однако у человека, далматинов, приматов и птиц она является конечным экскретируемым продуктом катаболизма пуринов, и здесь время поговорить о подагре.
Заболевания, связанные с катаболизмом пуринов
1. Гиперурикемия и подагра.
Повышенное содержание мочевой кислоты в крови называется гиперурикемией (> 360 мкмоль/л для женщин и > 400 мкмоль/л для мужчин). У этого состояния может быть множество причин: дефект генов, отвечающих за экскрецию уратов почками и кишечником, богатая пуринами и/или фруктозой диета, низкоуглеводная диета, голодание, синдром лизиса опухоли, прием препаратов (диуретиков, аспирина, никотиновой кислоты и др.), синдром Лёша-Нихена, большие дозы алкоголя и другие, но всех их можно поделить на два типа: гиперпродукция уратов и снижение их экскреции. Гиперурикемия далеко не всегда сопровождается подагрой, но подагра гиперурикемией — всегда. Подагра — это метаболическое заболевание, характеризующееся отложением кристаллов уратов натрия преимущественно в плюснефаланговых суставах, поражением почек и приступами острого подагрического артрита.
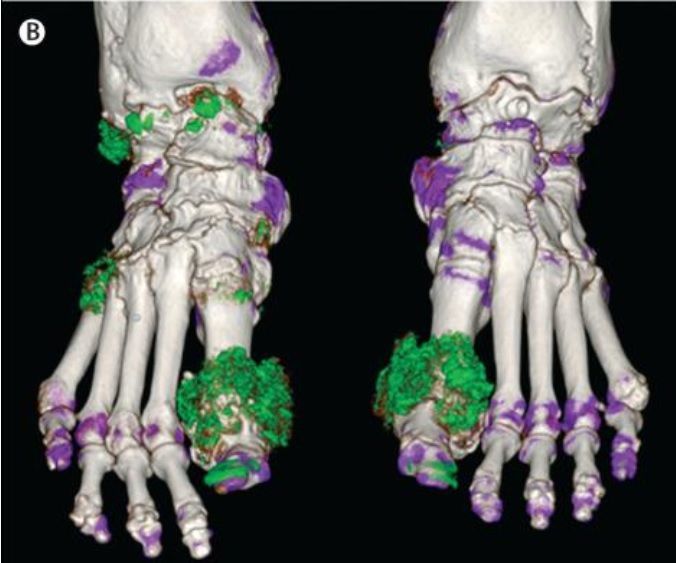
Рисунок 10. | Двухэнергетическая КТ стоп пациента с тофусной подагрой. Депозиты урата показаны зеленым цветом ( на ногтях – артефакт)
Этиология, патогенез и терапия подагры заслуживают отдельной статьи. Здесь я упомяну только о препаратах, влияющих на катаболизм пуриновых нуклеотидов, — ингибиторах ксантиноксидазы (фермента, превращающего ксантин в мочевую кислоту, см. рис. 9). Один из них — аллопуринол, структурный аналог гипоксантина, конкурентный ингибитор ксантиноксидазы. К неконкурентным ингибиторам относится фебуксостат. Оба препарата снижают уровень мочевой кислоты в крови и используются для предотвращения приступов подагры.
2. Дефицит аденозиндезаминазы ведет к одному из типов тяжёлого комбинированного иммунодефицита (SCID, синдром Глянцмана — Риникера, в 30 % случаев вызывается дефицитом ADA), характеризующемуся неспособностью T- и B- лимфоцитов к пролиферации и продукции антител.
Отсутствие аденозиндезаминазы ведет к значительному накоплению dATP, который ингибирует нуклеотидредуктазу, в результате чего возникает дефицит всех дезоксирибонуклеотидов (рис. 11). ADA является Zn-зависимым ферментом, поэтому нарушения в делении лимфоцитов возможны и при дефиците в организме цинка.
Рисунок 11. | Недостаточность аденозиндезаминазы приводит к нарушениям репликации ДНК
Источники
- Pedley A. M., Benkovic S. J. A new view into the regulation of purine metabolism: the purinosome //Trends in biochemical sciences. – 2017. – Т. 42. – №. 2. – С. 141-154.
- Нельсон Д. Л., Кокс М. М., Ленинджер А. Основы биохимии Ленинджера. – 2017.
- Major T. J. et al. An update on the genetics of hyperuricaemia and gout //Nature Reviews Rheumatology. – 2018. – С. 1.
- Garrett R., Grisham C. M. Biochemistry (4th ed., pp. 813-860). Brooks/Cole, Cengage Learning: Belmont, CA. – 2010.
- Campbell M. K., Farell S. O. Biochemistry. Ed ke-5. – 2006.
- Niemeyer C., Flotho C. Hämatologische Erkrankungen //Kinder-und Jugendmedizin. – Springer, Berlin, Heidelberg, 2007. – С. 271-294.
- http://watcut.uwaterloo.ca/webnotes/Metabolism/Nucleotides.html
- https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(16)00346-9/fulltext#articleInformation
