Эндолизины бактериофагов в лечении бактериальных инфекций

Бактериальные инфекции подрывают здоровье человека и входят в перечень ведущих причин смерти по данным ВОЗ. Проблема в последнее время все более обостряется из-за быстрого распространения антибиотикорезистентных штаммов. ESKAPE-патогены (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa и другие виды Enterobacteriaceae) — представители так называемых «супербактерий», которые могут быстро получить резистентность к нескольким классам антибиотиков и способны вызывать множество внутрибольничных инфекций. Пониженная восприимчивость к антибиотикам чрезвычайно затрудняет лечение инфекций ESKAPE, поэтому ученые в настоящее время пытаются расширить спектр альтернативных антибактериальных агентов. Подходящие кандидаты на эту роль — эндолизины — ферменты бактериофагов, разрушающие пептидогликан, основной компонент бактериальной клеточной стенки (КС).
Бактериофаги — повсеместно распространенные вирусы, заражающие бактерии с целью размножения. В конце репродуктивного цикла они лизируют (разрушают) хозяйскую клетку, чтобы частицы вирусного потомства смогли выбраться наружу. Ферменты, ответственные за лизис, получили название эндолизины, поскольку синтезируются в цитоплазме инфицированных бактерий и действуют на них изнутри. Для эффективной работы эндолизинам в большинстве случаев необходимо присутствие белка холина, олигомеры которого формируют отверстия в цитоплазматической мембране (ЦПМ) бактерий. Через холиновые поры эндолизины пересекают ЦПМ и получают доступ к КС. Затем происходит быстрое разрушение КС, приводящее к резкому осмотическому лизису клеток и последующему высвобождению фагов-потомков [2].
Классификация эндолизинов
Эндолизины классифицируют по типам ферментативной активности в отношении пептидогликана. Пептидогликан бактерий — трехмерная решетка из пептидного и гликанового компонентов (рис.1). Полимер, с попеременно расположенными остатками N-ацетилмурамовой кислоты (MurNAc) и N-ацетилглюкозамина (GlcNAc), формирует гликановый компонент, который связан через амидную связь с первой аминокислотой пептидного компонента (чаще всего аланином).
В зависимости от расщепляемой связи в пептидогликане, эндолизины подразделяют на классы: гликозидазы (N-ацетилглюкозаминидазы или N-ацетилмурамидазы), эндопептидазы, специфические амидогиролазы и литические трансгликозилазы. N-ацетилглюкозаминидазы расщепляют гликановый компонент на редуцирующем конце GlcNAc (рис.1А), а N-ацетилмурамидазы, расщепляют гликановый компонент на редуцирующем конце MurNAc (рис. 1B) — последние еще называют мурамидазой или лизоцимом. Амидогидролазы (N-ацетилмурамоил-L-аланин амидазы) расщепляют амидную связь между гликановым (MurNAc) и пептидным (L-аланин) компонентами пептидогликана (рис.1C). Эндопептидазы (протеазы) расщепляют пептидные связи между двумя аминокислотами. Литические трансгликозилазы не являются истинными «гидролазами», поскольку не требуют воды для каталитического расщепления пептидогликана. Как и мурамидазы, они расщепляют связи между N-ацетилмурамовым и N-ацетилглюкозаминовым остатками пептидогликана (рис.1B), но в результате образуют остаток N-ацетил-1,6-ангидро-мурамила и поэтому отнесены к другому механистическому классу.
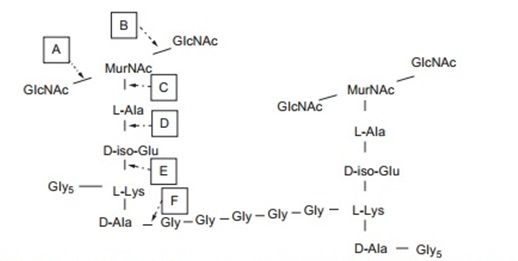
Рисунок 1 | Структура пептидогликана S. aureus с отмеченными сайтами разрезания гидролазами. (А) N-ацетилглюкозаминидаза гидролизует гликановый компонент пептидогликана на редуцирующем конце GlcNAc. (В) N-ацетилмурамидаза («лизоцим») гидролизует гликановый компонент на редуцирующем конце MurNAc. Литические трансгликозилазы разрушают ту же связь, но без участия воды. (С) N-ацетилмурамоил-L-аланин амидаза разрушает амидную связь между MurNAc и первой аминокислотой пептидного компонента. (D-F) Эндопептидазы разрезают амидные связи между двумя аминокислотами, которые могут находиться в составе отдельного пептида (Е) или формировать межпептидные мостики (F) [1]
Структура эндолизинов
Эндолизины, направленные против грамположительных и грамотрицательных бактерий, структурно отличаются друг от друга, поскольку строение КС этих групп бактерий различно. Грамположительные бактерии не имеют наружной мембраны, но их пептидогликан очень толстый, с многочисленными сшивками и поверхностными углеводами и белками. Эндолизины фагов грамположительных хозяев обычно содержат каталитические домены и домены связывания с клеточной стенкой (CBDs, cell wall-binding domains), распознающие эпитопы на поверхности восприимчивых организмов [4].
Пептидогликан грамотрицательных бактерий относительно тонкий и отделен от окружающей среды внешней мембраной. Большинство эндолизинов из фагов грамотрицательных хозяев — небольшие белки, состоящие только из одного каталитического домена. Но существуют и исключения: например, эндолизин бактериофага KZ144, заражающего Pseudomonas, имеет модульную структуру: N-концевой CBD и С-концевую литическую трансгликозилазу [1].
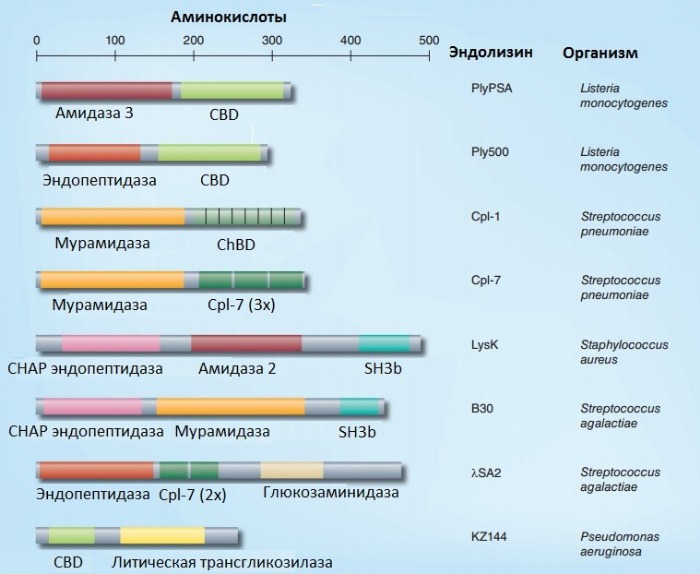
Рисунок 2 | Схематическое представление модульной архитектуры некоторых фаговых эндолизинов. CBD — КС-связывающий домен, ChBD — холин-связывающий домен, Сpl-7 — Cpl-7-подобный КС-связывающий домен, SH3b — бактериальный SH3 домен [1]
Терапевтический потенциал
Эндолизины фагов широко изучались в течение полувека, но вплоть до 2001 г. только in vitro [2]. В лаборатории Fiscetti (Рокфеллеровский университет, США) первыми начали оценивать эффективность эндолизинов на животных моделях человеческих заболеваний. Было обнаружено, что пероральное введение эндолизина стрептококкового бактериофага С1 защищало мышей от колонизации верхних дыхательных путей Streptococcus pyogenes (30% инфицированных особей против 70% инфицированных в контрольной группе). Увеличение дозы препарата привело к полному исчезновению стрептококков через 2 ч после введения. Вдохновившись результатами, в своей статье [3] авторы ввели термин «энзибиотик» для описания терапевтического потенциала эндолизинов.
Вскоре были получены аналогичные результаты для эндолизина Pal из пневмококкового бактериофага Dp-1 [5]. Успех этих двух экспериментов вылился в два крупных гранта от DARPA (Defense Advance Research Project Agency): первый, в свете недавней истории с рассылкой сибиреязвенных спор, был направлен на поиск эндолизинов против B. anthracis, а второй — на получение эндолизинов против новых антибиотикорезистентных патогенов, в частности S. aureus. Терапевтический эндолизин, разработанный группой Fiscetti и направленный против B. anthracis, получил название PlyG. При испытании на мышиной модели бактериемии PlyG спас 68,4 % животных от быстрой смерти. Эта работа удостоилась чести красоваться на обложке Nature (рис.3) и стала первым примером системного применения эндолизинов [5].

Рисунок 3 | Обложка Nature, 22 августа 2002. На фото клетка B. anthracis после обработки PlyG, c выступающими во внешнюю среду участками цитоплазматической мембраны (в белом круге и в верхней части клетки) [5]
В последующих работах были изучены новые свойства эндолизинов. Оказалось, что ферменты с одинаковой специфичностью, но с разными каталитическими активностями (например, амидаза и мурамидаза) проявляют синергизм при совместном применении и при этом практически не влияют на комменсальные бактерии. Узкая специфичность действия характерна для большинства эндолизинов и очень востребована, т.к. способствует уменьшению побочных эффектов, наблюдаемых при использовании антибиотиков широкого спектра действия [5]. Антибиотики могут приводить к селекции резистентных штаммов за счет переноса последовательностей ДНК из устойчивого штамма к восприимчивому, в результате чего возникают устойчивые комменсальные бактерии, которые могут распространять элементы ДНК на соседние штаммы (потенциальные патогены).
На сегодняшний день науке не известны случаи приобретения патогенами устойчивости к эндолизинам, несмотря на то, что авторы нескольких работ очень старались обнаружить такие штаммы. Три патогена: S. pneumonia, S. pyogenes, B. anthracis несколько раз обрабатывали сублетальными дозами эндолизинов, специфичных для каждого вида, после чего выжившие бактерии обработали летальными дозами эндолизинов, но даже в этом случае не обнаружили никаких изменений восприимчивости [1].
Применение эндолизинов в борьбе с грамотрицательными патогенами затрудняется наличием у таких бактерий наружной мембраны, защищающей слой пептидогликана от непосредственного воздействия внеклеточной среды. Чтобы помочь эндолизинам преодолеть внешнюю мембрану, придумали объединять их с различными пермеабилизирующими (повышающими проницаемость мембраны) агентами, такими как этилендиаминтетрауксусная кислота (ЭДТА) и органические кислоты. Например, эндолизин EL188 из фага EL в сочетании с ЭДТА уменьшал количество клеток P. aeruginosa на 4 порядка, тогда как в отсутствие ЭДТА не проявлял антибактериальной активности [7]. Альтернативный путь — создание генно-инженерных эндолизинов, т. н. артилизинов, слитых с липополисахарид-дестабилизирующими пептидами, помогающими переправлять эндолизин через внешнюю мембрану. Артилизины оказались эффективными in vitro против таких патогенов, как Salmonella, E. coli, A. baumannii, P. aureginosa [2]. Например, артилизин Art-175, состоящий из овечьего антимикробного пептида (AMP), способного перемещаться через внешнюю мембрану, и эндолизина KZ144, направленного на P. aeruginosa, уменьшал количество клеток на 4 порядка и не вызывал развитие устойчивых форм.
Поскольку эндолизины являются иммуногенными белками, предположили, что антитела, сформировавшиеся в ответ на их введение, могут привести к неэффективности последующей терапии. Это была серьезная критика, которая, к счастью, не получила экспериментальной поддержки: Loefflier с соавт. обнаружили, что эффективность эндолизина Cpl-1 не снижалась после предшествующего внутривенного введения и образования антител. Влияния на литическую активность не наблюдали даже при смешивании Cpl-1 с Cpl-1-специфической гипериммунной сывороткой кролика. Аналогичные результаты позже были получены другими исследователями для различных эндолизинов и в совокупности подтвердили, что антитела в сопоставимых концентрациях не нейтрализуют гидролитическую активность эндолизинов [5].
На данный момент большинство препаратов эндолизинов находятся в фазе доклинических испытаний. Для их изучения чаще всего используются мышиные модели системной инфекции. Животных заражают смертельными дозами бактерий и спустя несколько часов вводят препарат эндолизина. Чаще всего учитывают такие показатели, как процент выживших особей и формирование нейтрализующих антител. Обобщенная информация об этих экспериментах представлена в таблице 1.
Таблица 1 | Сравнение эндолизинов, протестированных на животных моделях системных инфекций человека [2]
| Эндолизин | Природный / Инженерный |
Патоген |
Животная модель1 |
Способ введения2 |
Режим (доза и время введения) |
Главные результаты |
| Cpl-1 |
П | S. pneumoniae |
Бактериемия |
в/б |
Единичная доза (0.4 или 1 мг/кг) через 1 ч после заражения |
0%-ная выживаемость в контрольной и опытной группах. Сочетание с даптомицином дает ≥ 80% выживаемости |
| Cpl-1 |
И | S. pneumoniae |
Бактериемия |
в/в |
Единичная или несколько доз (2 мг/ особь) через 1 ч или 5 и 10 ч после заражения |
20%-ная выживаемость в контрольной и 100%-ная в опыытной группе При прогрессирующей бактериемии (5 и 10 ч после заражения) все мыши умерли |
| Cpl-1, Pal |
П | S. pneumoniae |
Сепсис | в/б |
Единичная доза (5-200 мкг/ особь) через 1 ч после заражения |
0%-ная выживаемость в контрольной и 100%-ная в опытной группе C-при введении 200 мкг каждого фермента. При введении 5 мкг выживаемость 0%. |
| Cpl-771, Cpl-1 |
И, П | S. pneumoniae | Бактериемия |
в/б |
Единичная доза (25-500 мкг/ особь) через 1 ч после заражения |
0%-ная выживаемость в контрольной группе, ≥45%-ная среди мышей, получивших Сpl-771 и ≥20%-ная среди получивших Cpl-1. При наивысших дозах выживаемость 100% и 30% соответственно. |
| Ply30 |
П | S. suis / S. equi |
Бактериемия |
в/б |
Единичная доза (2 мг/ особь) через 1 ч после заражения |
0%-ная выживаемость в контрольной группе и ≥80%-ная выживаемость в опытной группе через 96 ч после введения препарата |
| PlyPy |
П | S. pyogenes |
Бактериемия |
в/б |
Единичная доза (0.25-0.5 мг/ особь) через 3 ч после заражения |
17%-ная выживаемость в контрольной и ≥90%-ная выживаемость в опытной группе через 72 ч после введения препарата |
| PlySK1249 |
П | S. agalactiae |
Бактериемия |
в/б |
Единичная или несколько доз (22.5-45 мг/кг) через 1 ч или 2, 20 и 24 ч после заражения |
Отсутствие различий между контрольной и опытной группами через 1 ч после введения препарата. Только последовательное введение (2, 20 и 24 h после заражения) увеличило выживаемость на 60% относительно контрольной группы |
| ClyR |
И | S. agalactiae |
Бактериемия |
в/б |
Единичная доза (25-40 мг/кг) через 3 ч после заражения |
0%-ная выживаемость в контрольной группе и ≥25%-ная в опытной Наивысшая доза обеспечивала абсолютную защиту |
| ClyS |
И | S. aureus |
Септицемия | в/б |
Единичная доза (2 мг/мышь) через 3 ч после заражения |
0%-ная выживаемость в контрольной группе и 88%-ная в опытной |
| ClyH |
И | S. aureus |
Бактериемия |
в/б |
Единичная доза (450 или 900 мкг/особь) через 3 ч после заражения |
0%-ная выживаемость в контрольной группе и ≥66.7%-ная в опытной. При наивысшей дозе достигалась 100%-ная выживаемость. Ежедневные инъекции ClyH не оказывали вредного воздействия |
| MR-10 и миноциклин |
П | S. aureus |
Бактериемия |
подкожно | Единичная доза (50 мкг/особь) через 3 ч после заражения |
0%-ная выживаемость в контрольной группе и 100%-ная в опытной. Лечение в отдельности MR-10 или миноциклином дало 35%-ную выживаемость |
| LysGH15 |
П | S. aureus |
Бактериемия |
в/б |
0%-ная выживаемость в контрольной группе и 100%-ная в опытной при введении ≥50 мкг через 1 ч. При введении через 2, 3 или 4 ч выживаемость от 40% до 0% |
|
| CF-301 |
П | S. aureus |
Бактериемия |
в/б |
Единичная доза (0.25-5 мг/кг) через 3 ч после заражения |
0%-ная выживаемость в контрольной группе и ≥20%-ная в опытной при дозах ≥2.5 мг/кг. При наивысшей дозе достигнута максимальная выживаемость – 70%. CF-301 синергичен с ванкомицином или даптомицином |
| MV-L |
П | S. aureus |
Бактериемия |
в/б |
Единичная доза (500 U/особь) через 30 или 60 мин после заражения |
0%-ная выживаемость в контрольной группе и ≥60%-ная в опытной при введении через 60 мин после заражения. При введении через 30 мин достигалась абсолютная защита |
| SAL-1 |
П | S. aureus |
Бактериемия |
в/в |
Несколько доз (12.5-25 мг/кг) через 1, 25 и 49 ч после заражения |
20%-ная выживаемость в контрольной группе и ≥93.3%-ная в опытной. Количество бактерий значительно снизилось в кровяном русле и ткани селезенки |
| 8 эндолизинов и лизостафин |
П, И | S. aureus |
Бактериемия |
в/б |
Единичная доза (200 мкг/особь) через 30 мин после заражения |
30%-ная выживаемость в контрольной группе и 100%-ная в опытной Twort, phiSH2 и P68 обеспечили самую низкую выживаемость: 50%, 60% и 20% соответственно |
| PlyG |
П | B. anthracis |
Сепсис | в/б |
Единичная доза (50 U/особь) через 15 мин после заражения |
0%-ная выживаемость в контрольной группе и 68.4%-ная в опытной. Токсические эффекты отсутствуют. |
| LysEF-P10 |
П | E. faecalis |
Бактериемия |
в/б |
Единичная доза (1-10 мкг/особь) через 1 ч после заражения |
0%-ная выживаемость в контрольной группе и 100%-ная в опытной при дозах ≥ 5 мкг. При наименьшей дозе (1 мкг) выживаемость 20% LysEF-P10 вызывает образование антител, но не теряет активность |
| PlyF307 |
П | A. baumannii |
Сепсис | в/б |
Единичная доза (1 мг/особь) через 2 ч после заражения |
10%-ная выживаемость в контрольной группе и 50%-ная в опытной Эндолизин также устраняет биопленки с катетера in vivo |
1 модельный организм – мышь, если иное не указано; 2 в/в – внутривенно; в/б - внутрибрюшинно
В 2015 году компания ContraFect завершила первую фазу клинических испытаний препарата эндолизина CF-301 против S. aureus. В настоящее время, уже во второй фазе испытаний, ContraFect тестирует CF-301 в лечении бактериемии или эндокардита, вызванных S. aureus, у госпитализированных пациентов во всем мире [6]. На препарат возлагают большие надежды, поскольку в испытаниях in vitro он проявлял высокую активность в отношении биопленок стафилококка. Биопленки — колонии бактерий, которые могут образовываться на поверхности различных имплантатов и тканях макроорганизма — представляют большую угрозу, т. к. в составе биопленок многие патогены становятся на порядок более устойчивыми к антибиотикам, чем их планктонные формы. Устойчивость достигается за счет ограниченного проникновения антибиотиков через слой внеклеточного матрикса биопленок, а также благодаря замедленному росту (некоторые соединения атакуют только активно растущие формы), повышенному накоплению разрушающих антибиотики ферментов и интенсивному обмену генами устойчивости. На рис. 4 видно, что CF-301 способен эффективно разрушать биопленку MRSA за короткий период.

Рисунок 4 | Разрушение биопленки MRSA с использованием CF-301. (А) биопленка MRSA на поверхности катетера, (В) через 30 с после обработки CF-301: большая часть биопленки уничтожена, (С) через 15 мин: катетер стерилен [6]
Другой препарат, направленный против S. aureus, — Staphefekt SA.100 компании Micreos — уже зарегистрирован в Европе. Он предназначен для местного применения, доступен в форме крема на основе цетомакрогола или геля и отпускается без рецепта. Описаны случаи успешного лечения пациентов с хроническими или рецидивирующими дерматозами при использовании Staphefekt SA.100. У мужчины 23 лет с выраженными acne vulgaris кожи лица и туловища через 8 недель применения Staphefekt SA.100 наблюдались заметные улучшения, не сопровождающиеся изменением минимальной подавляющей концентрации препарата (рис.5) [8].
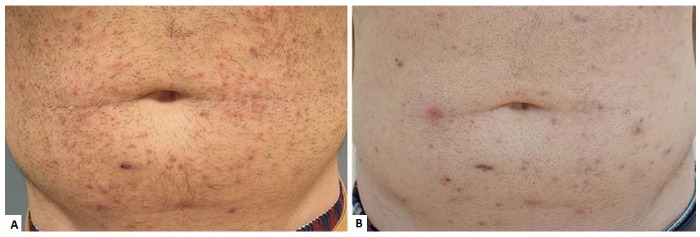
Рисунок 5 | Фолликулит. (А) Исходное состояние: обширные фолликулярные папулы и пустулы, (В) через 8 недель: несколько фолликулярных папул, поствоспалительная гиперпигментация и рубцевание [8]
Другой пациент с диагнозом вторичная бактериальная инфекция нуммулярной экземы уже через неделю после назначения препарата пациент сообщил об улучшении (рис.6).
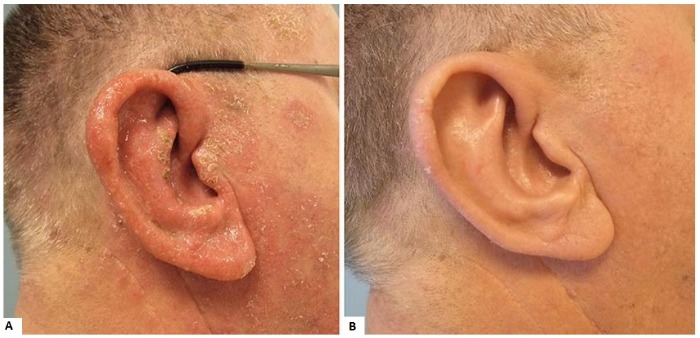
Рисунок 6 | Вторичная инфекция нуммулярной экземы. (А) Исходное состояние: эритремо-сквамозные поражения, образующие покрытые коркой бляшки, опухание уха. (В) 6 недель спустя: неявное эритрематозное пятно с минимальным образованием чешуек [8]
Этапы исследований
На рис.7 схематически представлен поэтапный план исследования эндолизинов. Обычно процесс начинается с in silico идентификации генов эндолизинов в геноме бактериофага. Последовательности эндолизинов высококонсервативны и удобны для биоинформатического поиска с использованием инструментов BLAST. Дальнейшие шаги включают клонирование, экспрессию и очистку ферментов.
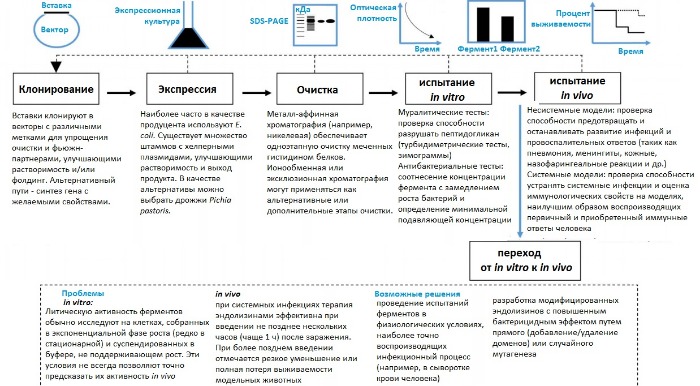
Рисунок 7 | Поэтапное представление процесса поиска фаговых эндолизинов и проверки их терапевтического потенциала [2].
Сложности и ограничения
- В настоящее время не существует стандартизированных методов оценки эффективности эндолизинов in vivo: животных заражают различными дозами патогена при различных путях введения, и это существенно затрудняет сравнение результатов. Cpl-1 — показательный пример нестандартизированных отчетов (табл.1). В одном из исследований наблюдали 100 % выживаемости мышей, получивших Cpl-1 внутривенно через 1 час после заражения, а в другом — при внутрибрюшинном введении препарата через 1 час после заражения, выжили только 30 % мышей. В еще одном исследовании Cpl-1 не оказал никакого положительного эффекта при внутрибрюшинной инъекции.
- В большинстве исследований in vivo эндолизины вводят через 1 или несколько часов после заражения, имитируя лечение ранней бактериемии — довольно редкого клинического проявления. В немногих исследованиях с разным временем введения препарата показано, что при более позднем введении лечение безуспешно. Например, мыши с пневмококковой бактериемией, получившие эндолизин Cpl-1 через 1 час после заражения, показали 100 % выживаемости по сравнению с 20 % выживаемости в контрольной группе. Однако при прогрессирующей бактериемии (введение через 5 часов и 10 часов после заражения) применение эндолизина лишь несколько увеличивало продолжительность жизни по сравнению с контрольной группой, но не влияло на выживаемость (табл.1).
- Эффективность антибактериальной терапии эндолизинами, оцененную in vitro, нельзя с уверенностью экстраполировать на условия живого организма. Высокая эффективность in vitro может не воспроизводиться in vivo, когда клетки находятся в неоптимальных для действия эндолизинов условиях. Кроме того, эндолизины обычно изучают in vitro с использованием клеток в экспоненциальной фазе роста, а не в более поздних физиологических состояниях. Известно, что в некоторых случаях клетки в стационарной фазе оказывались более устойчивыми к лизису, вероятно, из-за модификации пептидогликана (в стационарной фазе происходит ацетилирование и/или N-деацетилирование гликановых цепей и амидирование пептидов — модификации, которые могут мешать действию эндолизинов). Так, например, эндолизин PlyF307, более чем на 3 порядка снижающий число клеток A. baumannii в экспоненциально растущих культурах, лишь на 1 порядок уменьшает их число в культурах стационарной фазы. Таким образом, эффективность эндолизинов следует оценивать не только в разных диапазонах рН, температур и ионных сил, но также при использовании различных условий окружающей среды и клеток в разных физиологических состояниях, имитирующих более вероятный сценарий in vivo [1].
Заключение
Антибиотикоустойчивые патогены подняли планку требований к новым противомикробным препаратам: в идеале они должны устранять возбудителей с множественной устойчивостью, в том числе и в биопленках, и успешно предотвращать дальнейшее развитие резистентности. Эндолизины бактериофагов и артилизины обладают уникальными свойствами, которые делают их идеальными кандидатами на эту роль. Эти ферменты нацелены на узкий диапазон родственных патогенов и не оказывают специфического воздействия на неродственные комменсальные бактерии. Они работают на поверхности клетки патогена и не подвержены действию внутриклеточных механизмов защиты. Помимо активно делящихся клеток, эндолизины действуют на покоящиеся клетки в составе биопленок, с которыми не справляется большинство антибиотиков. Мультидоменная природа эндолизинов позволяет конструировать белки с двумя или более литическими активностями, увеличивая терапевтический потенциал препаратов. Множество лабораторий по всему миру занимаются поиском и испытанием новых эффективных эндолизинов, и ближайшие успехи в данной области, вероятно, станут отправной точкой для широкомасштабного терапевтического использования этих ферментов.
Источники:
- Schmelcher M., Donovan D. M., Loessner M. J. Bacteriophage endolysins as novel antimicrobials //Future microbiology. – 2012. – Т. 7. – №. 10. – С. 1147-1171.
- Oliveira H., São-José C., Azeredo J. Phage-Derived Peptidoglycan Degrading Enzymes: Challenges and Future Prospects for In Vivo Therapy //Viruses. – 2018. – Т. 10. – №. 6. – С. 292.
- Nelson D., Loomis L., Fischetti V. A. Prevention and elimination of upper respiratory colonization of mice by group A streptococci by using a bacteriophage lytic enzyme //Proceedings of the National Academy of Sciences. – 2001. – Т. 98. – №. 7. – С. 4107-4112.
- Абатуров А. Е., Крючко Т. А. Терапевтический потенциал бактериофагов и эндолизинов при лечении острых респираторных инфекций, вызванных бактериальными патогенами //Здоровье ребенка. – 2017. – Т. 12. – №. 6.
- Fischetti V. A. Development of Phage Lysins as Novel Therapeutics: A Historical Perspective //Viruses. – 2018. – Т. 10. – №. 6
- Schuch R. et al. Bacteriophage lysin CF-301: a potent anti-staphylococcal biofilm agent //Antimicrobial agents and chemotherapy. – 2017. – С. AAC. 02666-16.
- Love M. J. et al. Potential for Bacteriophage Endolysins to Supplement or Replace Antibiotics in Food Production and Clinical Care //Antibiotics. – 2018. – Т. 7. – №. 1. – С. 17.
- Totté J. E. E., van Doorn M. B., Pasmans S. G. M. A. Successful treatment of chronic Staphylococcus aureus-related dermatoses with the topical endolysin Staphefekt SA. 100: a report of 3 cases //Case reports in dermatology. – 2017. – Т. 9. – №. 2. – С. 19-25.
