Плацебо, ноцебо и боль: теоретические аспекты и практическое применение

Что мы имеем в виду, когда говорим о «плацебо»? Скорее всего, вы уже сталкивались с этим термином при прочтении статей об исследованиях, где плацебо использовалось для подтверждения эффективности исследуемого препарата.
Можно сказать, что плацебо — это такая «пустышка», вследствие приема которой может наблюдаться определенный положительный эффект, и если он оказывается аналогичен эффекту от применения какого-либо препарата, то эффективность этого лекарственного вещества считается нулевой. Но каким образом в различных исследованиях достигается сам эффект плацебо? Как он работает, на чем основан механизм его применения, действует ли системно, либо же оказывает влияние лишь на отдельные функции?
Для того, чтобы ответить на заданные выше вопросы, необходимо принять во внимание еще одно явление — эффект ноцебо, противоположный плацебо. С данным понятием можно столкнуться крайне редко, и в исследованиях, целью которых не ставится изучение данного явления, оно обычно игнорируется
Плацебо подразумевает под собой не только прием какого-либо вещества, оказывающего терапевтическое действие без соответствующего фармакологического субстрата. На развитие эффекта плацебо влияют также и социальные взаимодействия, такие как отношения между доктором и пациентом (убеждение последнего в благоприятном исходе лечения).
К эффектам плацебо ошибочно приписывают, например, спонтанную ремиссию хронического заболевания; прошедшее со временем «чувство дискомфорта», которое приносило тревогу и субъективно воспринималось пациентом как патология.
Кроме того, имеется человеческий фактор, выраженный в предвзятости исследователя, совершении ошибок в проведении эксперимента, касающегося сравнения эффективности препарата или методики с эффектом плацебо.
В основе формирования эффекта плацебо/ноцебо лежат следующие механизмы:
1. ожидание эффекта от приема лекарства пациентом:
— позитивное/негативное ожидание: вызывает снижение или повышение уровня тревожности;
— ожидание позитивного разрешения болезни: активация «системы вознаграждения»;
2. обучение — закрепление эффекта на фоне полученного опыта (не обязательно личного, возможно внушаемого извне).
Оба эти механизма не являются взаимоисключающими, а, наоборот, дополняют и потенцируют друг друга. Феномен плацебо и ноцебо наиболее часто ярко проявляется при следующих состояниях:
1. субъективная симптоматика, сопровождающая различные заболевания и патологии и проявляющаяся нарушениями психоэмоциональной сферы, такими как:
— повышенная тревожность, раздражительность;
— периодически возникающее чувство дискомфорта, и т. д.;
2. психические расстройства (например, депрессия);
3. боль: острая, хроническая (включая КРБС);
4. экстрапирамидные расстройства (болезнь Паркинсона, хорея различного генеза): эффекты плацебо/ноцебо возникают вследствие дисрегуляции дофаминергической системы, происходящей при этих заболеваниях;
5. заболевания иммунной и эндокринной систем.
Боль
Около 40–50 % населения земного шара испытывают хронические боли различной локализации и степени интенсивности. Характеристика этих болей зависит от их первичной этиологии (пускового фактора), а также индивидуальных особенностей, таких как возраст пациента, его профессия и т. д.
Около 10 % перенесенных случаев острой боли «хронизируются». В принципе, острая боль не является патологической сама по себе (за исключением некоторых случаев, например, боли при травматическом шоке), хотя она и приносит человеку физиологические страдания. У боли, обусловленной ноцицептивным компонентом, выделяют свои функции — защитную и репаративную.
В то же время хроническая боль лишена этих положительных эффектов, характеризующих боль острую. Это — дезадаптивное явление, при котором возникшая хроническая боль перестает быть симптомом, а становится самим заболеванием.
Также важно то, что зачастую один и тот же триггер может вызывать появление боли через разные биохимические пути, и это определяет необходимость выбора терапии в зависимости от биохимического профиля боли, а не ее первичной этиологии.
На возникновение, проведение и восприятие болевых сигналов определенным образом влияет ЦНС, и ее модулирующий эффект играет важную роль как в анальгезии, так и в процессе хронизации боли. Выраженность болевой симптоматики и возникновение хронизации боли определяются в том числе и множеством субъективных и ситуационных факторов, таких как уровень тревожности и страха, недостаток сна, социальное поведение и др. Далее в тексте будут приведены доказательства влияния субъективных параметров на восприятие боли, а также возможности воздействия на них.
Нейробиологические аспекты плацебо и ноцебо в анальгезии
Плацебо и ноцебо проявляют антагонизм друг к другу, изменяя активность различных внутренних систем организма. Одной из них является опиоидная система.
Индуцированная активацией плацебо анальгезия подавляется антагонистом опиоидных μ-рецепторов налоксоном. В противоположность этому, антагонист холецистокининовых рецепторов (ХЦКр) проглумид активирует плацебо-индуцированную опиоидную гипоалгезию (при этом эффект плацебо подавляется агонистом ХЦК-2р пентагастрином).
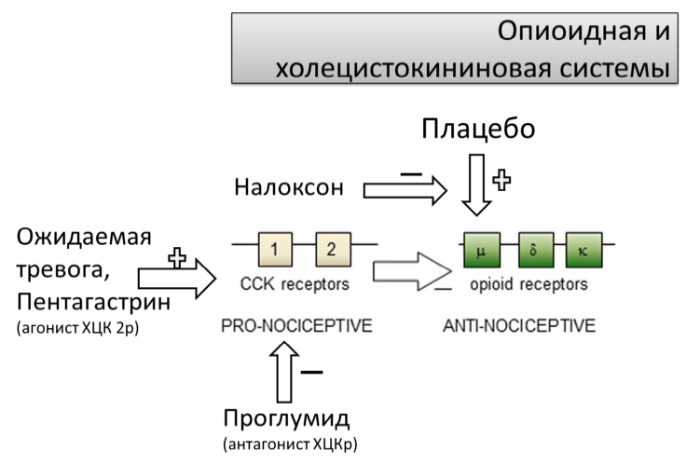
Тем не менее, эксперименты на мышах с инъекцией холецистокинина в ростральную вентромедиальную часть спинного мозга и следующую за этим гипералгезию связывают с многократным повышением при этом продукции PGE2 (простагландина E2) и 5-HT (5-гидрокситриптамина) (подавление синтеза PGE2/5-HT значительно снижает болевую симптоматику).
Также доказательствами активного участия опиоидной системы в плацебо-анальгезии служат ПЭТ-исследования головного мозга. Так у пациентов, получающих агонист опиоидных рецепторов ремифентанил, и пациентов из группы плацебо при проведении ПЭТ была выявлена активность в одних и тех же участках мозга, а именно в дорсолатеральной префронтальной коре (dPFC), передней поясной коре (ACC), островке (инсула) и прилежащем ядре (NAcc) (при этом ремифентанил вызывал гораздо более выраженную активность по сравнению с плацебо).
Кроме того, в экспериментах на мышах удалось установить, что плацебо-анальгезию индуцирует именно активация μ-рецепторов. Могло показаться, что холецистокинин просто подавляет функцию опиоидной системы, при этом не играя роли в формировании эффекта ноцебо. Однако в экспериментальной модели социального стресса («социального поражения», а проще говоря, ежедневного буллинга на протяжении определенного времени, чаще всего в течение 10 дней), созданной на мышах, обусловленная тревогой гипералгезия подавлялась путем приема ХЦК-2р антагониста (CI-988).
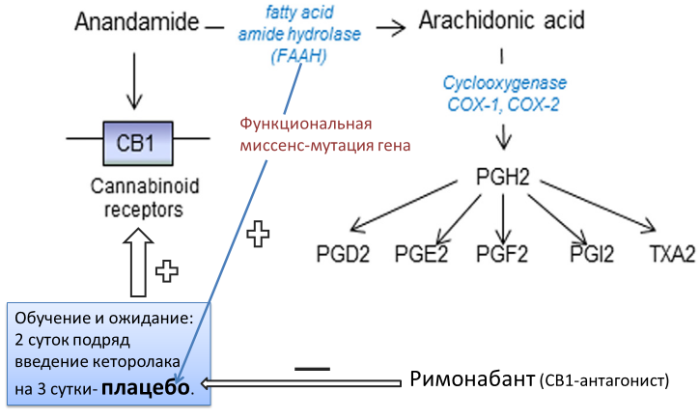
Следующая система, которой мы коснемся в рамках эффектов плацебо и ноцебо, будет каннабиноидная система. Прием нестероидного противовоспалительного препарата (НПВП) кеторолака в течение 2 дней с последующей заменой его на плацебо индуцирует анальгезию, которая не подавляется антагонистом опиоидных рецепторов налоксоном, тогда как антагонист каннабиноидных рецепторов (CB-antagonist) римонабант полностью элиминирует эффект плацебо.
Функциональная миссенс-мутация гена Pro129Thr, кодирующего FAAH (амидо-гидролаза жирных кислот) — основной фермент, деградирующий эндогенные каннабиноиды, — активировала плацебо-анальгезию так же, как плацебо-индуцированная μ-опиоидная нейротрансмиссия.
Также в создании эффекта плацебо участвует дофаминергическая система. Плацебо-анальгезия сопровождается увеличением связывания дофамина с D2/D3-рецепторами и эндогенных опиоидов с μ-рецепторами, наблюдаемым в прилежащем ядре, тогда как инактивация данных рецепторов проявляется ноцебо-гипералгезией.
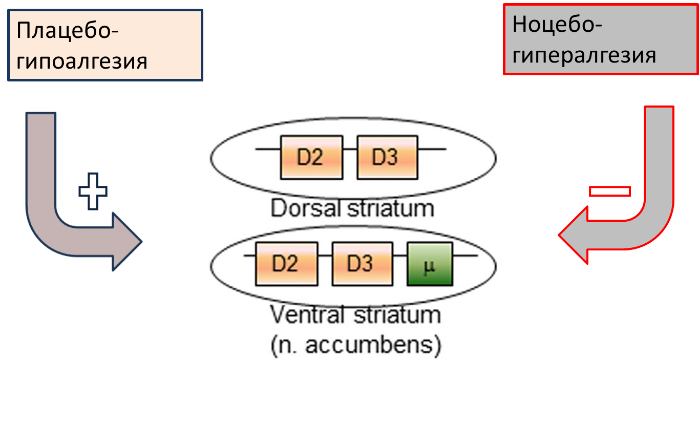
Схожим образом, когда плацебо дают пациентам с болезнью Паркинсона, дофаминовые рецепторы активируются одновременно в вентральном (NAcc) и дорсальном стриатуме. Учитывая возникающую в результате приема плацебо стимуляцию NAcc, можно предположить вовлечение системы вознаграждения в создание эффекта плацебо.
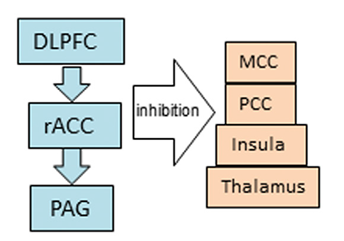
Проведенный метаанализ по исследованиям активности определенных участков мозга с использованием визуализирующих методов (ПЭТ или фМРТ) и корреляции этого с плацебо-анальгезией продемонстрировал следующее: при ожидании анальгезии от приема плацебо наблюдалась повышенная активность в зонах передней опоясывающей извилины, прецентральной и латеральной префронтальной коры и околоводопроводного серого вещества, и, наоборот, снижение активности наблюдалось в зонах медиальной и задней опоясывающей коры, верхней височной и прецентральной извилины, переднего и заднего островка, ограды и скорлупы, таламуса и хвостатого ядра.
Механизмы формирования плацебо
Как уже говорилось ранее, в формировании эффекта плацебо участвуют два процесса: обучение и ожидание. Оба эти механизма редко обходятся друг без друга, но иногда одно явление превалирует над другим. Обучение и последующее внушение положительного/негативного ожидания может идти косвенно через других людей, через средств массовой информации и т. д. К примеру, одной из форм обучения является социальная пропаганда.
При головной боли, вызванной гипобарической гипоксией, плацебо-анальгезия, наступившая в результате социальной пропаганды, напоминала эффект приема аспирина, когда как активированная социальной пропагандой ноцебо-индуцированная головная боль сопровождается повышенной экспрессией простагландинов.
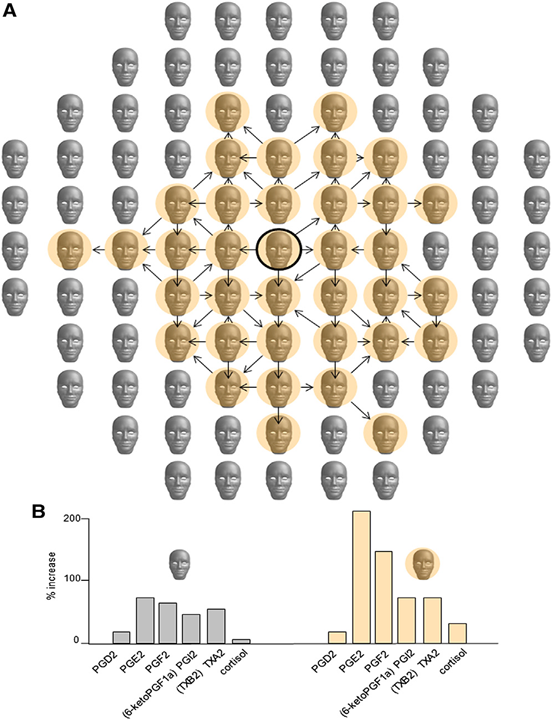
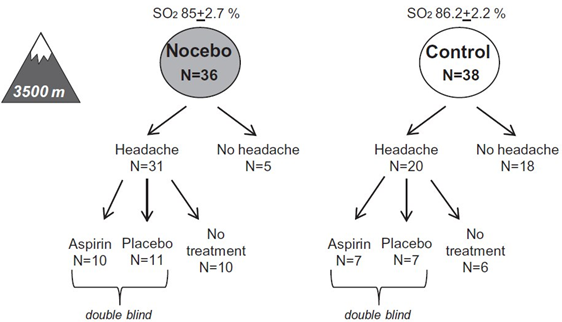
Рассмотрим вышеописанный эффект такой пропаганды на следующем примере. Распространение среди отдельной группы негативного ожидания приводит к эффекту ноцебо в виде формирования оправдания такого ожидания, что было продемонстрировано в исследовании, в ходе которого, где люди, поделенные на 2 группы, поднимались на высоту 3,5 тысяч метров. В первой группе (ноцебо-группа — 36 человек) был индуцирован механизм социальной пропаганды, что проявлялось возникновением у них головной боли во время подъема, вторая группа же группа являлась контрольной (38 человек).
Методика постановки этого эксперимента довольно-таки интересна: сначала «заражали» ожиданием выраженной головной боли одного человека (впоследствии он стал триггером), при этом экспериментаторы заявляли ему, что такая боль снимается аспирином. После этого у человека развивалась головная боль, он принимал аспирин и подавлял ее.
Также исследователи сообщили о возможной головной боли и другим подопытным из ноцебо-группы, а за более полной информацией рекомендовали обратиться к первому человеку — триггеру. Через неделю ноцебо-группа и контрольная группа отправились в поход на высоту 3500 метров над уровнем моря. На высоте у ноцебо-группы чаще выявлялась головная боль, а уровни простагландинов, тромбоксана и кортизола в слюне были выше, чем в контрольной группе.
Далее в каждой из групп пациентов с головной болью разделили на 3 подгруппы: подгруппа, которой дали аспирин (аспирин-группа), подгруппа, которой дали плацебо (плацебо-группа) и подгруппа, находившаяся без лечения (группа без лечения).
Что же получилось в итоге?
При сравнении уровней простагландинов, тромбоксана и степень выраженности боли в ответ на прием плацебо или аспирина были получены следующие результаты:
— в контрольной группе плацебо не оказало почти никакого влияния; аспирин, как и положено, снижал выраженность ГБ;
— в ноцебо-группе была продемонстрирована одинаковая эффективность как аспирина, так и плацебо.
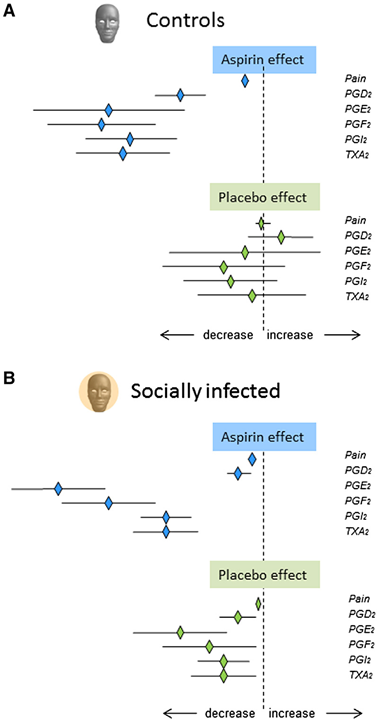
Плацебо было эффективно в группе ноцебо, потому как возникшая боль и повышение простагландинов были обусловлены воздействием социальной ноцебо-пропаганды. Как плацебо, так и ноцебо могут быть обусловлены окружением и социальными взаимодействиями. Это важно учитывать также и при назначении обычных лекарственных препаратов.
В следующем эксперименте проверяли выраженность формирования послеоперационного болевого синдрома. Как видно из исследования, которое проводилось на мышах, проверка эффективности плацебо-эффекта не имела первостепенной значимости.
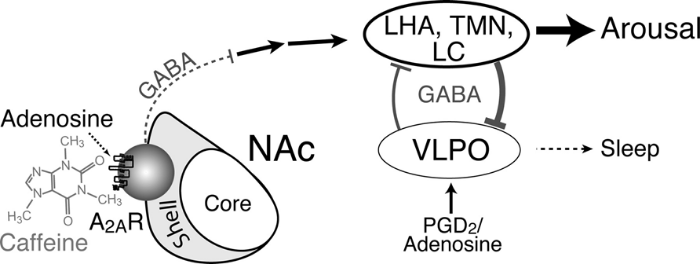
Однако в ходе исследования выяснилось, что тревога и недосып в предоперационном периоде в несколько раз увеличивали выраженность боли после операции, что в перспективе могло приводить к хронизации этой боли. Потенциальную роль в развитии данного эффекта приписывают преоптической аденозинергической системе A2 рецепторов в отношении оси «СОН-БОЛЬ».
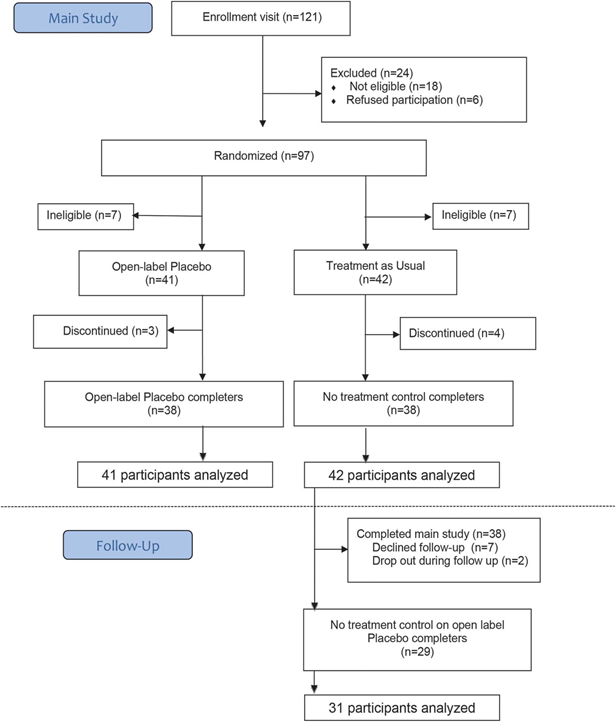
Касательно хронических болей было проведено клиническое исследование 83 пациентов с поясничными болями, длящимися более 3-х месяцев. Критериями включения в эксперимент являлись следующие характеристики: возраст старше 18 лет, отсутствие хирургических операций на поясничном отделе позвоночника, отсутствие тяжелой фибромиалгии, переломов, новообразований, инфекций, дегенерации межпозвоночных дисков с возможностью возникновения травмы; исключался прием опиоидов менее чем за 6 месяцев до исследования. В исследовании не участвовали пациенты с тяжелыми психическими нарушениями и параличами, а также пациенты, склонные к самостоятельному прекращению приема препаратов.
Тяжесть боли оценивалась с помощью трех числовых рейтинговых шкал со значениями от 0 до 10 баллов: определялась максимальная, минимальная и обычная боль, а также комбинированный первичный результат — общий балл боли (среднее значение из трех шкал боли). Другим исходным результатом считалось снижение качества жизни, связанное с поясничной болью, которое было оценено при помощи опросника Roland-Morris.
Для исследования были случайно отобраны 97 взрослых, которые сообщали о стойких болях в пояснице в течение 3 месяцев и более, что было подтверждено сертифицированным специалистом в больнице. 83 человека завершили исследование. По сравнению с TAU (обычная лекарственная терапия) OLP (информированный прием плацебо) приводил к более выраженному снижению боли по каждой из трех 0–10-точечных числовых шкал и с умеренной или выраженной эффективностью по комбинированной шкале от 0 до 10 баллов (P 0,001). Также OLP в большей степени способствовал улучшению жизнедеятельности по сравнению с TAU (P, 0.001). Улучшение показателей инвалидности составило 2,9 (1,7–4,0) в группе OLP и 0,0 (–1,1 до 1,2) в группе TAU.
В ходе последующего исследования участники TAU получали плацебо-таблетки в течение 3 дополнительных недель. После перехода на OLP группа TAU продемонстрировала значительное снижение как боли (среднее значение по результатам трех шкал — 1,5; 0,8–2,3), так и дисфункции (3,4; 2,2–4,5).
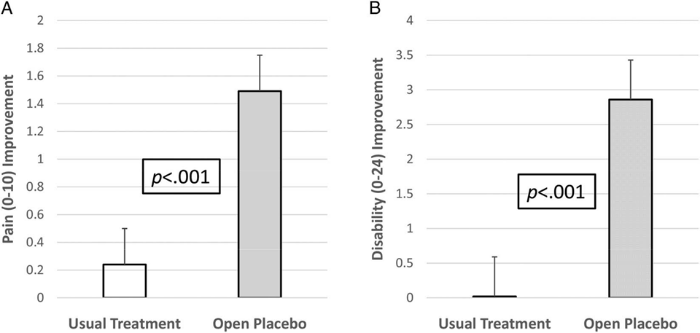
Ярко заметен эффект внушения-обучения: несмотря на то, что пациенты знали о приеме плацебо, плацебо-анальгезия оказала лучшее действие, чем другие анальгетики. По-другому проявляется эффект плацебо, когда к пациенту не применяют прием обучения.
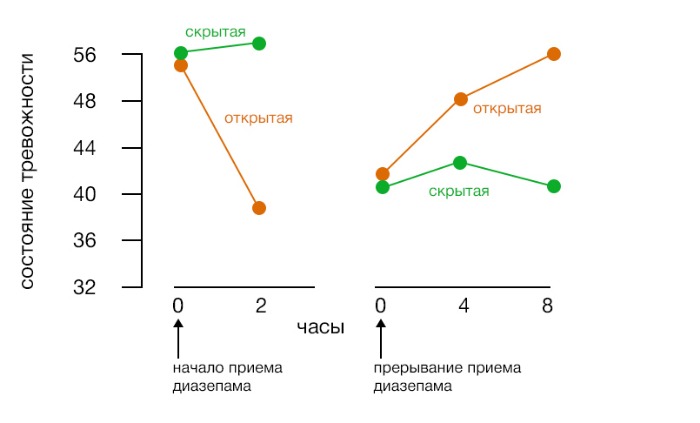
На первом графике — результат скрытого и открытого использования препарата. На втором — скрытая и открытая отмена диазепама. Это демонстрирует то, как ожидание тревоги от ложной отмены препарата приводит к проявлению этой тревоги и наоборот.
Интересно исследование, в ходе которого для подавления послеоперационной боли после экстракции третьего моляра пациентам проводилась либо скрытая внутривенная инъекция 6–8 мг морфина, либо открытая внутривенная инъекция плацебо-раствора на виду у пациента. Эффект открытого введения плацебо был сопоставим с эффектом морфина.
Другими словами, сказать пациенту, что вводится болеутоляющий препарат (который на деле является солевым раствором) столь же эффективно, как и инъекция 6–8 мг морфина. Это работает с различными болеутоляющими средствами, такими как морфин, бупренорфин, трамадол, кеторолак и метамизол.
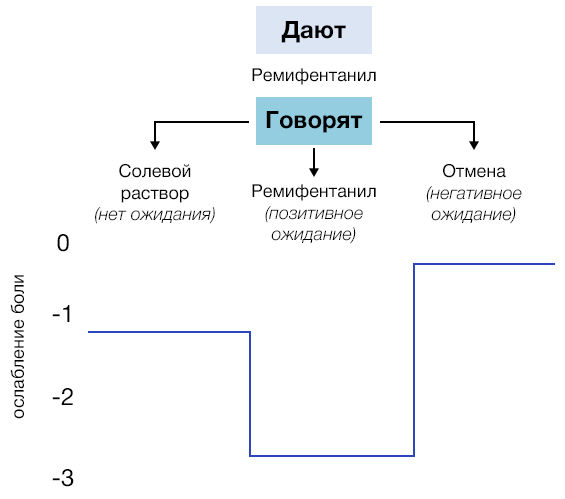
Таким образом, даже для опиоидных анальгетиков важен эффект информирования пациента, формирующий у него эффект ожидания обезболивания. Исходя из вышеизложенных исследований, складывается впечатление, что плацебо — обязательно сознательное явление. Но так ли это на самом деле?
Некоторые исследования демонстрируют активацию плацебо и ноцебо на бессознательный стимул. Сильное заявление. Проверять мы его, конечно, будем.
В 2014 году Karin B. Jensen было проведено исследование, для участия в котором были отобраны 24 испытуемых (10 женщин и 14 мужчин). Исследование состояло из 2-х этапов. Первый этап заключался в демонстрации 2 лиц мужского пола, показ каждого из которых сопровождался определенной термической стимуляцией руки (температуру откалибровали как стимул «сильной боли» и «слабый болевой»).
На первом этапе лицо №1 сопровождалось слабым стимулом, в то время как на лицо №2 давался сильный стимул. Всего было произведено 50 стимулов — по 25 на каждое лицо, и так дважды в течение 10 минут (для того, чтобы удостовериться в запоминании стимула).
Второй этап отличался добавлением «контрольного» стимула в виде лица №3, а также «неосознанного» стимула — демонстрации определенного лица в течение 12 миллисекунд, в результате чего испытуемый не осознавал появление данной фотографии.
Каждая фотография сопровождалась одинаковым температурным стимулом с температурой, средней между сильным и слабым болевыми стимулами. Проводилось 60 стимулов, по 20 на каждое «лицо», трижды в течение 10 минут. Во время эксперимента испытуемых просили описывать полученную боль по шкале от 0 до 20, а также с помощью фМРТ выполнялось исследование активации зон мозга с регистрацией активности различных его зон.
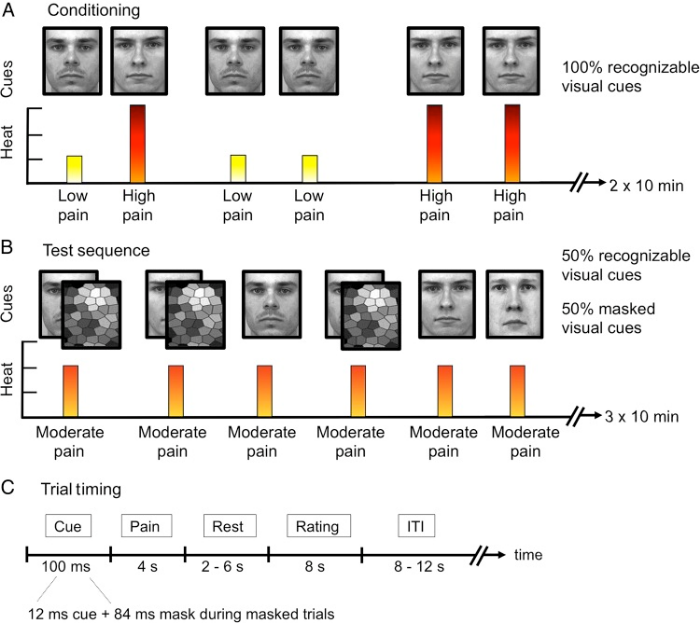
Результаты эксперимента таковы: неосознанное ноцебо проявлялось большей болевой чувствительностью, нежели осознанное ноцебо, а неосознанный эффект плацебо был более выражен, чем осознанный, хотя оба различия не особо чувствительны.
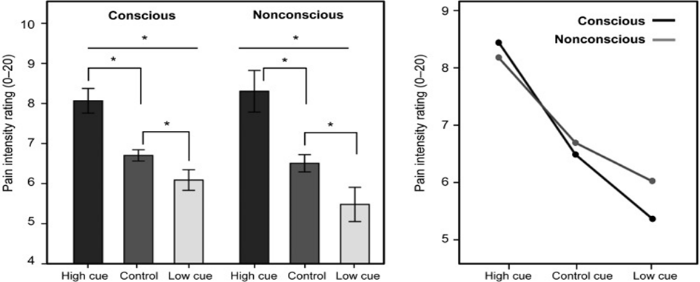
Относительно данных фМРТ: эффект плацебо в обоих случаях ассоциировался с активацией rACC, но при бессознательном плацебо-эффекте наблюдалась выраженная активация орбитофронтальной коры (OFC).
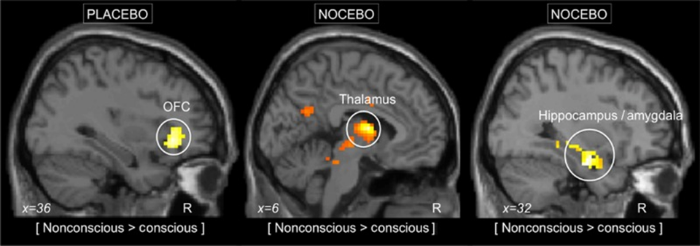
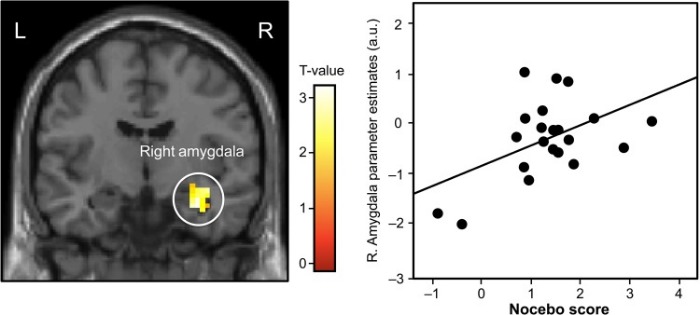
При ноцебо-эффекте происходила активация ACC, билатеральной инсулы, таламуса и ствола мозга. При неосознанном ноцебо более выраженная активация по сравнению с осознанным наблюдалась в стволе мозга, таламусе, миндалевидном теле и гиппокампе. При исследовании неосознанного ноцебо-эффекта уровень активации правого миндалевидного тела положительно коррелировал с уровнем боли, у левого миндалевидного тела такой аналогии не наблюдалось.
Другое исследование того же автора, выполненное без проведения фМРТ на 40 добровольцах, также продемонстрировало наличие неосознанных эффектов плацебо и ноцебо.
Таким образом, исследования с использованием нейровизуализации демонстрируют, что лимбическая система и префронтальная кора активно вовлечены в обеспечение эффектов плацебо и ноцебо. Доказательством того будут состояния, при которых вследствие нарушений деятельности префронтальной коры эффект плацебо не способен активироваться.
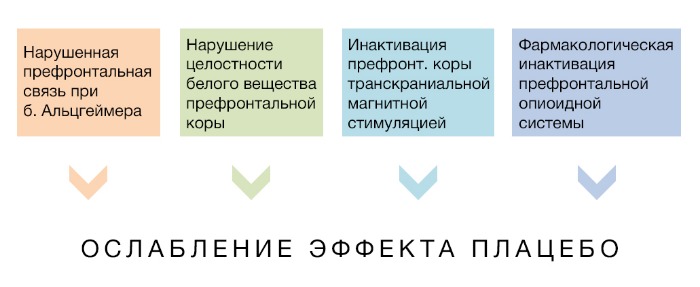
У всех исследований из рассмотренных нами выше можно определить следующие минусы:
1. субъективность;
2. малая подборка;
3. сложность проведения в повседневной практике:
— необходимо предугадать развитие эффекта плацебо/ноцебо;
— ограниченный контингент пациентов и виды патологий и т. д.
И, тем не менее, плацебо и ноцебо работают!
Источники:
1. Fabrizio Benedetti "Placebo Effects: From the Neurobiological Paradigm to Translational Implications". Neuron 84, November 5, 2014.
2. Juliana Barcellos de Souza, Eduardo Grossmann et al “Prevalence of Chronic Pain, Treatments, Perception, and Interference on Life Activities: Brazilian Population-Based Survey” Pain Research and Management. Volume 2017.
3. Macfarlane Gary J. “The epidemiology of chronic pain” PAIN: October 2016 - Volume 157.
4. Mrs Alison M Elliott, BSc, Blair H Smith, MRCGP et al “The epidemiology of chronic pain in the community” The Lancet. October 09, 1999. Volume 354.
5. Fishbain DA1, Cutler RB, et al “Impact of chronic pain patients' job perception variables on actual return to work” Clin J Pain. 1997 Sep;13(3):197-206.
6. ПОСТОРОНИСЬ, МОРФИН [Электронный ресурс] / И. Боровикова, Е. Лисицына, Н. Лисицкий. — Электрон. журн. — Medach, 2016. — Режим доступа: http://clc.to/-GXnAA
7. БОЛЬ: НОЦИЦЕПЦИЯ [Электронный ресурс] / В. Волков, Н.Родионов, Н. Лисицкий и др. — Электрон. журн. — Medach, 2017. — Режим доступа: http://clc.to/cKuycQ
8. НЕЙРОПАТИЯ: ИМЯ ДЛЯ БОЛИ [Электронный ресурс] / Д. Ряскина, М. Гусев, Н. Лисицкий и др. — Электрон. журн. — Medach, 2016. — Режим доступа: http://clc.la/mqVa4g
9. Timothy M. Marshall, David S. Herman, et al “Activation of Descending Pain Facilitatory Pathways from the Rostral Ventromedial Medulla by Cholecystokinin Elicits Release of PGE2 in the Spinal Cord” Pain. 2012 Jan; 153(1): 86–94.
10. Amanzio, M., Benedetti, F., et al “Activation likelihood estimation meta-analysis of brain correlates of placebo analgesia in human experimental pain” Hum Brain Mapp. 2013 Mar;34(3):738-52.
11. Benedetti F, Durando J, Vighetti S “Nocebo and placebo modulation of hypobaric hypoxia headache involves the cyclooxygenase-prostaglandins pathway” Pain. 2014 May;155(5):921-8.
12. Viviane S Hambrecht-Wiedbusch et al. “Preemptive Caffeine Administration Blocks the Increase in Postoperative Pain Caused by Previous Sleep Loss in the Rat: A Potential Role for Preoptic Adenosine A2A Receptors in Sleep–Pain Interactions” Sleep. 1 September 2017 Volume 40, Issue 9.
13. C. Carvalho et al. Open-label placebo treatment in chronic low back pain: a randomized controlled trial// PAIN 157 (2016) 2766–2772
14. Karin B. Jensen, Ted J. Kaptchuk, et al “A Neural Mechanism for Nonconscious Activation of Conditioned Placebo and Nocebo Responses” Cereb Cortex. 2015 Oct; 25(10): 3903–3910.
15. Karin B. Jensen,Ted J. Kaptchuk, et al “Nonconscious activation of placebo and nocebo pain responses” Proc Natl Acad Sci USA. 2012 Sep 25; 109(39): 15959–15964.
