Ингибиторы контрольных точек для лечения рака головы и шеи

Плоскоклеточный рак органов головы и шеи (ПРГШ) находится на 6-м месте по распространенности в мире среди раковых заболеваний с частотой рецидивов около 50 %, несмотря на агрессивное лечение, включающее хирургические, лучевые и химиотерапевтические методы, в т. ч. ингибирование рецептора эпидермального фактора роста (EGFR), когда это возможно. По мере получения новых данных о механизмах взаимодействия клеток иммунитета с раковыми клетками появляются новые способы лечения онкологических заболеваний. Одним из таких способов является ингибирование иммунных контрольных точек, о котором мы рассказали вам ранее. В этом обзоре мы расскажем о лечении рака головы и шеи различными препаратами, являющимися ингибиторами контрольных точек (ИКТ, в частности, ингибиторами контрольной точки PD-1–PD-L1) — пембролизумаб, ниволумаб и др. — применявшимися как в монотерапии, так и в комбинации с другими методами лечения. Эти препараты продемонстрировали хорошие результаты в исследованиях и были одобрены для применения в 2016 г.
К раку головы и шеи относят злокачественные опухоли, возникающие в околоносовых пазухах, носовой полости, полости рта, глотки и гортани. В Европе насчитывается около 139 000 новых случаев рака головы и шеи в год, 90 % из которых — плоскоклеточная карцинома (ПРГШ). Помимо таких давно известных факторов риска развития ПРГШ, как курение и употребление алкоголя, в последнее время появляется все больше доказательств значимости вируса папилломы человека (ВПЧ) как фактора риска развития карцином орофарингеальной области.
Здоровый иммунитет имеет решающее значение в борьбе с канцерогенезом, однако опухолевые клетки уклоняются от иммунного контроля, исключая Т-клетки из своего микроокружения, но при ПРГШ инфильтрация микроокружения опухоли Т-лимфоцитами достаточно высокая, что предполагает другие механизмы ухода от иммунного ответа, например, за счет влияния на взаимодействие Т-лимфоцитов с раковыми клетками. Было выявлено несколько супрессивных механизмов:
- Дефект или изменение экспрессии молекул MHC класса I наряду с избыточной экспрессией антигенов, вызывающих толерантность к Т-клеткам,
- Увеличение экспрессии иммуносупрессивных цитокинов IL-10, IL-6 и TGF-β,
- Аберрантная активация факторов транскрипции, например, STAT3 и NF-kB, которые связаны с сигналами IL-6 и TGF-β соответственно.
Для подавления аутоиммунной активности на поверхности иммуноцитов присутствуют несколько видов молекул, связанных с различными контрольными точками, при этом для активации Т-клеточного иммунного ответа необходимо соблюдение тонкого баланса коингибирующих и костимулирующих молекул и их лигандов (Рис. 1). Обнаружены иммуномодулирующие агенты, которые блокируют взаимодействие между коингибирующими рецепторами, такими как цитотоксический T-лимфоцитарный антиген 4 (CTLA-4), белок запрограммированной смерти клеток 1 (PD-1) или ген-3-лимфоцитарный активатор (LAG-3) и их лиганды. Также были рассмотрены препараты, которые имитируют активированную лигандом сигнализацию в костимулирующих молекулах, таких как рецептор фактора некроза опухолей, индуцированный глюкокортикоидами (GITR). Оба этих подхода направлены на достижение одного результата — усиления активации иммунного ответа на опухолевые клетки (Рис. 2). Экспрессия PD-L1 часто повышена в клетках ПРГШ (по данным разных исследователей, от 46 до 100 %).

Рисунок 1 | Коингибирующие и костимулирующие контрольные точки являются ключевым элементом иммунной регуляции Т-клеток.
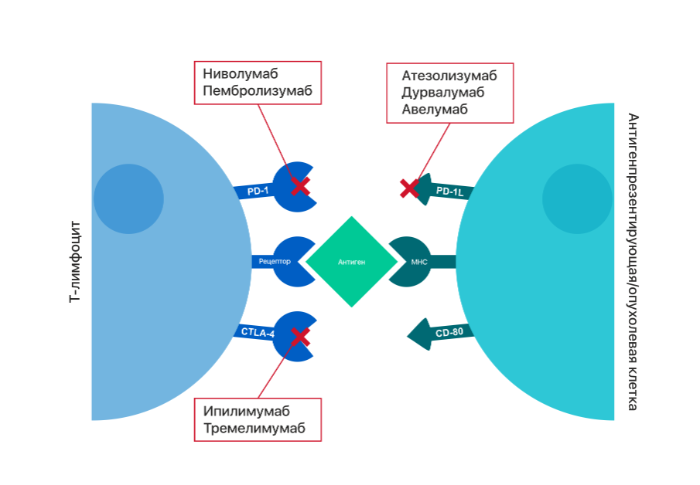 Рисунок 2 | Моноклональные антитела к ключевым коингибирующим иммунным контрольным точкам.
Рисунок 2 | Моноклональные антитела к ключевым коингибирующим иммунным контрольным точкам.
PD-1/PD-L1
Ниволумаб — моноклональные антитела IgG4 PD-1, предназначенные для блокирования коингибирующей сигнализации через взаимодействие PD-1/PD-L1.
Данные, полученные в открытом клиническом исследовании III фазы (CheckMate 141) с участием 361 пациента, страдающих ПРГШ, показывают, что медиана общей выживаемости пациентов (ОВ) составила 7,5 мес. в группе ниволумаба и 5,1 мес. в группе стандартной химиотерапии. Показатель однолетней ОВ составил 36,0 % и 16,6 % соответственно. У пациентов с уровнем экспрессии PD-L1 ≥ 1 % медиана ОВ составила 8,7 и 4,6 мес. соответственно. Побочные явления 3–4 степени тяжести зарегистрированы у 13,1 % пациентов в группе ниволумаба и 35,1 % больных в группе химиотерапии.
Пембролизумаб — еще одно антитело IgG4 PD-1, также зарегистрирован в качестве препарата для лечения рецидивирующего или метастатического ПРГШ. Исследование включало 132 пациента с ПРГШ. Частота ответа на терапию составила 18 % через 9 месяцев (среди них 4 полных ответа и 20 частичных ответов), медиана ОВ — 8 месяцев, а 6-месячная выживаемость без прогрессирования (PFS) — 23 %. Лечение хорошо переносилось, токсичность 3 или 4 степени проявилась у 9 % пациентов. Эти данные привели к ускоренному одобрению Пембролизумаба в США.
Исследование других ингибиторов PD-1/PD-L1 при ПРГШ, таких как дурвалумаб, атезолизумаб и авелумаб, в настоящее время продолжается.
GITR
GITR является членом суперсемейства фактора некроза опухолей, экспрессируемым на поверхности CD25+CD4+ Treg-лифоцитов. Активация GITR его лигандом (GITRL) уменьшает пролиферацию Treg и отключает их иммуносупрессивную функцию.
AMG228 представляет собой антитело IgG1, которое связывается с GITR. Исследование, завершенное на I фазе клинических испытаний, показало, что у 29 из 30 пациентов не было объективного ответа на терапию. У 90 % пациентов проявлялись побочные действия в виде гипофосфатемии, усталости, анемии, тошноты и лихорадки. Не было обнаружено признаков изменения активности Т-клеток.
Комбинации ингибиторов контрольных точек
Использование комбинаций ингибиторов контрольных точек (ИКТ) улучшило показатели ответа и ОВ при различных типах опухолей, в т. ч. при ПРГШ.
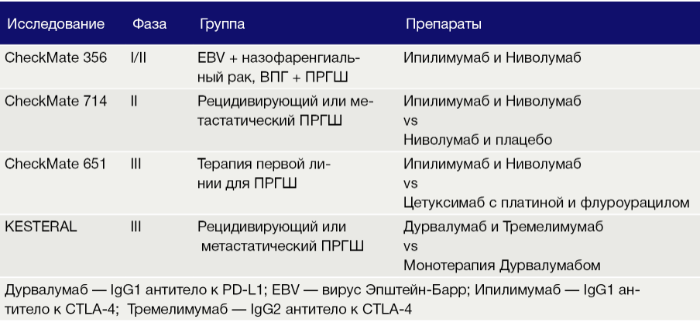
CTLA-4 обычно экспрессируется на поверхности активированных Т-клеток, где он связывается с B7, предотвращая взаимодействие с костимулирующим фактором CD28, что приводит к подавлению пролиферации Т-клеток и продукции IL-2. Блокада CTLA-4 коррелирует с увеличением активации T-клеток и поддержанием клонотипов Т-лимфоцитов с высокой плотностью Т-клеточных рецепторов. Комбинация ингибиторов PD-L1 и CTLA-4 улучшает скорость ответа и противоопухолевую активность по сравнению с монотерапией только при метастатической меланоме, и эта комбинация изучается в терапии других солидных раковых опухолях. В ПРГШ этот комбинированный подход оценивается в четырех отдельных испытаниях (Табл. 1).
Таблица 1 | Текущие исследования, оценивающие комбинацию ингибиторов PD-L1 и CTLA-4 при ПРГШ.
LAG-3 экспрессируется на поверхности активированных CD4+ и CD8+ T-клеток и некоторых подтипов естественных киллеров и дендритных клеток. Считается, что он снижает активацию и пролиферацию Т-клеток. Также экспрессируется клетками Treg и необходим для их оптимальной супрессивной функции. На данный момент проводятся исследования действия ингибитора LAG-3 — BMS-986016 (антитело против LAG-3) как в монотерапии, так и в сочетании с ниволумабом в качестве препарата для лечения опухолевых заболеваний, в т. ч. ПРГШ.
Ингибиторы контрольных точек в сочетании с другими иммунными модуляторами
Комбинации иммуномодуляторов в онкологии не ограничиваются только комбинациями ИКТ. В настоящее время исследуется целый ряд других агентов, способных модулировать микроокружение опухоли для лечения ПРГШ.
SCORES — это исследование Дурвалумаба (ингибитор PD-L1) в комбинации с AZD9150 или AZD5069 в терапии солидных опухолей на поздних стадиях (в том числе рецидивирующий/метастатический ПРГШ), находящееся в фазе Ib/II. AZD9150 ингибирует STAT3, а его активность при лимфоме и раке легких подтверждена в доклинических исследованиях. Эти исследования также показали, что ингибирование STAT3 может повысить хемо- и радиотерапевтическую сенсибилизацию ПРГШ, особенно при раке носоглотки. AZD5069 является новым селективным антагонистом метаботропного рецептора CXC Chemokine 2 (CXCR2). Он сверхэкспрессируется на поверхности клеток ПРГШ и участвует в пролиферации клеток посредством передачи сигналов через IL-8. Первоначальные результаты пациентов с ПРГШ, получавших AZD9150 и Дурвалумаб, оказались многообещающими: ответ на лечение дали 25 % пациентов, а побочные эффекты 3–4 степени тяжести наблюдались у 3,4 % пациентов. Исследования продолжаются.
Индоламин 2,3-диоксигеназа 1 (IDO1) представляет собой катаболизирующий фермент, который индуцирует иммунную толерантность путем подавления активности Т-клеток и обусловливает плохой прогноз при карциноме язвы гортани. IDO1 интенсивно исследуется как новая цель иммунной терапии, разрабатывается несколько препаратов-ингибиторов этого фермента. KEYNOTE-037 — это исследование фазы I/II, оценивающее пембролизумаб при одновременном применении с эпакадостатом, пероральным ингибитором IDO1. Среди 38 пациентов, ответ на лечение дал 31 %, при этом в 58 % случаев удавалось достигнуть контроля над заболеванием составлял 58 %, независимо от количества предыдущих курсов лечения. Самыми распространенными побочными эффектами были усталость (24 %), тошнота (11 %) и снижение веса (11 %). Полученные данные предполагают перспективную противоопухолевую активность и хорошую переносимость этой комбинации, была запланирована III фаза исследований.
Ингибиторы контрольных точек в сочетании с вирусной терапией
В ряде доклинических исследований было обнаружено, что онколитические вирусы уменьшают опухолевую нагрузку и обеспечивают активацию противоопухолевого иммунитета, а при использовании в комбинации с ингибитором PD-1 могут преодолеть резистентность к ИКТ путем усиления Т-клеточного иммунного ответа. В настоящее время несколько онколитических вирусов проходят испытания в качестве терапии ПРГШ. KEYNOTE-137 — это текущее рандомизированное исследование фазы Ib/III, в котором изучается комбинация Талимогена лагерпарепвека (T-VEC) с пембролизумабом при рецидивирующем метастатическом ПРГШ. T-VEC — модифицированный, живой, ослабленный вирус простого герпеса типа 1, который предназначен для стимулирования противоопухолевого ответа путем селективной репликации в опухолевых клетках и продукции гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) для стимуляции системного противоопухолевого иммунитета. Он уже лицензирован как единственный агент для лечения неоперабельной метастатической меланомы после демонстрации улучшенной долговременной реакции (DRR) и медианой ОВ относительно изолированного ГМ-КСФ.
Ингибиторы контрольных точек в сочетании с химиолучевой терапией
Особый интерес представляет изучение ИКТ в сочетании с химио- и лучевой терапией при местно-распространенном ПРГШ. В III фазе исследования PACIFIC после проведения химиолучевой терапии (ХЛТ) был применен Дурвалумаб, что дало улучшенный ответ на лечение и рост медианы ОВ при местно-распространенном неоперабельном немелкоклеточном раке легких.
Увеличенное количество CD3+ и CD8+ TIL (противоопухолевых эффекторных Т-лимфоцитов) положительно коррелирует с клиническим эффектом от ХЛТ при ПРГШ. Кроме того, в экспериментальном исследовании с участием 20 пациентов показано, что ХЛТ изменяет набор иммунных клеток при ПРГШ с увеличением числа эффекторных клеток CD8+, T-регуляторных клеток CD4+ и Т-клеток, экспрессирующих PD1, TIM3 и LAG3. Важно отметить, что в этом исследовании большинство пациентов были мужчинами (90 %) с локализованной опухолью, связанной с вирусом папилломы человека (ВПЧ), в 80 % случаев опухоль происходила из ротоглотки, и, таким образом, результаты могут не быть репрезентативными для всех лиц, страдающих ПРГШ.
Было проведено исследование с применением комбинации ХЛТ и пембролизумаба, в котором 27 пациентов получали фиксированную дозу пембролизумаба за 4–7 дней до ХЛТ, 3 раза в неделю одновременно с ХЛТ и еще пять раз после завершения. Пациенты преимущественно имели ВПЧ-положительные опухоли ротоглотки (74 %), все получали запланированную дозу химиотерапии, при этом 85 % достигли запланированного введения цисплатина и 78 % получили запланированные дозы пембролизумаба. Добавление ИКТ не приводило к увеличению токсичности, однако у трех пациентов пришлось прекратить лечение в связи с побочными эффектами, связанными с иммунной реакцией (G2 — периферическая двигательная невропатия, G3 — повышение уровня АСТ и G1 — синдром Лермитта). В настоящее время исследование расширяется как для ВПЧ-положительных, так и для ВПЧ-отрицательных опухолей, для подтверждения переносимости и получения предварительных доказательств эффективности.
Цетуксимаб также используется в комплексе с лучевой терапией для лечения локализованного ПРГШ. Он влияет на реакцию естественных киллеров, созревание дендритных клеток, увеличивает экспрессию ингибирующих контрольные точки PD-1, TIM-3 и CTLA-4 молекул на клетках TIL. Существует ряд текущих испытаний, в которых планируется определить преимущества ингибирования контрольных точек наряду с различными комбинациями цетуксимаба и ЛТ при локализованном ПРГШ, причем комбинация с авелумабом как часть исследования REACH (NCT02999087) представляет особый интерес из-за способности комбинации авелумаба и цетуксимаба к активации антителозависимой клеточной цитотоксичности (АЗКЦТ).
Побочные эффекты
Лечение препаратами ИКТ может приводить к воспалительным побочным эффектам, связанным с иммунной системой (irAEs). Точный механизм неизвестен, вероятно, из-за роли иммунных контрольных точек в поддержании иммунного гомеостаза и за счет ингибирования их действия, Т-клетки способны реагировать с аутоантигенами, причем различные контрольные точки имеют различные профили иммунной токсичности. Эти аутоиммунные проявления чаще встречаются у пациентов с ранее существовавшими аутоиммунными нарушениями, однако при осторожном введении ИКТ, их можно использовать и у этих пациентов.
Объединенный ретроспективный анализ профиля безопасности ниволумаба у 576 пациентов с распространенной меланомой показал, что у 49 % пациентов возникали проявления irAEs; чаще всего это были кожные, желудочно-кишечные, эндокринные и печеночные проявления, которые достигли 3–4 степени тяжести у 4 % пациентов. Время начала проявлений варьировалось в зависимости от задействованной системы органов, при этом кожные irAEs проявлялись через 5 недель, а почечная токсичность — в среднем через 15 недель. Приблизительно у 24 % пациентов возникла необходимость системного иммуносупрессивного лечения, которое в большинстве случаев оказалось успешным. В CheckMate 141 профиль побочных эффектов ниволумаба с ПРГШ показал более низкие показатели токсичности для ЖКТ и для печени по сравнению со стандартным лечением, но продемонстрировал увеличение токсичности для кожи (15,7 %), эндокринной системы (7,6 %), легких (2,1 %).
Результаты лечения 114 пациентов с метастатическим ПРГШ, получавших Анти-PD-1 терапию, продемонстрировали, что у пациентов с проявившейся irAE, результаты лечения опухоли были лучше по сравнению с теми, у которых irAE не проявлялся. Аналогичное наблюдение было отмечено у пациентов с метастатической меланомой, независимо от того, требовалось ли лечение irAE системным иммунодепрессантом.
Развитие irAE может иметь серьезные последствия, а в некоторых случаях приводить к смертельному исходу, поэтому необходимо тщательно изучить все риски до начала использования ИКТ, следовательно, необходимо выявить биомаркеры, способствующие получению возможности информированного принятия решений о применении препаратов ИКТ и мониторинга их токсичности.
Биомаркеры
Ответ на применение ниволумаба и пембролизумаба был лучше при ВПЧ-положительном ПРГШ, чем при ВПЧ-отрицательном (32 % ответивших против 14 %, 6-месячная PFS 37 % против 20 % и 6-месячная медиана ОВ 70 % против 56 %).
В качестве потенциального биомаркера была также рассмотрена экспрессияа экспрессия PD-L1 опухолевыми клетками. Процент ответивших на терапию составил 22 % у пациентов с экспрессией PD-L1 > 1 % против 4 % у пациентов с PD-L1 < 1 %, с медианой ОВ 303 день против 151 дня соответственно.
Было обнаружено, что профиль экспрессии генов соматической мутационной нагрузки (ML) и INF-γ позволяет прогнозировать положительный ответ на пембролизумаб как у пациентов с ВПЧ и ВЭБ-положительными опухолями, так и у пациентов с ВПЧ и ВЭБ-отрицательными опухолями.
Комбинации этих биомаркеров могут давать дополнительную возможность для применения ИКТ в качестве препарата для лечения плоскоклеточного рака головы и шеи.
Заключение
Иммунотерапия продвигается вперед и все чаще говорят об индивидуальных подходах к лечению опухолевых заболеваний, в т. ч. ПРГШ, возможно, в недалеком будущем появится возможность с помощью наборов биомаркеров подбирать такое лечение, которое будет максимально эффективно в отношении конкретных форм злокачественных новообразований при наименьших побочных эффектах.
Источники
Forster M. D., Devlin M. J. Immune Checkpoint Inhibition in Head and Neck Cancer //Frontiers in oncology. – 2018. – Т. 8.
