Новые стратегии для редактирования генома в клетках мозга

Несмотря на беспрецедентные терапевтические возможности редактирования генома, в настоящее время целительная сила этого метода ограничена значительной сложностью доставки ферментов, режущих ДНК, в клетки, которые нуждаются в коррекции. Недавнее исследование показало, что ферменты, редактирующие геном, можно доставить в клетку в виде комплексов рибонуклеопротеинов. Таким образом удалось добиться полного излечения синдрома ломкой Х-хромосомы (FXS) в модели на мышах.
Технология редактирования генома преобразила биомедицинские исследования и продемонстрировала многообещающие терапевтические возможности благодаря своей успешности на культурах тканей, ex vivo, редактировании генома эмбрионов и в моделях болезней человека на животных. Для успешного внедрения в клинику метод редактирования генома должен быть безопасным, эффективным, и в идеале — простым в изготовлении. Эффективную доставку кодирующей ДНК и белковых компонентов геном-редактирующего фермента на основе CRISPR, такого как Cas9, могут осуществлять аденоассоцированные вирусы (AAV), однако безопасность этого метода сомнительна, а производственные расходы достаточно велики [1]. Одной из новых альтернатив является доставка ферментов, редактирующих геном, в форме предварительно собранного рибонуклеопротеинового комплекса (РНК и белка, он же RNP). Этот подход весьма привлекателен из-за малой продолжительности действия: RNP разрушаются менее чем за 24 часа. Вирусы же, напротив, могут способствовать длительной (в течение нескольких дней) экспрессии фермента, редактирующего геном, что связано с более высокой частотой неожиданных побочных эффектов [2]. Для обеспечения транспортировки RNP из цитоплазмы в ядро обычно используется клеточный сигнал внутриядерной локализации (nuclear localization signal, NLS), однако особую проблему представляет перенос крупного геном-редактирующего фермента из внеклеточного пространства в цитоплазму. Для улучшения переноса Cas9-RNP в клетку применяется несколько успешных стратегий, таких как модификация белка Cas9 с включением последовательностей NLS, спонтанно разрушающих мембраны [3] или добавление к белку Cas9 отрицательно заряженных доменов для улучшения его взаимодействия с полимерами, способствующими внедрению в клетку [4]. Лаборатория Мёрти (The Murthy lab) разработала подход под названием CRISPR-Gold, в котором структурообразующая наночастица золота, конъюгированная с одноцепочечной ДНК, используется для привлечения Cas9-RNP, покрытых катионным полимером, облегчающим проникновение через клеточную мембрану [5].
Головной мозг — заманчивая область для применения терапевтического редактирования генома, поскольку он анатомически изолирован, что обеспечивает прямой хирургический доступ, а также иммунопривилегирован, что снижает риски, возникающие при введении вирусных векторов [1] и/или ферментов, редактирующих геном [6]. В недавнем исследовании, проведённом при сотрудничестве лабораторий Ли (Lee) и Мёрти [7], в мозг мыши при помощи CRISPR-Gold были успешно доставлены фермент Cas9 и его аналог Cas12a (Cpf1). CRISPR-Gold, несущий либо Cas9, либо Cas12a, стереотаксически вводили в гиппокамп или полосатое тело мозга мыши, где фермент эффективно осуществлял редактирование генома, что определялось с помощью флуоресцентных репортеров. Для экспериментов по изучению способности редактирования генома излечивать аутизм применялась основанная на нокауте Fmr1 мышиная модель FXS. FXS — это распространенное наследственное моногенное расстройство аутистического спектра (РАС), в случае которого медикаментозная терапия в значительной степени неэффективна. Важно отметить, что перспективным кандидатом для редактирования выступает ген mGluR5, поскольку он может способствовать развитию FXS, а также других РАС. Чтобы проверить, может ли ослабление экспрессии mGluR5 уменьшить степень проявления ассоциированных с аутизмом фенотипов в модели FXS, в полосатое тело мозга мышей вводили комплекс CRISPR-Gold, несущий Cas9-RNP, нацеленный на mGluR5. В обработанных клетках полосатого тела оказались повреждены 15 % локусов mGluR5, что приводило к снижению количества мРНК или белка mGluR5 на 40 % (подтверждено методом количественной ПЦР или иммуноокрашивания, соответственно). Исследования поведения мышей, на которых проводилось редактирование FXS, выявили заметное урежение частоты двух основных поведенческих особенностей мышей с аутичными фенотипами: закапывания шариков и спонтанных прыжков. Этот многообещающий результат был подкреплен наблюдением, что терапия CRISPR-Gold не оказала заметного влияния на двигательную активность мышей.Другие тесты на токсичность показали, что терапия CRISPR-Gold не приводит к гибели клеток in vivo или изменению свойств нейронов в культуре.
Результаты терапии CRISPR-Gold нагляднее оценивать в сравнении с AAV-опосредованной доставкой, которую пионеры редактирования генома быстро приспособили для применения на головном мозге (Рис. 1). Доставка Cas9/AAV, то есть AAV, кодирующего Cas9 и его одноцепочечной направляющей РНК (single guide RNA), оказалась особенно успешной для создания моделей нейродегенеративных заболеваний и других болезней головного мозга и нервной системы. В докладе 2016 года, лаборатория Жанг (Zhang) сообщила о Cas9/AAV-опосредованном редактировании гена MCP2 в головном мозге мышей, что привело к полному нарушению его экспрессии в большинстве (68 %) клеток ткани, в которую была произведена инъекция. Полученное устойчивое распределение вирусов по всей ткани и редактирование в постмитотических нейронах позволило создать на мышах модель синдрома Ретта с соответствующим поведенческим фенотипом [8]. Также AAV применяется в терапевтических моделях; например, в лаборатории Дэвидсона (Davidson laboratory) отредактировали болезнетворный аллель в модели хореи Гентингтона на трансгенных мышах — после инъекции Cas9/AAV в головной мозг уровень мутантного белка гентингтина снизился на 80 % [9]. В одной из недавних публикаций показана успешность аналогичного подхода для редактирования in vivo мутантных аллелей гена APP, который обусловливает развитие болезни Альцгеймера, еще одного заболевания с доминантным типом наследования [10]. Векторы Cas9/AAV вводили в гиппокамп трансгенных взрослых мышей, экспрессирующих множественные копии мутантного аллеля APP человека и избирательные инсерции/делеции (1,3 %), создаваемые в мутантном аллеле при редактировании, позволили снизить уровень патогенного бета-амилоида в мозге мышей [10]. Ни в одном из примеров редактирование болезнетворных мутаций методом Cas9/AAV не привело к улучшению состояния (фенотипа) мышей, в отличие от заметного улучшения при терапии методом CRISPR-Gold в недавнем исследовании Ли с соавт. Однако в различных исследованиях применяются различные модельные системы, и логично было бы ожидать, что эффективность редактирования методом Cas9/AAV может оказаться сопоставимой с редактированием, применявшимся на модели FXS.
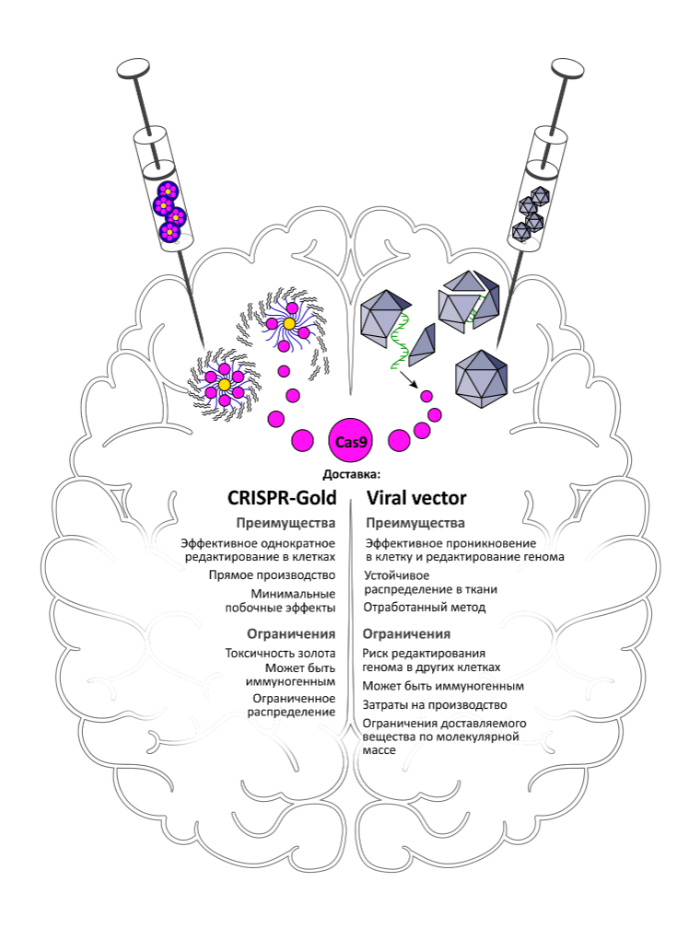
Одним очевидным преимуществом AAV-опосредованной доставки в случае мышей и приматов является распространение вирусных частиц по всему мозгу. При изолированном введении RNP [3] или же CRISPR-Gold [7], напротив, редактированию подвергаются лишь клетки в пределах нескольких кубических миллиметров от места инъекции. Это указывает на потенциальные препятствия для внедрения метода в терапевтическую практику. Ещё одна потенциальная проблема, связанная с применением CRISPR-Gold для лечения людей — это введение тяжёлого металла, который, как известно, токсичен. Однако эта проблема облегчается тем, что золото составляет лишь незначительную долю наночастиц, и тем, что в идеале редактирование генома — лечение однократное, что позволит избежать накопления золота, возможного при повторных инъекциях. При продолжении разработки, доставка RNP может стать основной стратегией для терапевтического редактирования генома клеток головного мозга.
