Метастазы в головной мозг и лептоменингеальные метастазы: диагностика и лечение
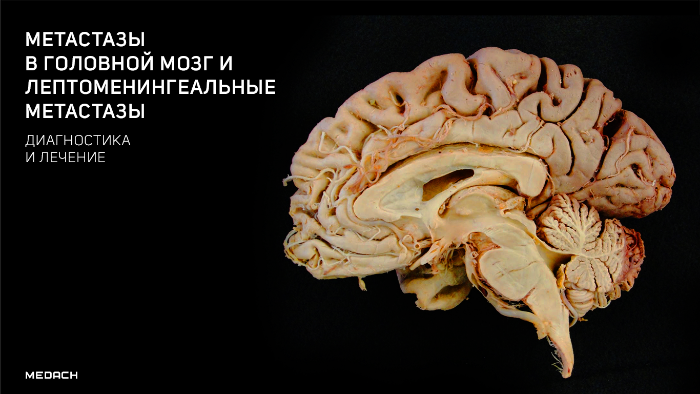
Метастазы в головном мозге представляют собой серьезное препятствие при лечении пациентов с солидными опухолями и делают немалый вклад в тяжесть заболевания, а также увеличивают процент смертельных исходов различных типов опухолей. Предполагается, что статистическое увеличение частоты метастазирования опухолей в головной мозг связано с несколькими причинами, включая более совершенные методы системной терапии, обеспечивающие высокую выживаемость, а также выявление метастазов у бессимптомных пациентов. Ввиду почти полного отсутствия моделей для доклинических исследований, которые бы оптимально моделировали клинические параметры, а также отсутствие пациентов с метастатическими поражениями головного мозга среди участников большинства клинических испытаний существенно затрудняют разработку терапевтических стратегий для таких пациентов. Молекулярными факторами, способствующими метастазированию первичных опухолевых очагов в головной мозг, являются многочисленные гены, задействованные в процессах клеточной адгезии, экстравазации, метаболизма и клеточного сигналинга. Кроме того, все больше внимания ученые обращают на роль уникального микроокружения тканей головного мозга. Также более глубокого изучение требует вопрос о месте гематоэнцефалического барьера в формировании метастатических опухолевых очагов. Помимо этого, опухолевые клетки, вероятно, противостоят терапевтическим воздействиям, создавая себе убежище путем отграничения от системного кровотока гистогематическим барьером (blood-tumor barrier).
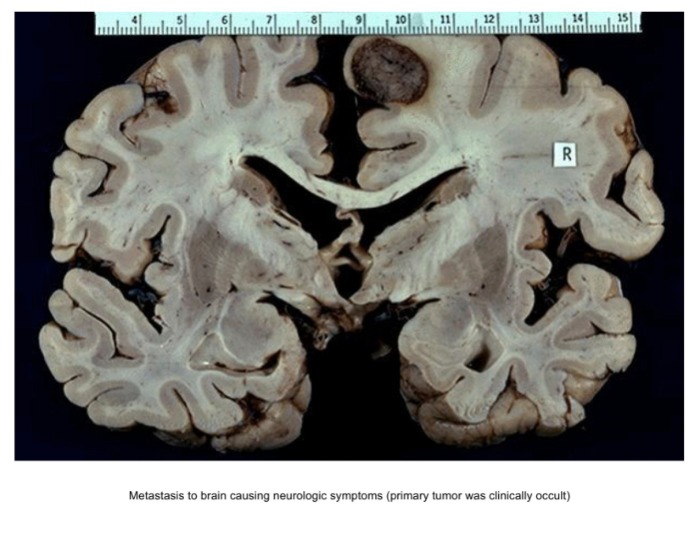
Участки головного мозга, где наиболее часто можно обнаружить метастатический очаг можно выделить в соответствии с интенсивностью кровоснабжения и объемом ткани, при этом около 80 % метастазов обнаруживаются в полушариях большого мозга, 15 % в мозжечке, 5 % в структурах ствола мозга. На момент диагностики метастазов в головном мозге большинство пациентов уже имеет множественные очаги опухолевого роста. Клинические проявления могут включать в себя головные боли, неврологическую симптоматику, пароксизмальные расстройства. Выявляемые в 65 % случаев когнитивные нарушения могут являться следствием разрушения либо смещения ткани головного мозга растущей опухолью; перитуморальный отек к разрушению прилежащих участков белого вещества, повышению внутричерепного давления, повреждению сосудистой системы.
Метастатический каскад, в ходе которого опухолевые клетки отделяются от первичного очага, внедряются в окружающие ткани, проникают в кровеносные и лимфатические сосуды, а затем, выходя из сосудистого русла, пролиферируют и обосновываются на новом месте, представляет собой, по сути, не самый действенный метод. Некоторые типы опухолей демонстрируют органоспецифический характер распространения; к примеру, рак простаты часто дает метастазы в кости, а меланома часто метастазирует в легкие, печень и головной мозг. Такую склонность опухолевых клеток к миграции в определенные ткани впервые описал Стивен Педжет, назвав данный процесс теорией «благодатной почвы», где раковые клетки – это метафорически семя, которое прорастает на благоприятствующей его росту почве, под которой подразумевается микроокружение ткани, в которой формируется метастаз. Существовала и альтернативная теория, принадлежащая патологу Джеймсу Юингу, которая гласила о том, что вероятность появления метастазов в том или ином органе зависит от интенсивности его кровоснабжения и плотности сосудистой сети в нем. Но теперь спор Юинга и Педжета остался в прошлом, а современный взгляд на данный процесс заключается в том, что опухолевые клетки, покидая первичную опухоль, делают это в сопровождении компонентов стромы из данного очага, включая активированные фибробласты. Давайте по порядку рассмотрим то, как молекулярные и генетические особенности клеток первичной опухоли, а также микроокружение тканей головного мозга и ангиогенные пути влияют на распространение опухоли в головной мозг.
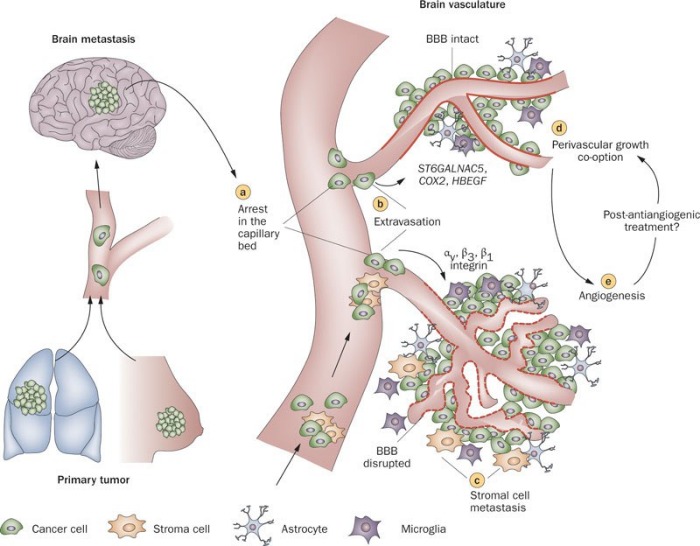
Как только опухолевые клетки попадают в сосуды головного мозга, они задерживаются в местах с низкой скоростью кровотока, например, в капиллярных сетях в точках ветвления сосудов. С этим событием наступают ранние изменения в тканевом микроокружении: опухолевые клетки вступают в контакт с эндотелиоцитами сосудов, которые способствуют росту и инвазии злокачественных клеток, а клетки стромы первичной опухоли, мигрировавшие вместе с опухолевыми клетками, начинают способствовать скорейшему формированию нового очага опухоли в мозге. Совместная со стромальными клетками колонизация тканей мозга дает опухолевым клеткам пролиферативные преимущества и обеспечивает их выживаемость. Кроме того, микроокружение головного мозга отличается от такового в других органах и тканях, а факторы, способствующие или подавляющие заселение и пролиферацию клеток опухоли изучены недостаточно. После проникновения в ткань мозга злокачественные клетки сталкиваются с резидентными клетками ЦНС – астроцитами и клетками микроглии. В эксперименте на мышах, которым было проведено интракаротидное введение клеток рака молочной железы, вокруг опухолевых клеток после их экстравазации в течение недели наблюдалось скопление клеток микроглии. Активированные астроциты с повышенной экспрессией GFAP (глиальный фибриллярный кислый белок) можно наблюдать и того раньше, пока опухолевые клетки еще в сосудистом русле, и они остаются в тесной взаимосвязи и далее, в процессе развития макрометастазов. На животных моделях как реактивные астроциты, так и клетки микроглии располагались не только на периферии, окружая опухоль на ее границах, но и инфильтрировали непосредственно толщу опухоли. Кроме того, на примерах кокультивирования клеток опухоли и глии in-vitro было указано на пятикратное усиление пролиферации опухолевых клеток. С этими данными коррелирует и то, что в 85 % случаев исследованных гематогенных метастатических новообразований головного мозга в перитуморальных астроцитах была зафиксирована повышенная экспрессия эндотелина 1 – регулятора многочисленных процессов трансформации. Также можно предположить, что на ранних этапах внедрения опухолевых клеток в головной мозг еще поддерживается баланс между протективными/трофическими и токсическими свойствами микроглии, зависящий от различных факторов, вырабатываемых клетками, и в конечном итоге переходящий под контроль сигналов от опухолевых клеток.
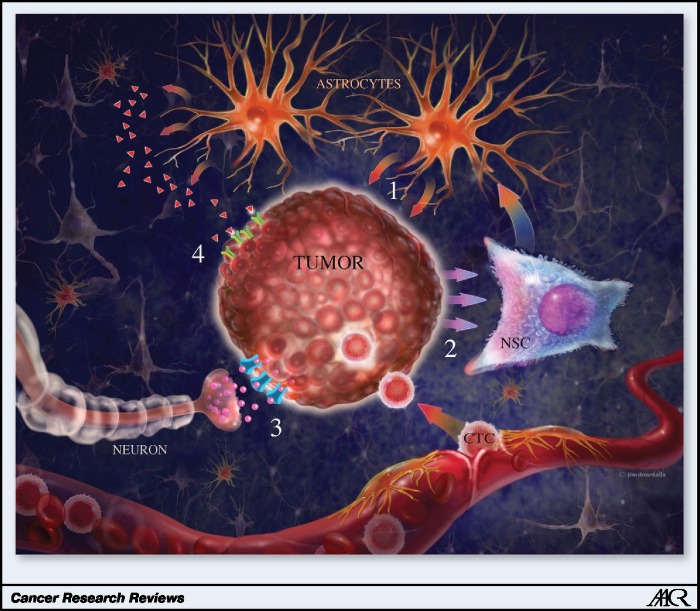
В свою очередь, астроциты могут защищать опухолевые клетки от цитотоксического воздействия химиотерапевтических средств. Экспериментальное кокультивирование клеточных линий человеческой меланомы, рака молочной железы и рака легкого именно с астроцитами, даже не с фибробластами, продемонстрировало резкое предотвращение развития в опухолевых клетках апоптоза в ответ на обработку цисплатином и 5-фторурацилом. При разделении клеток в сосуде с помощью специально подобранной пористой мембраны данный эффект был утрачен, что позволяет сделать вывод о том, что непосредственно контакт астроцитов и опухолевых клеток лежит в основе защиты от цитотоксического воздействия, а, например, не выделяемые астроцитами факторы. Однако эти факторы тоже играют немалую роль во взаимодействии астроцитов со злокачественными клетками. Например, секретируемые клетками опухоли фактор ингибирования миграции макрофагов (MIF), IL‑8, ингибитор активатора плазминогена 1 (PAI-1) провоцируют астроциты к высвобождению молекул IL‑6, TNF‑α и IL‑1β, которые стимулировали пролиферацию опухолевых клеток in vitro. В исследованиях метастатических клеток меланомы в головном мозге было отмечено также значение нейротрофинов и их рецепторов для инвазии и роста клеток меланомы.
Опухоль может обрастать кровеносными сосудами (васкуляризироваться), пользуясь для этого различными механизмами, как например: стимуляция ангиогенеза (образование сосудов из уже существующих); васкулогенез (возникновение сосудистой системы de novo из клеток-предшественников эндотелия); кооптация, когда рост опухоли осуществляется вдоль существующих кровеносных сосудов; ремоделирование сосудов и их захват путем внедрения столбцов интерстициальной ткани в просвет формирующихся сосудов; васкулогенная мимикрия (формирование опухолевыми клетками сосудоподобных каналов, без участия эндотелиальных клеток); трансдифференцировка опухолевых клеток в эндотелиальные; формирование опухолевыми клетками, подобными стволовым, внутренней выстилки кровеносных сосудов головного мозга. Наблюдения за ростом метастазов различных опухолей (рака молочной железы, меланомы, фибросаркомы, рака легкого, рака толстой кишки) в головном мозге на моделях мышей в реальном времени с использованием мультифотонного лазерного сканирующего микроскопа показали, что метастазы могут достигать 3-х мм и более за счет кооптации. Кроме того, плотность микрососудов в опухоли может быть и небольшой в сравнении с клетками нормальной ткани головного мозга, однако просвет сосудов растущей опухоли значительно превышает просвет сосудов в нормальной ткани.
После краткого рассмотрения механизмов, опосредующих метастазирование в ткани головного мозга, хотелось бы обратиться к тому, как же выявить такую опухоль и какие методы терапевтического воздействия существуют.
К основным симптомам, которые могут быть проявлением существующих в головном мозге метастазов, относятся: головные боли (50 %), гемипарезы (50 %), психоорганический синдром (30 %), эпилептические припадки (15-20 %), парезы черепных нервов, признаки повышенного ВЧД.
Кроме метастазирования в ткани головного мозга, метастазы могут попадать в позвоночник (спинальные метастазы), их рост может быть экстрадуральным, интрадуральным экстрамедуллярным и интрамедуллярным. Наиболее часто первичными опухолями при обнаружении экстрадуральных метастазов являются рак легкого и рак молочной железы (при локализации в грудном отделе позвоночника) и рак предстательной железы (при обнаружении метастазов в поясничном отделе). Клинически, как правило, наблюдаются прогредиентные боли в спине, а также признаки синдрома поперечного поражения спинного мозга. Помимо спинальных метастазов, возможно также диффузное метастатическое распространение опухолевых клеток в субарахноидальном пространстве, как в виде солидных адгерентных лептоменингеальных метастазов, так и в виде рассеянных по всему пространству клеток. Наиболее частыми первичными опухолями, дающими такие метастазы, являются рак молочной железы, рак легкого, меланома, лимфомы, лейкоз, также это могут быть и опухоли головного мозга – герминомы, медуллобластомы, примитивные нейроэктодермальные опухоли, эпендимомы, изредка это могут быть пилоцитарная астроцитома и злокачественные глиомы.
Необходимые диагностические мероприятия:
— Клинико-неврологическое обследование (обратить внимание на признаки, могущие свидетельствовать о повышенном внутричерепном давлении).
— МРТ головного мозга с и без гадолиниевого контраста (если есть противопоказания к МРТ – проведение КТ с контрастом и без него); изображения получают, делая Т1-взвешенные серии до и после введения контраста, при одинаковых параметрах, соблюдая одинаковую толщину срезов и их сведение, чтобы различать гиперинтенсивный патологический МР-сигнал на Т1 (особенно характерны для меланина, подострых гематом) от накопления контрастного вещества. Толщина срезов не должна превышать 5-ти мм. Дополнительно рекомендуется сделать серию Т1-взвешенных 3D изображений после введения контраста, благодаря чему можно достовернее выявить распространенные метастазы. По причине лучшего контрастирования искомых объектов, рекомендуется прибегать к получению изображений без инверсии импульса (т.е. предпочтительны серии VIBE, THRIVE, FAME, вместо, например, MPRAGE и подобных). Дополнительная 3D-реконструкция полученных изображений может поспособствовать более четкому определению метастатических очагов, однако при этом не стоит забывать, что и случайные артефакты после реконструкции могут неверно интерпретированы как реальные участки патологии. Диффузно-взвешенная МРТ поможет отличить опухоль от абсцесса.
— Гистологическое подтверждение диагноза: проводится стереотаксическая биопсия или открытое оперативное вмешательство, после чего изъятый кусочек ткани фиксируют в 4-хпроцентном буферизованном растворе формалина. Иногда может потребоваться (например, для молекулярно-биологического исследования) сохранить нативную ткань в состоянии глубокой заморозки (если есть возможность). После фиксации и приготовления парафиновых блоков, окрашенный, например, гематоксилин-эозином препарат среза ткани изучается под микроскопом. Для обнаружения в тканях признаков, специфических для тех или иных видов опухолей, используются специальные красители. Например, выявлению слизеобразования (к примеру, в случае аденокарциноматозных метастазов) или накоплений гликогена (при метастазах светлоклеточного рака) могут послужить гистохимические методы окраски с использованием множества различных красителей: альциановый синий, PAS, серебрение (для ретикулярных волокон), окраска по Гимзе (кроме прочего, имеет важное значение в диагностике метастатических клеток меланомы, лимфом, саркоматозных метастазов). В том случае, если на момент обнаружения метастазов первичная опухоль еще не определена, то иммуногистохимические анализы разных маркеров могут стать источником информации о типе опухоли и ее локализации. Например, метастазы эпителиальной опухоли можно по гистологическим и иммуногистохимическим параметрам отличить от метастатических сарком, меланомы, злокачественных лимфом и опухолей головного мозга. Эпителиальная природа клеток метастатического очага может подтвердиться при исследовании с помощью антител к общему цитокератину (KL-1, MNF116, Lu-5). Экспрессия специфических подтипов цитокератина несет уточняющую информацию о типе опухоли, и в отдельных случаях ее определение может натолкнуть на вывод об исходной опухоли. Антитела к хромогранину А, синаптофизину и CD56 (NCAM) предназначены для установления нейроэндокринной дифференцировки. Большая часть бронхиальных карцином (в особенности аденокарциномы и мелкоклеточный рак) дают позитивный анализ на тиреоидный фактор транскрипции (TTF1); рак простаты может быть выявлен при помощи антител к простатспецифическому антигену; рак щитовидной железы – тиреоглобулина и TTF1. Метастазы рака печени, хотя и крайне редко встречаются в ЦНС, тем не менее, для них может быть определен антиген Hep-Par-1. Клетки, метастазировавшие из очага колоректальной аденокарциномы, как правило, экспрессируют маркер Cdx2; а вот клетки светлоклеточного рака почки положительны на цитокератин 8, виментин, а также CD10. Для дифференциальной диагностики злокачественных герминогенных опухолей интерес представляет определение альфа-фетопротеина (AFP), специфической плацентарной щелочной фосфатазы (PLAP), Oct4 и хорионического гонадотропина человека ((β-HCG). Диагноз «меланома» может быть иммуногистохимически подтвержден даже при беспигментной форме при помощи специфических для меланомы маркеров HMB45, Melan A. Также клетки метастазов меланомы стабильно синтезируют виментин и белок S100, но при этом никаких цитокератинов. Определение BRAF-статуса посредством специфических антител к BRAF V600E диагностически очень важное мероприятие, поскольку позволяет принять решение относительно последующей терапии (например, вемурафениб, дабрафениб). Церебральные метастазы сарком – довольно редкое явление, но, тем не менее, хочется упомянуть о том, что они экспрессируют виментин как основной белок промежуточных филаментов, а также могут быть определены подробнее путем выявления таких маркеров, как десмин, MyoD1, гладкомышечный актин, CD31, CD34, S100, и MIC2. Пролиферативная активность клеток опухоли может быть оценена при иммуногистохимическом анализе, например, при помощи антител к антигену Ki-67, ассоциированному с пролиферативными процессами в клетках.
В отдельных случаях может быть необходимо:
- Поиск первичной опухоли, если изначально она не известна. КТ грудной клетки является важнейшим диагностическим мероприятием, проводимым перед взятием биопсии.
- КТ основания черепа при подозрении на инфильтрацию костей в случае часто дающих метастазы в костную ткань опухолей.
- МРТ-исследование ЦНС при подозрении на спинальные или лептоменингеальные метастазы.
- Исследование ликвора + измерение его давления (также при подозрении на лептоменингеальные метастазы), особенно при несоответствии между локализацией метастатических очагов и клинической картиной. Проводится по возможности после МРТ.
- FDG-PET (ПЭТ с фтордезоксиглюкозой), чаще всего проводится уже после радиохирургической терапии.
Лечение
Средняя выживаемость пациентов после постановки диагноза составляет около месяца при отсутствии лечения и около 2 месяцев при симптоматической терапии стероидами. Среди методов лечения можно выделить резекцию, радиохирургию, фракционную лучевую терапию (стереотаксическое локальное вмешательство или тотальное облучение всего головного мозга), а также медикаментозную терапию. Оценивая эффективность локальной терапии в клинических исследованиях, стоит обратить внимание на то, что срок средней выживаемости обеспечивается не только терапевтическим воздействием непосредственно на метастазы. Более половины всех случаев смерти пациентов обусловлены не метастазами как таковыми, а последствиями системной опухолевой прогрессии.
Оперативное вмешательство
Два из трёх рандомизированных исследований показали преимущество комбинирования хирургического удаления опухоли и лучевой терапии относительно только лучевой терапии. При резекции солитарных (единичных) метастазов с последующим тотальным облучением головного мозга средняя выживаемость повышается до 6‒9 месяцев в сравнении только с одним облучением. В третьем исследовании преимущество проведения оперативного вмешательства подтверждено не было. Однако такой результат был, вероятно, обусловлен тем, что резекция была проведена позднее, после курса лучевой терапии (и вследствие его малой эффективности), а прогнозы пациентов в данной группе были не самыми благоприятными. Также стоит отметить, что, несмотря на наличие данных многочисленных ретроспективных анализов, говорящих в пользу резекции единичных метастазов, нередки случаи рецидивов на месте удалённой опухоли. Риск появления как дистантных метастазов, так и развития нового очага в месте резекции может быть снижен назначением облучения головного мозга сразу после операции.
Инфратенториально локализованные метастазы могут приводить к скорому развитию обструктивной гидроцефалии или компрессии ствола мозга с соответствующим острым неврологическим ухудшением картины, потому такие опухоли должны быть удалены в первую очередь. У пациентов с инфратенториальными метастазами, которые были прооперированы независимо от того, имело ли место последующее облучение или нет, была отмечена большая продолжительность жизни, чем у пациентов, которым была проведена только фокальная лучевая терапия или даже полное облучение головного мозга. Таким образом, проведение оперативного вмешательства предполагают следующие клинические критерии:
- наличие солитарных метастазов,
- отсутствие / низкая степень выраженности неврологических дефицитов,
- отсутствие экстракраниальных проявлений опухоли (или же опухоль манифестировала более, чем за 3 месяца до операции),
- метастазы опухолей, устойчивых к лучевой терапии,
- случаи, когда первичная опухоль не известна,
- при нейрорадиологическом обследовании патологические очаги не были со всей точностью идентифицированы как метастазы,
- опухоль расположена в участке, оперативный доступ к которому не затруднён,
- объёмные опухоли (D>3 см), метастазы с выраженной симптоматикой (например, признаки сдавления мозга), инфратенториальные метастазы,
- риск развития неврологических нарушений вследствие операции ниже такового при отказе от хирургического удаления опухоли.
Даже если метастатических очагов два и более, хирургическое удаление может быть показано при выполнении вышеприведённых условий. Иногда удаляется только большая опухоль, а для избавления от мелких очагов прибегают к радиохирургическому лечению. Пациентам с мелкоклеточным раком лёгкого, герминомой или лимфомой резекция, как правило, не показана, поскольку данные опухоли восприимчивы как к лучевой, так и к химиотерапии, а также склонны к диссеминированному метастазированию (исключение составляют инфратенториальные метастазы). В некоторых случаях может потребоваться повторная операция, например, при окклюзионной гидроцефалии, вызванной метастазами в области водопровода или ствола мозга; проводится эндоскопическая вентрикулоцистерностомия.
Радиохирургия
Метод подразумевает под собой чрескожное стереотаксическое воздействие единичными высокими дозами излучения, что позволяют реализовать такие радиохирургические установки, как линейный ускоритель, гамма-нож, кибер-нож. Для достижения максимальной точности процедура в некоторых случаях требует правильной фиксации рамы и иммобилизации пациента (в этом плане кибер-нож предпочтительнее, так как не требует жёсткой фиксации пациента и проведения инвазивной подготовки перед облучением). Высокие дозы излучения дают неплохие результаты, позволяя взять опухоль под контроль, тогда как окружающие здоровые ткани остаются сохранными благодаря существенному снижению дозы направленной радиации от центра воздействия к периферии (что особенно важно при небольших метастазах). Радиохирургия может быть полноценной заменой нейрохирургической резекции, поскольку данный метод действенен как на радиочувствительные, так и на устойчивые к облучению опухоли. Максимальная допустимая доза при единоразовом облучении зависит от объёма патологического очага и составляет 24 Гр, 18 Гр и 15 Гр при размерах опухоли <20 мм, 21‒30 мм и 31‒40 мм соответственно. Радиохирургическое лечение может назначаться как в качестве первичной терапии единичных или множественных метастазов диаметром до 30 мм и объёмом до 15 мл, так и применяться для повторного вмешательства в случае рецидива. Некоторые ретроспективные когортные исследования указывают на равнозначность радиохирургического лечения и нейрохирургических методов удаления опухолей. Стоит, однако, подчеркнуть, что локальный контроль даже лучше обеспечивается при радиохирургических процедурах. По результатам одного исследования (EORTC 22952-26001 study), общая частота локальной прогрессии составляла 59% после резекции против 31% после радиохирургии. Решение о том, каким подходом воспользоваться — хирургическим или радиохирургическим — принимается в соответствии с клиническими данными. Преимущества инвазивной операции заключаются в возможности гистологического подтверждения диагноза и быстром устранении симптомов, обуславливаемых масс-эффектом. Но хирургическое вмешательство имеет ограничения, связанные с расположением опухоли, поскольку доступ к ней не должен быть сопряжён с вероятностью серьёзных функциональных повреждений здоровых тканей мозга. Радиохирургическое лечение, напротив, может быть назначено при опухоли любой локализации, и потому к нему часто прибегают при маленьких, глубоко лежащих, нерезектабельных опухолях (например, метастазы в стволе мозга). Также к преимуществам радиохирургии можно отнести возможность амбулаторного проведения процедур (или же менее продолжительное пребывание пациента в стационаре). Кроме того, так как процедура неинвазивная, то отсутствуют риски, связанные с возможными сопутствующими заболеваниями пациента, что имеет место быть при проведении операции. В то же время и при радиохирургической терапии могут быть осложнения, самым большим из которых является лучевой некроз (вероятность радионекроза через 2 года после терапии составляет около 11%).
В одном рандомизированном исследовании, которое, к сожалению, было прервано по причине плохого набора, сравнивались оперативное вмешательство с последующим полным облучением головного мозга и радиохирургическое лечение при единичных метастазах; различий в локальном контроле опухоли или выживаемости отмечено не было, но вот отдалённые метастазы чаще встречались в группе пациентов, которым проводилась только радиохирургическая терапия. Учитывая высокую частоту рецидивирования после хирургического удаления метастатической опухоли, а также исходя из данных гистологического исследования (более или менее инфильтративный рост) возможно использование комбинации из резекции и последующего локального фракционированного облучения или радиохирургического воздействия на опухолевое ложе. В ходе другого рандомизированного сравнения радиохирургии в комбинации с тотальным облучением головного мозга и одного только облучения всего головного мозга было показано, что получение отклика на тотальное облучение не прибегая к радиохирургии требует большего количества времени.
Медикаментозная терапия
Протоколы, используемые для медикаментозной терапии метастазов различных опухолей в головном мозге, по сути не отличаются от тех, что применимы для терапии метастазов тех же первичных опухолей в других органах. Медикаментозное лечение может быть назначено в комбинации с лучевой терапией или радиохирургией. Особенный интерес представляют таргетные препараты, всё чаще становящиеся препаратами выбора при некоторых типах опухолей (например, почечно-клеточный рак, колоректальный рак, рак печени HER2/neu-позитивный рак молочной железы, немелкоклеточный рак лёгкого с мутациями EGFR- или EML4/ALK, меланома с мутациями BRAF).
При раке молочной железы у трети пациенток с HER2/neu-положительными опухолями после лечения трастузумабом (антитела к HER2/neu) образуются метастатические очаги в головном мозге. Преимущественное метастазирование опухоли в головной мозг предположительно позволяет опухолевым клеткам избегать воздействия препарата под защитой ГЭБ. Лапатиниб — двойной обратимый EGFR/HER2 ингибитор тирозинкиназы — превосходит по эффективности трастузумаб в терапии церебральных метастазов, однако при монотерапии лапатинибом объективный ответ составляет лишь 6%. В комбинации с капецитабином уровень объективного ответа может достигать 31,8%. Еще больший ответ на данную комбинацию — более 60% — был получен у пациенток, прошедших лучевую терапию. Также, несмотря на отмеченную вероятность формирования метастазов в головном мозге, добавление трастузумаба к комбинации лапатиниба с капецитабином может иметь смысл, поскольку это позволит воспрепятствовать системным метастазам.
Немелкоклеточный рак лёгкого нередко сопровождается транслокациями EML4/ALK. Следствием такой перегруппировки является аутофосфорилирование и конститутивная активность ALK (anaplastic lymphoma kinase), вследствие чего активируются пути RAS и PI3K. Активация сигнального каскада RAS может быть причиной большей агрессивности опухоли и негативно отражаться на клинических результатах. Также перестройки ALK связывают с удвоенным риском прогрессии и рецидивирования опухоли в течение 5 лет и развитием множества метастазов. Одобренным FDA ингибитором тирозинкиназ ALK, MET и ROS1, используемым для медикаментозной терапии немелкоклеточного рака лёгкого, в том числе и церебральных метастазов, является кризотиниб. Ингибируя ALK и MET, кризотиниб предотвращает фосфорилирование тирозина активированной ALK.
При немелкоклеточном раке лёгкого в 10‒20% случаев имеют также место мутации тирозинкиназного домена EGFR, которые сопровождаются тропизмом к ЦНС. Как первичная опухоль, так и церебральные метастазы высокочувствительны к ингибиторам EGFR гефитинибу и эрлотинибу. Чёткие алгоритмы относительно последовательности и комбинации медикаментозной терапии с лучевой терапией или радиохирургией ещё не установлены. Однако хотелось бы привести в пример предварительные результаты одного клинического исследования (фаза IIa): комбинация полного облучения головного мозга с эрлотинибом у 40 пациентов с раком лёгкого дала у 11 пациентов полную ремиссию, у 20 — частичную. Средняя выживаемость в данной группе составила 11,8 месяцев. Статус мутаций EGFR был известен у 17 пациентов: средняя выживаемость пациентов с мутациями EGFR составляла 19,1 месяц и 9,3 месяцев — среди пациентов без мутаций EGFR. В связи с этим стоит отметить, что назначения эрлотиниба в нагрузку к лучевой терапии пациентам без проведённой диагностики мутационного статуса EGFR не имеет смысла. Также в ходе терапии возможно развитие лекарственной устойчивости опухолевых клеток. В этом случае можно попробовать использовать необратимые ингибиторы второго поколения (афатиниб). Что интересно, возникновение церебральных метастазов у пациентов с опухолями при наличии мутации EGFR, которые изначально проходили терапию ингибиторами EGFR, наблюдалось значительно реже, чем у тех пациентов, которые данными препаратами не лечились (21% против 32% в течение двухлетнего наблюдения). Таким образом, не исключено, что ингибиторы EGFR могут быть пригодными для химиопрофилактики церебральных метастазов. Однако соответствующие проспективные исследования отсутствуют.
- April F. Eichler et al.: The biology of brain metastases—translation to new therapies, Nature reviews, 2011
- Krebsfrüherkennung: Evidenz – aktueller Stand – Perspektiven, Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie, 2014
- Role of the Neural Niche in Brain Metastatic Cancer, 2014
- HER-2 Expression in Brain Metastases from Colorectal Cancer and Corresponding Primary Tumors: A Case Cohort Series, 2013
- Hirnmetastasen und Meningeosis neoplastica, Deutsche Gesellschaft für Neurologie, 2017
- Adjuvant Whole-Brain Radiotherapy Versus Observation After Radiosurgery or Surgical Resection of One to Three Cerebral Metastases: Results of the EORTC 22952-26001 Study, 2011
- Targeting brain metastases in ALK-rearranged non-small-cell lung cancer, 2015
- Patricia S. Steeg et al.: Therapeutics for Brain Metastases, Clinical Cancer Research, 2016
