CD20 — первая мишень таргетной терапии и современный терапевтический агент В-клеточных лимфом
CD20 (B1, кластер дифференцировки 20) был открыт в 1980-м году как один из первых маркеров молодых и зрелых В-лимфоцитов. Он представляет собой продукт гена MS4A1 — негликозилированный мембранный белок группы тетраспанинов. Характерной особенностью всех тетраспанинов является наличие четырех схожих трансмембранных участков. В строении CD20 также выделяют две внеклеточные петли, на которых расположены эпитопы взаимодействия с CD20-специфичными антителами [1].
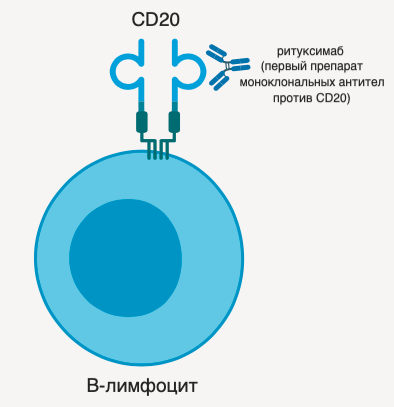 Рисунок 1 ❘ Схема строения CD20, связанного со специфичным антителом.
Рисунок 1 ❘ Схема строения CD20, связанного со специфичным антителом.
На поверхности неизмененных В-лимфоцитов CD20 обнаруживается с самых ранних этапов дифференцировки, начиная с пре-В-клеток. На этапе трансформации В-лимфоцитов в плазматические клетки CD20 утрачивается. Согласно современным представлениям, основная функция CD20 заключается в модификации высвобождения внутриклеточных запасов ионов кальция. Кроме того, с нормальным функционированием и достаточным количеством этого белка тесно связана функция В-клеточного рецептора. По этой причине дефицит корецептора CD20 снижает способность В-лимфоцитов отвечать на антигенную стимуляцию. При этом особую функциональную активность CD20 приобретает после перемещения в липидные рафты — мембранные участки, обогащенные гликосфинголипидами и координирующие работу рецепторных белков [2]. Специальный лиганд для CD20 пока не был обнаружен.
CD20 синтезируется на поверхности не только нормальных, но и неопластически трансформированных В-лимфоцитов, и потому обнаруживается при В-лимфопролиферативных заболеваниях. Этим ограничивается маркерная функция CD20. Посредством его обнаружения можно дифференцировать В- и Т-клеточные лимфомы, однако заболевания внутри В-пролиферативной группы невозможно различить лишь по экспрессии данного рецептора.
На сегодняшний день CD20 является одной из наиболее изученных мишеней воздействия таргетной терапии. Считается, что его использование в качестве терапевтического агента удобно по двум причинам. Во-первых, в случае CD20-положительных опухолей этот рецептор обнаруживается на поверхности В-лимфоцитов в огромном количестве — около ста тысяч молекул на одну клетку. Во-вторых, мембраны стволовых и плазматических клеток не содержат этот белок, что резко снижает количество нежелательных эффектов, связанных с изменениями гемопоэза и иммунореактивности, а также обусловливает высокую чувствительность препаратов [3].
Ритуксимаб был одобрен к применению FDA (Food and Drug Administration, Управление США по санитарному надзору за качеством пищевых продуктов и медикаментов) в 1997 году. Для повышения клинической эффективности в терапии неходжкинских лимфом были разработаны второе и третье поколения аналогов ритуксимаба, а также созданы конъюгаты, используемые для радиоиммунотерапии В-лимфопролиферативных патологий. По мере разработки моноклональных антител, специфичных в отношении CD20, спектр их применения был расширен до терапии рассеянного (множественного) склероза и многих аутоиммунных патологий [3].
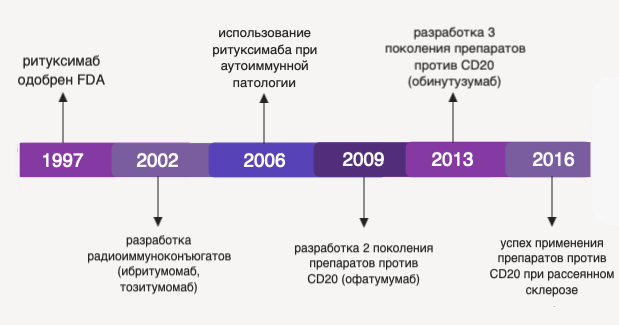 Рисунок 2 ❘ История разработки и внедрения препаратов моноклональных антител против CD20.
Рисунок 2 ❘ История разработки и внедрения препаратов моноклональных антител против CD20.
С 1997 года не был окончательно установлен механизм, обусловливающий клинический эффект ритуксимаба и его аналогов. Однако известно, что действие моноклональных антител, специфичных к CD20, приводит к замедлению пролиферации клеток опухоли, их апоптозу и повышению хемочувствительности. Кроме того, эти препараты призваны модифицировать микроокружение опухоли путем повышения уровня цитотоксичности его клеток [4].
Некоторые ученые называют период с 1997 года по настоящее время “эрой после ритуксимаба”. Это название прижилось в связи с тем, что с 1997 года стремительно растет уровень резистентности опухолей к ритуксимабу и его аналогам. Участились рецидивы опухолей после проведения курсов таргетной терапии, появились группы опухолей, не отвечающих на воздействие известными моноклональными антителами. Среди механизмов резистентности опухоли к действию ритуксимаба наиболее значимы следующие:
- Снижение уровня экспрессии CD20 вплоть до полного ее прекращения;
- Затруднение доступа к опухоли путем модификации микроокружения;
- Изменение активности тирозинкиназ, ассоциированных с CD20;
- Инактивация антител путем изменения клеточного метаболизма [5].
Задачей “эры после ритуксимаба” является разработка новых препаратов и их комбинация с другими терапевтическими агентами. Современными задачами разработки средств, активных в отношении CD20, являются:
- Увеличение чувствительности препаратов;
- Преодоление резистентности опухоли;
- Увеличение скорости гибели опухоли;
- Разработка средств модификации микроокружения опухоли [3].
Как уже было сказано, препараты моноклональных антител против CD20 используются в основном для лечения неходжкинских лимфом. В последнее время эти препараты таргетной терапии нашли применение и в лечении хронического лимфолейкоза [4]. Известно, что в 20–40% случаев лимфомы Ходжкина также являются CD20-положительными. Некоторые исследователи предполагают, что CD20 может играть патофизиологическую роль в развитии лимфомы Ходжкина, однако достоверные подтверждения этому еще не были представлены, и эффекты монотерапии лимфомы Ходжкина препаратами моноклональных антител против CD20 неизвестны [6]. Для охвата большего числа лимфопролиферативных заболеваний разрабатывают также биспецифичные средства, действующие одновременно против CD20 и другого мембранного белка B-лимфоцитов — CD19 [7].
В современных условиях ритуксимаб и его аналоги пока не теряют своей клинической значимости и успешно используются. Однако случаи неэффективности применения таких дорогостоящих средств таргетной терапии заставляют искать новые возможности использования CD20 как терапевтического агента. Возможно, проводимые разработки в будущем решат ключевые вопросы патогенеза и терапии В-лимфопролиферативных заболеваний.
Источники
1. Tetraspanin proteins promote multiple cancer stages. / Martin E. Hemler. // Nat Rev Cancer. - 2014. - Vol. 14. - p. 49-60.
2. Functional role of lipid rafts in CD20 activity? / Janas E, Priest R, Malhotra R. // Biochem Soc Symp. - 2005. - Vol. 72. - p. 165-175.
3. Therapeutic Antibodies: What Have We Learnt from Targeting CD20 and Where Are We Going? / Michael J. E. Marshall, Richard J. Stopforth, Mark S. Cragg. // Front Immunol. - 2017. - Vol. 8. - p. 1245.
4. CD20-based Immunotherapy of B-cell derived Hematologic Malignancies. / Shanehbandi D, Majidi J, Kazemi T [et al.] // Curr Cancer Drug Targets. - 2017. - Vol. 17, №5. - p. 423-444.
5. Rituximab (monoclonal anti-CD20 antibody): mechanisms of action and resistance. / Mitchell R. Smith. // Oncogene. - 2003. - Vol. 22, №47. - p. 7359-7368.
6. CD20 role in pathophysiology of Hodgkin’s disease. / Santos MAO, Lima MM. // Rev Assoc Med Bras. (1992) - 2017. - Vol. 63, №9. - p. 810-813.
7. CD20-CD19 Bispecific CAR T Cells for the Treatment of B-Cell Malignancies. / Martyniszyn A, Krahl AC, Andre MC [et al.] // Hum Gene Ther. - 2017. - Vol. 28, №12. - p. 1147-1157.
