Не Windows, но VISTA

Продолжая темы, в которых раскрываются механизмы работы контрольных точек негативной регуляции иммунного ответа (фармакологические воздействия на которые имеют место как в клинической практике, так и в качестве клинических или лабораторных испытаний), обсудим одного из их представителей, недоступного пока что для внедрения во врачебную практику.
Содержащий иммуноглобулин-V домен супрессор T-клеточной активации (VISTA) входит в семейство B7-ингибиторных иммунных чекпоинт-молекул, к которому также относятся известные многим PD-1, CTLA-4, TIM-3 и LAG-3. Общими усилиями они контролируют иммунный ответ, обеспечивают периферическую иммунную толерантность, противодействуя аутоиммунной агрессии, но способствуя выживанию и развитию инфекционных агентов и злокачественных клеток.
Структура
VISTA содержит IgV домен, находящийся на поверхности клетки. Он связан трансмембранным сегментом с цитоплазматическим доменом, который не содержит ITIM (тирозин-содержащий ингибиторный мотив иммунорецепторов), ITAM (тирозин-содержащий активирующий мотив иммунорецепторов) или ITSM (тирозин-содержащий мотив-переключатель иммунорецепторов), зато имеет два потенциальных ПКC (протеинкиназа C) связывающих сайта. Это позволяет предполагать, что VISTA является рецептором, хотя функциональная роль его еще полностью не изучена.
VISTA чаще встречается у клеток гемопоэтического ряда, экспрессирующих CD11b — гранулоцитов, моноцитов, макрофагов, миелоидных дендритных клеток; а помимо них также у натуральных киллеров (NK), TCRγδ T-клеток, наивных CD4+ и CD8+ TCRαβ T-клеток, и Foxp3+
CD4+ регуляторных T-клеток (Treg). VISTA не экспрессируется на B-лимфоцитах и NK CD56+ клетках.
Механизм
Существует парадигма лиганд-или-рецептор, раскрывающая пути регулирования T-клеточной активации VISTA-чекпоинтом. В одном случае VISTA играет роль лиганда, этот путь называется T-кл-внешним. В другом VISTA — рецептор, этот путь называется T-кл-внутренним. Оба эти пути способны дополнять друг друга.
Внешний путь
В данном механизме основную роль берет на себя внеклеточный домен VISTA (ECD-VISTA). Предполагается, что внеклеточный домен VISTA взаимодействует с коингибиторными рецепторами на Т-клетках и дозозависимо подавляет Т-клеточную пролиферацию, продукцию цитокинов (в т. ч., IL-2 и IFN-γ). Фосфорилирование нескольких ключевых проксимальных сигнальных молекул TCR (в т. ч., LAT, PLC-yl и SLP76) и апрегуляция ранних маркеров активации (CD69, CD44, CD25) подавляется взаимодействием с VISTA-ECD. Одновременно наивные Т-клетки и Т-клетки памяти имеют чувствительность к ингибиторным сигналам VISTA-ECD. Вдобавок, VISTA-ECD способствует конверсии Foxp3− CD4+ T клеток в Foxp3+ адаптивные Treg в присутствии TGF-b.
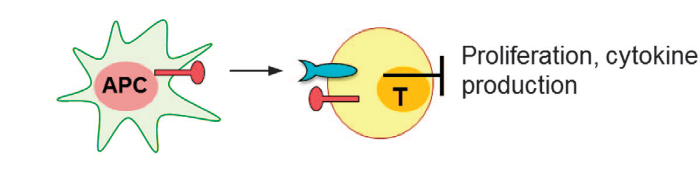
«Лигандная» активность VISTA, экспрессируемого на АПК (антиген-презентирующих клетках, АПК), продемонстрирована на A20 клетках B-лимфомы или костно-мозговых дендритных клетках (ДК), которые используются с целью стимулирования T-клеток в присутствии родственных пептидов. Гиперэкспрессия VISTA на вышеупомянутых клетках уменьшает пролиферацию и продукцию цитокинов Т-клетками.
Кроме того, экспрессия VISTA позволяет избежать противоопухолевой иммунной активности, индуцированной специфической вакциной.
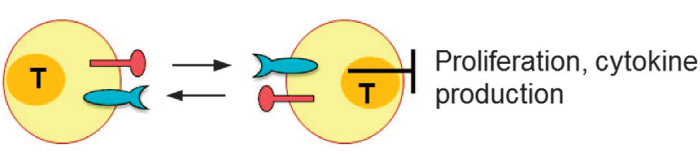
Внутренний путь
В данном случае VISTA экспрессируется на Т-клетках и может взаимодействовать с предполагаемым ингибирующим рецептором на Т-клетках посредством их взаимодействия (T-клетка с Т-клеткой), или может выступать в качестве само-сигнального рецептора. Результаты такой активности практически совпадают с описанными во внешнем пути.
Как и некоторые другие белки контрольных точек, VISTA вовлечен в регуляцию таких состояний, как воспалительные заболевания, онкоиммунология и аутоиммунные заболевания.
В целом, VISTA в рамках вышеперечисленных патологий влияет на иммунные клетки следующим образом:

В частности, на мышиной модели псориаза была рассмотрена противовоспалительная функция VISTA. Трансгенные мыши с отсутствием гена, кодирующего VISTA (Vsir) демонстрировали снижение уровня периферической толерантности, гиперфункцию CD4+ и CD8+ клеток. При помощи инъекции агониста TLR-7 имиквимода трансгенным мышам было продемонстрировано выраженное псориазоподобное воспаление в месте введения. Механизм, обуславливающий развитие данного явления, следующий: TLR-7 сигналлинг у Vsir-дефицитных мышей на ДК приводил к гиперактивации Erk1/2 и Jnk1/2 и к повышенной продукции IL-23. В свою очередь, IL-23 способствовал экспрессии IL-17A одновременно у TCRγδ T клеток и у CD4+ Th17 клеток. Более того, VISTA регулировал периферический гомеостаз CD27− γδ T клеток и их активацию через TCR или через стимуляцию цитокинами. VISTA контролировал секрецию IL-17A в этих T-клетках, регулируя воспалительный ответ.
Также VISTA приводит к негативной регуляции Th2 иммунного ответа, что продемонстрировано на мышиной модели Th2-индуцированной астмы. Подавление функции VISTA (например, с помощью специфических антител) во время аллергической сенситизации усиливает образование аллерген-специфичных Th2 цитокинов и Th2-опосредованной продукции антител, способствует секреции IL-13. Вдобавок, во время аллергизации во вторичных лимфоидных тканях обнаруживаются T-клетки с повышенной экспрессией IL-4, IL-5 и IL-13. Тем не менее, явного воздействия на эозинофильную инфильтрацию нет. К тому же, VISTA никак не влиял на уровни IFN-γ, что наводит на мысль об избирательном воздействии VISTA на Th2 иммунный ответ.
В экспериментах на мышиной модели рассеянного склероза блокирование VISTA приводило к прогрессии заболевания, потенцированию активности CD4+ клеток. Подобным образом отключение гена Vsir, кодирующего VISTA, усугубляло симптоматику индуцированной системной волчанки у мышей через гиперэкспрессию костимулирующих TCR молекул CD80, CD40 и MHC II (главный комплекс гистосовместимости II) и гиперпродукцию цитокинов IFN-γ и IL-10.
Роль VISTA в опухолевом иммунитете проявляется в воздействии не на одно звено онкоиммуносупрессии, но в целом на периферическую толерантность и иммунное опухолевое окружение.
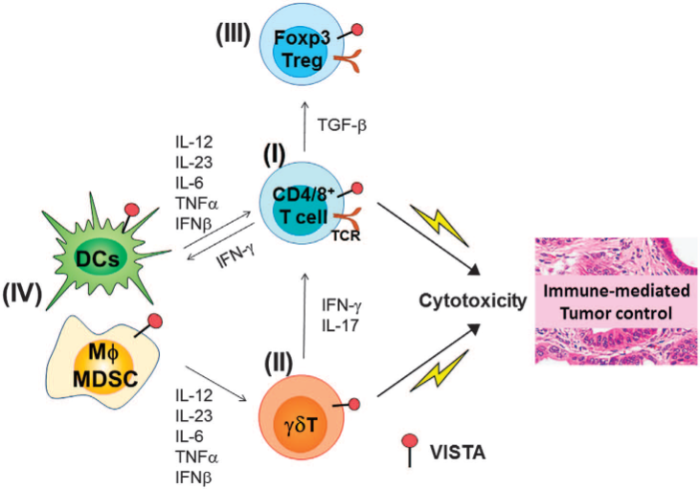
II) VISTA располагается на TCRγδ, тем самым контролирует периферический гомеостаз CD27- Т-клеток, подавляя продукцию IL-17.
III) VISTA потенцирует супрессивную функцию Foxp3+CD4+ Treg.
IV) VISTA снижает активацию миелоидных клеток через TLR-сигналлинг, тем самым уменьшая продукцию воспалительных цитокинов, таких как IL-12, IL-23, IL-6, TNF-α, IFN-β и т. д.
Использование специфических антител к VISTA демонстрирует выраженный противоопухолевый эффект (в т. ч., в отношении опухолей мочевого пузыря и меланомы).
Антитела значительно повышают опухолевую инфильтрацию, пролиферацию, синтез цитокинов и цитотоксическую функцию одновременно CD4+ и CD8+ Т-клеток. Кроме того, ингибирование VISTA приводит к снижению иммуносупрессивной деятельности Foxp3+CD4+ Treg, подавляя к тому же периферическую толерантность и инфильтрацию опухоли наивными CD4+ Т-клетками. VISTA-специфические антитела индуцируют активацию опухоль-ассоциированных дендритных клеток путем апрегуляции экспрессии CD80 и MHC-II, и, как следствие, повышения продукции IL-12 и TNF-α. Снижается количество миелоидных супрессорных клеток, инфильтрирующих опухоль.
Блокирование одновременно VISTA и других белков контрольных точек оказывает синергический эффект на противоопухолевую терапию. Так, использование CTLA-4 и PD-1 ингибиторов вкупе с антителами к VISTA повышает эффективность противоопухолевой терапии на 50 %!
Однако такая комбинация значительно повышает и усугубляет побочные эффекты, но в меньшей степени, чем комбинация некоторых других блокаторов иммунных чекпоинтов (например, PD-1/LAG-3).
Подытожим: VISTA-таргетная терапия обладает потенциалом в лечении аутоиммунных, воспалительных и онкологических заболеваний. На данный момент начинаются клинические исследования VISTA-чекпоинт ингибиторов в терапии онкопатологии (например, CA-170 — препарат комбинированного действия, блокатор PD-L1/PD-L2 и VISTA)
Литература:
- Wenwen Xu, Tạ Minh Hiếu, et al “The structure, expression, and multifaceted role of immune-checkpoint protein VISTA as a critical regulator of anti-tumor immunity, autoimmunity, and inflammation”. Cellular and Molecular Immunology (2018) 14, 1–9
- Ohno T1, Zhang C, et al “The immune checkpoint molecule VISTA regulates allergen-specific Th2-mediated immune responses”. Int Immunol. 2018 Feb 3;30(1):3-11.
- Na Li, Wenwen Xu, et al “Immune-checkpoint protein VISTA critically regulates the IL-23/IL-17 inflammatory axis”. Sci Rep. 2017 May 3;7(1):1485.
- https://clinicaltrials.gov/ct2/show/NCT02812875?term=VISTA&type=Intr&cond=Cancer&rank=2
