Применение пальмитоилэтаноламида в лечении хронической боли. Мета-анализ объединенных данных.
Нейровоспаление характеризуется инфильтрацией иммунных клеток, активацией тучных и глиальных клеток и продукцией воспалительных медиаторов в периферической центральной нервной системе. Растёт число доказательств важной роли нейровоспаления в развитии и поддержании хронической боли. Это поддерживает идею применения новых терапевтических подходов в лечении хронической боли, основанных на противовоспалительных медиаторах и медиаторах разрешения воспаления, которые действуют на иммунные клетки, в частности, на тучные клетки и глию, тем самым ослабляя или прекращая воспаление. К этим медиаторам относится пальмитоилэтаноламид (ПЭА), который снижает активацию тучных клеток и контролирует поведение глии.
Для оценки эфффективности и безопасности пальмитоилэтаноламида на интенсивность боли у пациентов, страдающих от хронической и нейропатической боли, был проведен мета-анализ клинических исследований ПЭА.
В мета-анализ были включены двойные слепые, контролируемые и открытые клинические испытания. Суммарно было включено 12 исследований, 3 из которых были двойными слепыми, сравнивающими действующее вещество с плацебо, 2 были открытыми испытаниями нового препарата против стандартной терапии и 7 были открытыми исследованиями без контроля.
Мета-анализ показал, что ПЭА вызывает прогрессивное снижение боли сильнее, чем контрольные препараты. Ни в одном исследовании не было зарегистрировано побочных эффектов и нежелательных реакций, связанных с приемом ПЭА. Результаты позволяют говорить, что ПЭА представляет собой новую терапевтическую стратегию для лечения хронической и нейропатической боли, связанной с нейровоспалением.
Пальмитоилэтаноламид является эндогенным амидом жирной кислоты (FAE), принадлежащим к классу лигандов ядерных факторов. ПЭА связывается с рецептором в клеточном ядре и вызывает широкий спектр изменений биологических функций, относящихся к хронической боли и воспалению. Его главной мишенью является α-рецептор, активируемый пероксисомным пролифератором (PPAR-α). ПЭА также имеет аффинность к каннабиноидоподобным рецепторам GPR55 и GPR119, связанным с G белками. Однако ПЭА не может считаться классическим эндоканнабиноидом, так как у него отсутствует аффинность к каннабиноидным рецепторам CB1 и CB2. Тем не менее, в присутствии ПЭА (и других структурно близких N-ацилэтаноламидов) происходит усиление активности анандамида, названное “эффектом синергии” (“entourage effect”).
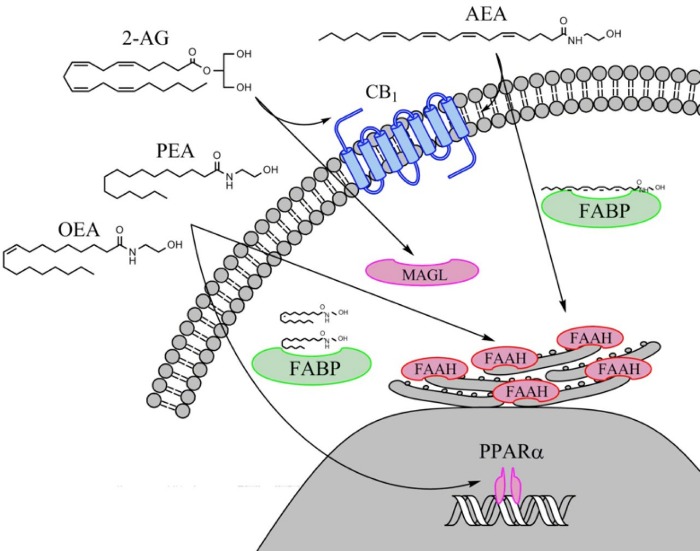
Пальмитоилэтаноламид (PEA) и олеоилэтаноламид (OEA) активируют ядерные рецепторы PPARα, в ядро они переносятся белками, аналогичными тем, что транспортируют жирные кислоты (fatty acid binding proteins — FABPs).
Ряд исследований показал, что при боли и хроническом воспалении происходят дисбаланс в эндоканнабиноидной системе и изменения уровня ПЭА. Например, при β-амилоид-индуцированном нейровоспалении развитие заболевания сопровождает дисрегуляция каннабиноидных рецепторов и их эндогенных лигандов. Также была продемонстрирована противовоспалительная, антиноцицептивная, нейропротективная и противосудорожная активность ПЭА.
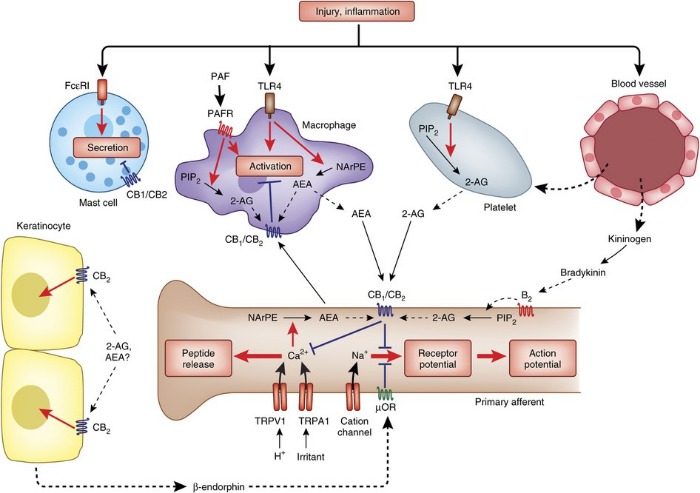
Эндоканнабиноиды контролируют периферические ноцицептивные сигналы
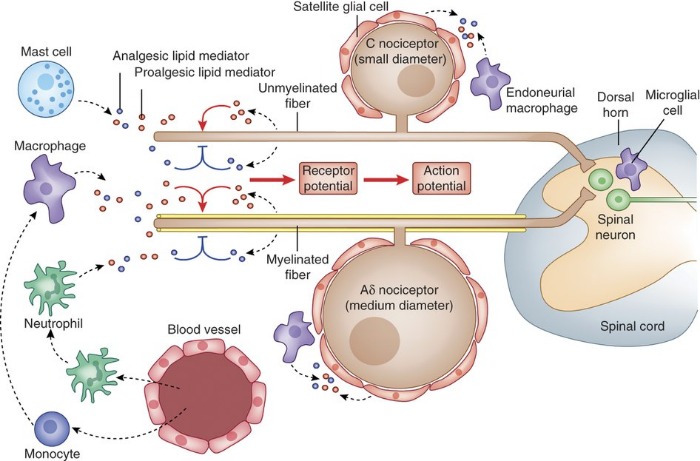
Периферическая регуляция ноцицептивных сигналов липидными медиаторами
ПЭА, как N-ацилэтаноламид, имеет физико-химические свойства, сравнимые с анадамидом, и, хотя он не является эндоканнабиноидом, ПЭА часто изучается в сочетании с анандамидом из-за перекрытия их синтетических и метаболических путей. N-ацилэтаноламиды, такие как ПЭА, часто действуют в качестве сигнальных молекул, активируя внутриклеточные и мембранно-связанные рецепторы и регулируя многие физиологические функции, связанные с воспалительным каскадом и состоянием хронической боли. Эндоканнабиноидные липиды широко распространены в природе: они встречаются во множестве растений, в тканях беспозвоночных и млекопитающих.
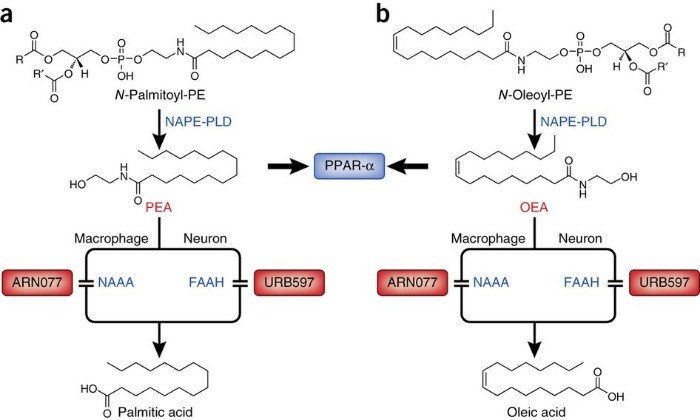
Синтез и инактивация ПЭА и OЭA
Механизм действия ПЭА иногда описывается как аутокоидный антагонизм локального повреждения (Autacoid Local Injury Antagonism - ALIA), и ПЭА в рамках этой номенклатуры относится в алиамидам. Акроним ALIA был впервые предложен группой лауреата нобелевской премии Rita Levi-Montalcini, которая в 1993 году первые предоставила доказательства, что N-ацилэтаноламиды, такие как ПЭА, могут регулировать активацию тучных клеток. Аутокоиды являются местно синтезируемыми регуляторными молекулами. Алиамиды представляют собой аутокоиды, синтезируемые по востребованию в ответ на повреждение, и их действие направлено на устранение патологии. Вскоре после публикации Levi-Montalcini было показано, что тучные клетки являются важной мишенью противовоспалительной активности ПЭА, и с 1993 года как минимум в 25 публикациях были описаны различные эффекты ПЭА на тучные клетки.
Также получены доказательства, что тучные клетки находятся в непосредственной близости от нервных окончаний и их дегрануляция может усилить ноцицептивный сигнал - причина, почему периферические тучные клетки считаются провоспалительными и проноцицептивными. Активность ПЭА в настоящее время рассматривается в качестве нового подхода для лечения нейропатической боли и при похожих заболеваниях (таких как диабет и глаукома), основанных на гиперактивации глии и родственных клеток. Микроглия играет ключевую роль в феномене увеличения интенсивности хронической боли (“wind-up” phenomenon) и центральной сенсибилизации.
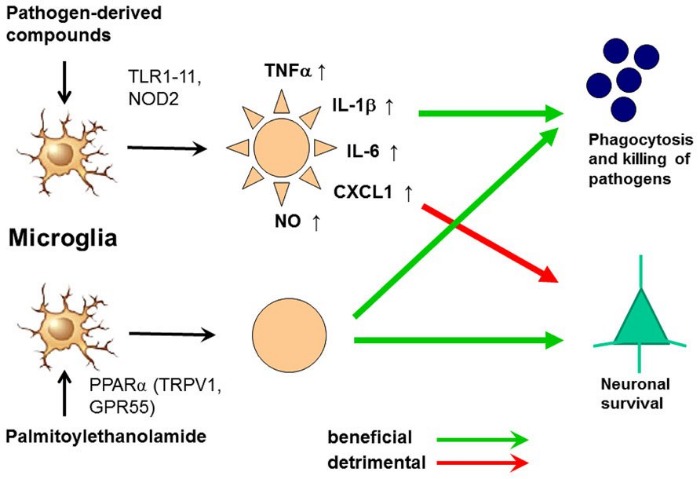
Активация микроглии агонистами TLR и ПЭА.
Метаболизируется ПЭА клеточными ферментами - гидролазой жирных кислот и N-ацилэтаноламид-гидролизующей ацидамидазой; последняя обладает большей специфичностью относительно ПЭА и других амидов жирных кислот.
Источники и дополнительная информация:
- https://www.ncbi.nlm.nih.gov/pubmed/26815246 — публикация
- https://en.wikipedia.org/wiki/Palmitoylethanolamide — PEA
- http://www.frca.co.uk/article.aspx?articleid=100514 — феномен wind-up
- https://www.liveinternet.ru/users/39446/post337121752/ — каннабиноиды и entourage effect
