«Слушая наше дыхание…» Роль тканевой гипоксии в канцерогенезе

Знакомьтесь, новый друг опухоли — гипоксический стресс.
Жизнь на Земле в целом и жизнь конкретной клетки зависят от кислорода. Концентрация (напряжение) кислорода в окружающей организм/клетку среде, близкая к атмосферному (т. е. к 21 %), называется нормоксия. Отклонения от данного значения расценивают как гипо- или гипероксию. Физиологическая гипоксия присутствует во множестве нормальных тканей, включая сетчатку, мозговое вещество почки, эпидермис кожи и костный мозг (гипоксические ниши). Как нормальные, так и опухолевые клетки адаптируются к гипоксической микросреде путем регулирования экспрессии белка семейства факторов транскрипции, индуцируемых гипоксией (HIF). HIF представляют собой димерные белки, состоящие из O2-чувствительной α-субъединицы (HIF-1α, HIF-2α или HIF-3α) и β-субъединицы (ядерный транслокатор HIF-1β). Гены, индуцированные гипоксия-зависимыми HIF-1α и HIF-2α, играют важную роль в регуляции различных аспектов канцерогенеза, таких как ангиогенез, устойчивость к апоптозу, химио- и радиорезистентность, пролиферативная активность, инвазивный потенциал и метастазирование, регуляция pH микроокружения опухоли и ее метаболизм в целом, ускользание от иммунного надзора и поддержание пула раковых стволовых клеток [1].
Гипоксия и предательство иммунной системы
Гипоксическая среда в опухолевой ткани способствует подавлению противоопухолевого иммунного ответа за счет трансформации клеток миелоидного ряда в иммуносупрессивные фенотипы. В экспериментальных моделях подтверждено, что гипоксические зоны в солидных опухолях инфильтрируются большим количеством иммуносупрессивных «клеток-предателей», таких как миелоидные клетки-супрессоры, ассоциированные с опухолью макрофаги и T-регуляторные (Treg) клетки (Рис. 1) [2,3].
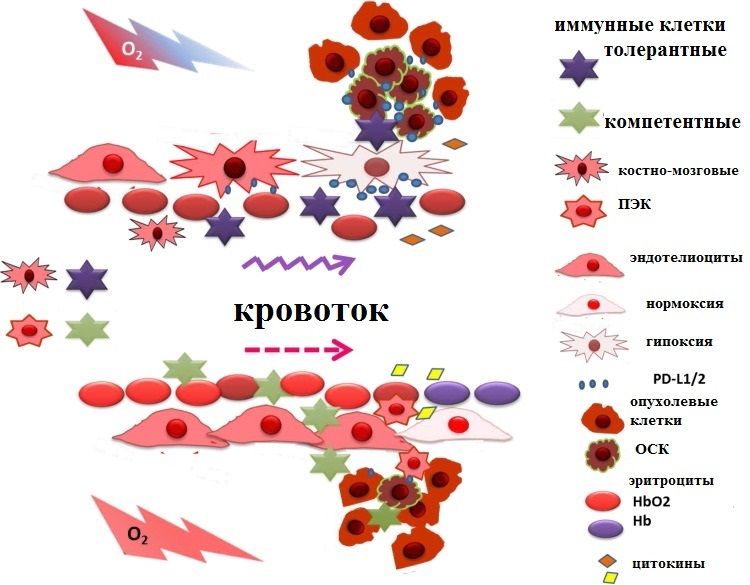
Рисунок 1 | Влияние гипоксии на рекрутирование иммунных клеток опухолевым микроокружением. В условиях гипоксии микроокружение опухоли рекрутирует индуцирующие толерантность иммунные клетки: T-регуляторные клетки и M2-ассоциированные с опухолью макрофаги. В условиях снижения гипоксии тканевой среды изменяются клеточные сигналы (цитокины), для миграции в опухолевый очаг иммунокомпетентных клеток, экспрессирующие на своей поверхности PD-1: NK-клетки и цитотоксические Т-лимфоциты (ЦТЛ) [2]. ПЭК — клетки-предшественницы эндотелиальных клеток (костно-мозговые), ОСК — опухолевые стволовые клетки.
Гипоксическая стимуляция гетерогенности опухолевых клеток
Гипоксия и HIF не только индуцируют дедифференцировку опухолевых клеток в незрелый «стволовой» фенотип, но и поддерживают опухолевые клетки со свойствами стволовых клеток, посредством экспрессии факторов плюрипотентности, таких как OCT4, SOX2 и NANOG, необходимых для поддержания самообновления в стволовых клетках, или активации сигнального пути Notch, который регулирует самообновление и дифференцировку клеток. Опухолевые клетки, избыточно экспрессирующие HIF, обнаруживают более низкий уровень дифференцировки, и следовательно, более высокий потенциал стволовости по сравнению с хорошо оксигенированными клетками. А так как постоянная пролиферация клеток также сопровождается высокими уровнями HIF, клеточная дифференцировка незлокачественного опухолевого микроокружения тоже угнетается, представляя собой «бомбу замедленного действия» с высоким потенциалом злокачественности [2].
Гипоксическая пластичность опухолевых клеток
Эпителиально-мезенхимальный переход — это процесс трансдифференцировки, при котором поляризованные эпителиальные клетки теряют свои эпителиальные черты, приобретая мезенхимные особенности, обусловливающие более высокий инвазивный потенциал. Также возможен возврат в эпителиальное состояние, частично или полностью (мезенхимально-эпителиальный переход). Поэтому наиболее точным термином является эпителиально-мезенхимальная пластичность (ЭМПл). В нескольких исследованиях обнаружено, что гипоксия способствует дизрегуляции экспрессии молекул клеточной адгезии и развитию ЭМПл при различных типах злокачественных новообразований, включая рак предстательной железы, молочной железы, почек, поджелудочной железы, рак легких и плоскоклеточный рак кожи [2] Так называемые циркулирующие опухолевые клетки, которые генерируются в первичной опухоли, освобождаются от межклеточных плотных контактов и колонизируют отдаленные органы, экспрессируют маркеры мезенхимной стадии ЭМПл [5].
Рассматривается связь гипоксии с повышенной нестабильностью генома. Обнаружена дизрегуляция микроРНК (miRNAs) в гипоксических очагах, где выявлена гиперэкспрессия miR-133a-3p [4].
Сосудистые эффекты гипоксии
Важнейшим элементом роста опухоли является развитие сосудистой сети, которая сильно дезорганизована и постоянно меняется из-за изменения числа кровеносных сосудов. Следствием этого являются колебания уровня кислорода и глюкозы, что приводит к сменяющим друг друга состояниям гипоксии, анаэробного и аэробного гликолиза. Сначала в результате персистирующей оксигенации в опухоли с новообразованными сосудами наблюдается аэробный гликолиз. В условиях увеличения площади гипоксических участков и выраженности снижения уровня молекулярного кислорода в клетках (как опухоли, так и ее микроокружения), увеличивается гипоксическая трансформация с увеличением всех гликолитических белков, транспортеров глюкозы (GLUT-1 и GLUT-3), гексокиназы 1 и 2, фосфофруктокиназы (PFK), альдолазы, глицеральдегида-3-фосфатдегидрогеназа (GAPDH), фосфоглицераткиназю (PGK), енолазы, пируваткиназы, а также лактатдегидрогеназы (LDH). При этом в гетерогенной опухолевой популяции и ее нише каждая клеточная линия имеет индивидуальный порог для гипоксической трансформации, вызывающей гликолиз [5].
И выдыхая после прочитанного…
Уточнение роли опухолевого микроокружения в прогрессировании канцерогенеза необходимо для углубленного понимания фундаментальной биологии злокачественных новообразований и поиска новых путей терапии. Создаваемая солидными опухолями враждебная гипоксическая микросреда может значительно препятствовать противоопухолевому иммунному ответу (преимущественно клеточно-опосредованному) и ослаблять эффективность иммунотерапии. Также в условиях гипоксии в «опухолевой Спарте» происходит отбор наиболее агрессивных клеток. Кроме этого, в данных условиях клетки повышают свой потенциал пластичности, что в итоге обусловливает патоморфоз опухоли, повышая клональную гетерогенность. И тут гипоксия становится новой перспективной мишенью противоопухолевой терапии. Воздействие на различных этапах гипоксического сигнального каскада, как ожидается, значительно снизит способность опухоли ускользать от иммунной системы, улучшит доставку «боеприпасов» (повысив эффективность как медикаментозной, так и лучевой терапии) и ударит прямо в тыл врага — в ее базы снабжения в виде микроокружения.
Итак, чтобы опухоль «задохнулась», нужен усиленный приток кислорода. И направить диверсантов (таргетные препараты) логичнее всего в сосудистое русло, способствуя его ремоделированию и улучшению газообмена в опухолевом стане.
Источники:
1. Rankin, E. B. & Giaccia, A. J. Hypoxic control of metastasis. Science, 352, 175–180 (2016)
2. Noman, M. Z., Hasmim, M., Messai, Y., Terry, S., Kieda, C., Janji, B., & Chouaib, S. (2015). Hypoxia: a key player in antitumor immune response. A Review in the Theme: Cellular Responses to Hypoxia. American journal of physiology. Cell physiology, 309(9), C569-79
3. Li, Y., Patel, S. P., Roszik, J., & Qin, Y. (2018). Hypoxia-Driven Immunosuppressive Metabolites in the Tumor Microenvironment: New Approaches for Combinational Immunotherapy. Frontiers in immunology, 9, 1591. doi:10.3389/fimmu.2018.01591
4. Vinayak Bhandari et al, Molecular landmarks of tumor hypoxia across cancer types, Nature Genetics (2019). DOI: 10.1038/s41588-018-0318-2
5. Li, C. H., Haider, S., Shiah, Y.-J., Thai, K. & Boutros, P. C. Sex differences in cancer driver genes and biomarkers. Cancer Res.78, 5527–5537 (2018)
6. Li, Y., Patel, S. P., Roszik, J., & Qin, Y. (2018). Hypoxia-Driven Immunosuppressive Metabolites in the Tumor Microenvironment: New Approaches for Combinational Immunotherapy. Frontiers in immunology, 9, 1591. doi:10.3389/fimmu.2018.01591
