Канцерогенез за гранью хромосом

Капитан — экипажу: «Те из вас, кто давно на службе, уже встречались с инопланетянами. Вы знаете, что главная опасность — это мы сами, наш иррациональный страх перед неизвестным. Но неизвестного не бывает — есть лишь то, что мы пока еще не поняли».
Джеймс Тиберий Кирк
Развитие методов молекулярной биологии все больше расширяет наши представления о многообразии и сложности процессов жизни клеток. Привычное представление о локализации клеточной ДНК в длинных линейных цепях хромосом уже пошатнули выявленные исключения, такие как митохондриальная ДНК, плазмиды в дрожжах и двойные микрохромосомы в раковых клетках, где ДНК присутствует во внехромосомных кольцевых фрагментах. Следующий удар нанесло обнаружение специализированных внехромосомных кольцевых ДНК (вхДНК), которые возникают из повторяющихся геномных последовательностей (например, теломерная ДНК, рибосомная ДНК). А недавним нокаутом стали вхДНК в нормальных и злокачественно трансформированных клетках, составленные их уникальных (неповторяющихся) последовательностей, которые значительно повышали неоднородность клеточной популяции (Рис. 1) [1, 2].
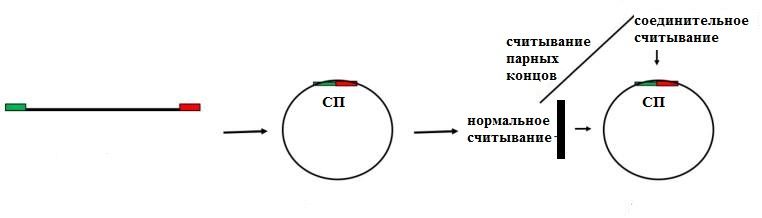
Рисунок 1 | Схематическое изображение внехромосомных ДНК.
Два конца линейной ДНК лигируются, что создает новую соединительную последовательность (СП), которой нет в родительской линейной ДНК. В ходе секвенирования считывается СП (соединительный тег / считывание), которая действует как дискриминационный признак в компьютерных алгоритмах, подтверждая, что фрагмент ДНК находился внутри кольцевой молекулы ДНК [1,2].
Функциональный потенциал
Многие исследователи рассматривают вхДНК как нового игрока на поле генетической гетерогенности опухолей, способного влиять на амплификацию онкогенов и генов лекарственной устойчивости, усиливая злокачественный потенциал опухолевой популяции. При этом вхДНК, как успешный житель мегаполиса, трудится в режиме «супермногозадачности». Высказываются предположения о возможной регуляции вхДНК экспрессии регуляторных РНК, способствующих развитию и трансформации опухолевого микроокружения, активации факторов транскрипции, повышению устойчивости поврежденных молекул ДНК, поддержанию высокого уровня экспрессии генов-мишеней. Также предполагается участие в процессах старения и апоптоза, механизмах межклеточной коммуникации, клеточного иммунного ответа.
Все более очевидным становится вклад внехромосомных молекул в эволюцию опухоли. ВхДНК были обнаружены почти в 40 % опухолевых клеточных линий и почти в 90 % моделей опухолей головного мозга (нейросферы и опухолевые ксенотрансплантаты), построенных из биопсийного материала реальных пациентов. Эти исследования также предоставляют математические и экспериментальные доказательства того, что не всегда «старый друг лучше»: амплификация онкогенов и гетерогенность опухоли достоверно выше при амплификации в вхДНК, чем в хромосомах. Из-за случайного распределения этих молекул в дочерние клетки во время каждого деления одна из дочерних клеток может наследовать большее количество копий вхДНК с драйвером-онкогеном, и таким образом приобретать пролиферативное преимущество (рис. 2) [3]. Количество специфических вхДНК в клетках также может изменяться в ответ на условия окружающей среды, тем самым обеспечивая дополнительный механизм адаптации опухоли. Примером этого процесса является глиобластома, где выявляются частые мутации EGFR, с наиболее распространенным онкогенным вариантом EGFRvIII. Хотя профиль EGFRvIII способствует росту опухоли, он также повышает чувствительность к ингибиторам тирозинкиназы EGFR. При этом потеря двойных микрохромосом с мутантным EGFR, напротив, повышает устойчивость к данным препаратам [4].
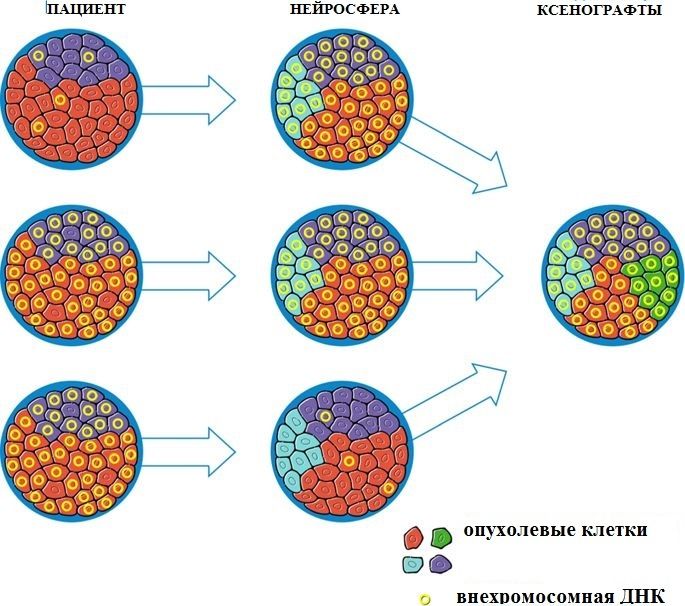
Рисунок 2 | Геномная гетерогенность глиобластом.
Данные секвенирования ДНК и РНК на образцах глиобластом и полученных из них моделях нейросфер и ортотопических ксенотрансплантатов. Наличие онкогенных вхДНК сохранялось на протяжении всего заболевания, длительная экспозиция усиливала гетерогенность генома, независимо от исходного состояния и последующих изменений хромосомной ДНК [3].
Инволютивные изменения клеток также могут контролироваться внехромосомными агентами. Обнаружены вхДНК, содержащие гены рибосомной РНК, процесс накопления которых приводит к старению дрожжевых клеток. Эти рДНК имеют автономно реплицирующуюся последовательность и способны самореплицироваться. Более того, в каждом клеточном делении они отделяются от материнских клеток. В итоге происходит экспоненциальное увеличение количества этих вхДНК в стареющих материнских клетках, в то время как ограничение их количества в дочерних клетках продлевает тем продолжительность жизни [2].
ВхДНК также могут играть роль в генной «компенсации», способствуя амплификации утраченных генов. У S. cerevisiae гистоны H2A и H2B кодируются двумя парами генов, названными HTA1-HTB1 и HTA2-HTB2. Когда HTA1-HTB1 удаляется, дозовая компенсация происходит путем амплификации гена HTA2-HTB2 посредством образования новой вхДНК, содержащей 39 килобайт хромосомы II, которая включает HTA2-HTB2, гистоновый локус H3-H4 и центромеру и обеспечивает начало репликации. Эта новая вхДНК создается путем рекомбинации между двумя ретротранспозонными элементами Ty1, которые фланкируют эту область. В удаленных штаммах HTA1-HTB1 образование вхДНК HTA2-HTB2 компенсаторно повышено, что позволяет поддержать высокую экспрессию H2A и H2B [2].
Кроме того, обнаружен подтип вхДНК, имеющий меньшие размеры, чем двойные микрохромосомы, но при этом значительно превосходящий их количественно. Эти микро-вхДНК (200–400 пар оснований) слишком малы, чтобы содержать гены, кодирующие белки, но достаточно длинные, чтобы кодировать регуляторные короткие РНК или фрагменты белков. Другой возможной функцией микроДНК может быть «молекулярное спонгирование»: они могут действовать как «губки» для факторов транскрипции, и таким образом косвенно контролировать экспрессию генов. Исследования подтвердили присутствие микроДНК в виде циркулирующей ДНК в сыворотке и плазме как мыши, так и человека. Их рассматривают как потенциальные биомаркеры для жидкой биопсии. Обсуждается возможность передачи межклеточных сигналов с их помощью [5].
ВхДНК высвобождаются в цитоплазму во время митоза и либо разрушаются ферментами, такими как TREX1, либо активируют путь cGAS, который завершается экспрессией интерферона и стимуляцией иммунной системы. Таким образом, вхДНК, особенно если они не защищены хроматином, могут выступать в роли эндогенных антигенов, активирующих аутоиммунные пути.
Клиническая значимость
Наиболее важно для внедрения вхДНК как биологического маркера дифференцировать их в опухолевой и нормальной ткани (рис. 3). Результаты секвенирования целого генома, структурного моделирования и цитогенетического анализа различных типов рака, включая анализ структуры и функции хромосом во время метафазы клеток, подтвердили наличие вхДНК почти в половине случаев рака человека; частота варьировалась в зависимости от типа опухоли, при этом вхДНК практически не обнаруживалась в нормальных клетках. Математическое моделирование предсказало, что амплификация вхДНК будет увеличивать количество копий онкогена и внутриопухолевую гетерогенность более эффективно, чем амплификация хромосомной ДНК [6]. В другом исследовании было обнаружено, что несмотря на значительное структурное сходство, линии клеток рака легкого демонстрировали популяцию более длинных вхДНК, чем в нормальных тканях [1].
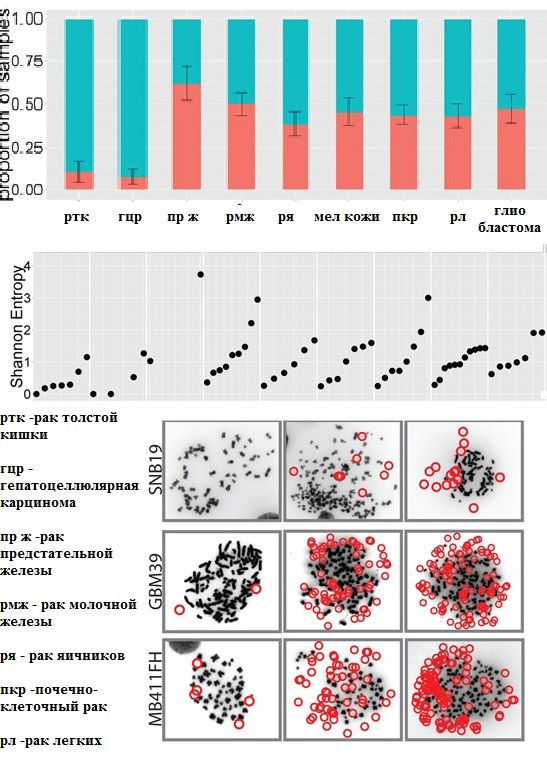
Рисунок 3 | ВхДНК в опухолях человека:
1 — распределение вхДНК в метафазе, стратифицированное по типу опухоли;
2 — доля опухолевых клеточных культур, положительных на вхДНК, с определением индекса разнообразия Шеннона (Shannon entropy);
3 — DAPI-окрашенные метафазы клеточных линий (DAPI, 4',6-диамидино-2-фенилиндол; флуоресцентный краситель для ДНК), обнаружено увеличение копий вхДНК при прогрессировании опухолевого роста [6].
Привлекательность вхДНК для экспериментов с жидкой биопсией связана также с их большей стабильностью, чем линейных ДНК. Кроме того, белки, участвующие в выделении вхДНК из генома, могут выступать в качестве мишеней терапии этой формы геномной пластичности (обусловленной амплификацией онкогенов и генов лекарственной устойчивости). Таким образом, циркулирующие внехромосомные ДНК представляют собой ранее неизученный пул нуклеиновых кислот, которые могут стать новым элементом опухолевого пазла, уже включающего определение микроРНК и линейной ДНК.
Источники:
1. Roos W. P., Thomas A. D., Kaina, B. DNA damage and the balance between survival and death in cancer biology. Nat. Rev. Cancer. 2016; 16: 20–33.
2. Paulsen T. et al. Discoveries of Extrachromosomal Circles of DNA in Normal and Tumor Cells.Trends in Genetics. 2018; Vol. 34, Issue 4: 270 – 8.
3. de Carvalho A.C. et al. Discordant inheritance of chromosomal and extrachromosomal DNA elements contributes to dynamic disease evolution in glioblastoma. Nature Geneticsvolume. 2018; 50:708–17.
4. Nathanson D. A. et al. Targeted therapy resistance mediated by dynamic regulation of extrachromosomal mutant EGFR DNA. Science (New York, N.Y.).2013; 343(6166): 72–6.
5. Kumar P. et al. Normal and Cancerous Tissues Release Extrachromosomal Circular DNA (eccDNA) into the Circulation. Mol Cancer Res.2017; 15 (9): 1197-1205.
6. Turner K.M., Deshpande V., Beyter D., et al. Extrachromosomal oncogene amplification drives tumour evolution and genetic heterogeneity. Nature. 2017;543(7643):122–125.
