Будущее постгеномной медицины: метаболомика

В эпоху Big Data (структурированные и неструктурированные данные огромных объемов и значительного многообразия) медицинские исследования характеризуются быстрым развитием, а также широким применением системной биологии, кроме того, они основываются на глобальном анализе биологических образцов с использованием аналитических подходов биоинформатики. Говоря о биологических системах, стоит определиться с терминологией.
Система — это абстрактная сущность, обладающая целостностью и определенная в своих границах [1]. Этот постулат утверждает основное свойство живых систем — их целостность, что указывает на необходимость комплексного анализа всех элементов с учетом их постоянного динамического взаимодействия. Это возможно в рамках транс-омиксных технологий (trans-omics), способных реконструировать биохимические сети через несколько «омических» слоев (геномики, транскриптомики, протеомики, метаболомики).
Набор метаболитов, синтезируемых биологической системой, составляет ее метаболом. Метаболическое фенотипирование, которое в настоящее время чаще всего называют «метаболомикой», определяется как «количественное измерение динамического мультипараметрического метаболического ответа живых систем на патофизиологические стимулы или генетическую модификацию» [2]. Этот подход впервые был предложен Джереми Николсоном в Имперском колледже Лондона в 1999 году.
Проводится комплексная оценка эндогенных метаболитов с последующим систематическим выявлением и количественным определением метаболитов из конкретного биологического образца. Метаболиты представляют собой разнообразную группу низкомолекулярных структур, включающую липиды, аминокислоты, пептиды, нуклеиновые кислоты, органические кислоты, витамины, тиолы и углеводы, что делает единовременный глобальный анализ сложной задачей. Из-за сложности метаболома и разнообразных свойств метаболитов ни одна аналитическая платформа не может быть применена для обнаружения всех метаболитов в биологическом образце. Только комбинированное использование современных инструментальных аналитических подходов позволило увеличить спектр изучаемых метаболитов.
Точная (прецизионная) медицина направлена на адаптирование методов лечения для каждого конкретного пациента, предполагает более эффективные лекарственные препараты с меньшим количеством нежелательных реакций. С этой целью за последние несколько лет были достигнуты значительные успехи в области фармакогеномики, ориентированные на генотипирование и выявление специфических генетических вариаций, связанных с лекарственной реакцией. Тем не менее клиническая фармакология, несомненно, выиграет от методов, способных дополнить эту геномную информацию [3]. Это необходимо потому, что в метаболизм лекарственного средства вовлечено множество разных ферментов, органов и систем организма (даже микробиом), кроме того, не всегда возможно провести скрининг на огромное количество генетических или гистологических вариантов. Поскольку метаболизм лекарственного средства варьируется в зависимости от этнической принадлежности, возраста, пола, веса, роста и особенностей диеты, а также других экологических и физиологических переменных, невозможно предсказать, как индивидуум отреагирует на лекарство на основании только его генотипа.
Тесная связь между метаболомом и генотипом индивида дает метаболомике возможность оценить взаимодействия генотип-генотип и генотип-среда.
Актуальность исследования метаболома несомненна и в онкологии. По мере прогрессирования злокачественного процесса возникают множественные дефекты в биохимических путях. Метаболические потребности раковых клеток отличаются от потребностей большинства нормальных дифференцированных клеток, при этом в опухолевой ткани также имеются различные метаболические фенотипы. Некоторые опухоли, по-видимому, «предпочитают» аэробный гликолиз (эффект Варбурга: повышенное усвоение глюкозы и ферментация глюкозы в лактат даже в присутствии полностью функционирующих митохондрий) [4]. Другие опухолевые клетки больше зависят от глютаминолиза (при хронических миелопролиферативных заболеваниях без филадельфийской хромосомы в JAK2 V617F- мутантных клетках наблюдался повышенный метаболизм глутамина) [5], от одноуглеродного метаболизма (холина или фолата) [6]. Некоторые опухоли могут использовать комбинацию двух или более из этих метаболических путей [7]. Использование метаболомики для выявления специфического метаболического подтипа конкретной опухоли позволит улучшить таргетированность первичной терапии или обосновать корректировку ее в динамике [8].
Метаболомические инструменты имеют широкий потенциал на этапах доклинической и клинической разработки фармакологических средств (рис. 1). Например, возможность субклассификации пациентов может способствовать повышению успешности выбора пациентов для включения в исследование. Метаболомические подходы позволяют выявить принципы формирования лекарственной устойчивости и факторы рецидивирования опухолей, определить новые перспективные мишени терапии, формируя постгеномный этап развития медицины.
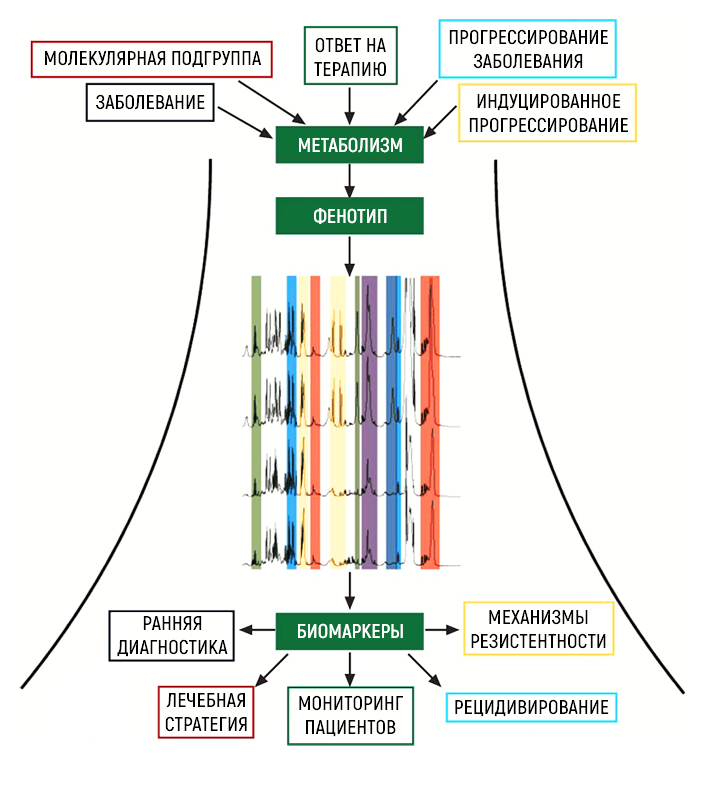
Рисунок 1 | Схема влияния различных патологических и фармакологических процессов на обмен веществ и возможности использования метаболитов как клинических биомаркеров в рамках прецизионной медицины.
Источники:
1. Большая советская энциклопедия: в 30 т. / гл. ред. А.М. Прохоров. — 3-е изд. — М.: Советская энциклопедия, 1969–1978.
2. Shikai Y., Dale G. N., YuDong Z., Weidong Z., Chapter 3 — Application of Systems Biology in the Research of TCM Formulae, Systems Biology and its Application in TCM Formulas Research,Academic Press; 2018; 31–67.
3. Puchades-Carrasco L., Pineda-Lucena A. Metabolomics Applications in Precision Medicine: An Oncological Perspective. Curr Top Med Chem. 2017 Sep;17(24):2740-2751.
4. Liberti M.V., Locasale J.W. The Warburg Effect: How Does it Benefit Cancer Cells? Trends Biochem Sci. 2016 Mar;41(3):211–218.
5. Zhan H., Ciano K., Dong K., Zucker S. Targeting glutamine metabolism in myeloproliferative neoplasms. Blood Cells Mol. Dis. 2015;55(3):241–247.
6. Lloyd S.M., Arnold J., Sreekumar A. Metabolomic profiling of hormone-dependent cancers: a bird’s eye view. Trends Endocrinol. Metab. 2015;26(9):477–485.
7. Levine A. J., Puzio-Kuter A. M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes. Science. 2010;330(6009):1340–1344.
8. Wishart D.S. Is cancer a genetic disease or a metabolic disease? Exp. Biol. Med. 2015;2(6):478–479.
