Терморецептор TRPV1 регулирует массу тела и артериальное давление в отсутствие белка термогенина

Несмотря на то, что ожирение является одной из основных причин артериальной гипертонии, молекулярная основа связи между этими патологиями еще не совсем ясна вследствие гетерогенности двух ключевых характеристик. В развитии избыточной массы тела и ожирения играют огромную роль такие факторы, как наследственность, образ жизни и особенности окружающей среды, а повышенная чувствительность к поваренной соли служит ключевой особенностью гипертонии при ожирении. У таких пациентов уровень артериального давления и окружность талии коррелируют с концентрацией альдостерона в плазме, гиперпродукцию которого связывают с гуморальными факторами, выделяемыми адипоцитами [1, 2]. Комплексность механизмов, лежащих в основе патогенеза, подчеркивается тем, что существуют также иные, независимые от альдостерона молекулярные пути развития сосудистой дисфункции и задержки ионов натрия в почках [3, 4].
Разобщающий белок 1 (UCP1), иначе называемый термогенин, регулирует несократительный термогенез и определяет общий расход энергии организмом [5]. UCP1 преимущественно присутствует на внутренней мембране митохондрий в бурой жировой ткани (БЖТ); этот белок обеспечивает повторный вход протонов из межмембранного пространства в матрикс митохондрии. UCP1 снижает протонный градиент, образующийся в ходе работы цепи переноса электронов, минуя АТФ-синтазу, что в конечном итоге приводит к выделению тепловой энергии [5]. С точки зрения физиологии, холодовые сигналы и активация симпатической нервной системы запускают β-адренергическую стимуляцию UPC1 в БЖТ, тем самым активируя термогенез. Данный процесс прерывается при генетической абляции гена Ucp1; этого оказывается достаточно для того, чтобы у мышей начался набор массы тела [6]. И наоборот, мыши, у которых наблюдается усиленная экспрессия гена Ucp1, оказываются устойчивы к развитию алиментарного ожирения (при этом мышей в эксперименте кормили пищей с высоким содержанием жиров) [7]. Кроме того, в нескольких клинических исследованиях сообщается о роли белка UCP1 в развитии ожирения и артериальной гипертензии у людей [8, 9]. Таким образом, это указывает на возможную связь между ожирением и гипертонией.
TRPV1 (англ. Transient receptor potential vanilloid — ваниллоидный канал переменного рецепторного потенциала) — это катионный канал, активируемый капсаицином (активным веществом в перце чили) и тепловыми раздражителями (температурой > 43 °C); канал был описан в 1997 году [10]. За это открытие ученые в 2021 году были удостоены Нобелевской премии по физиологии и медицине. Сейчас известно, что TRPV1 активируется и такими патологическими раздражителями, как кислоты и токсины. Помимо ноцицепции в сенсорном звене нервной системы, он регулирует ряд физиологических процессов, таких как терморегуляция, активность симпатической нервной системы и реакции сердечно-сосудистой системы [11]. Сенсорные нейроны, в которых экспрессируется TRPV1, иннервируют жировую ткань; TRPV1 присутствует и в адипоцитах. Согласно результатам клинических исследований, TRPV1 может изменять уровень потребления энергии в БЖТ [12]. Тем не менее, роль TRPV1 в развитии ожирения и сердечно-сосудистых заболеваний остается спорной.
В этом выпуске Hypertens Res представлена работа Ли с соавт., в ходе которой ученые вывели генетическую линию мышей с нокаутами генов TRPV1 и UCP1 (Trpv1–/–/Ucp1–/–) и подробно проанализировали фенотип животных (рис. 1) [13]. У мышей дикого типа при делеции гена Trpv1 не изменялись ни масса тела, ни артериальное давление. Однако авторы обнаружили, что у мышей группы Ucp1–/– нокаут гена Trpv1 усугубляет течение ожирения и артериальной гипертензии. У мышей с нокаутами генов Trpv1–/–/Ucp1–/– наблюдалось снижение потребления кислорода и теплопродукции, что сопровождалось повышением содержания липидов в жировой ткани и увеличением жировых отложений в области живота. Митохондриальная дисфункция в БЖТ мышей Trpv1–/–/Ucp1–/– предположительно связана со снижением содержания ключевых белков, участвующих в дифференцировке адипоцитов БЖТ и процессе липолиза, измененный процесс окислительного фосфорилирования и нарушение Ca2+-сигнализации в выделенных митохондриях БЖТ. Также авторы показали, что в этих процессах участвует трансмембранный белок LETM1 — канал-антипортер Ca2+/H+, крайне важный для гомеостаза митохондрий [14]; они обнаружили, что содержание LETM1 и UCP1 оказалось выше у мышей Trpv1–/–, чем у мышей дикого типа, тогда как у мышей Trpv1–/–/Ucp1–/– содержание LETM1 оказалось ниже, чем у мышей Ucp1–/–. Эксперименты по генетическому нокауту показали, что повышенная экспрессия LETM1 выполняет компенсаторную функцию в БЖТ мышей Trpv1–/–, а у мышей с двойным генетическим нокаутом эта функция оказалась нарушена. Митохондриальная дисфункция у мышей Trpv1–/–/Ucp1–/– усиливала окислительный стресс и локальную экспрессию минералокортикоидного рецептора (МКР) в БЖТ, а также приводила к увеличению концентрации альдостерона и снижению биодоступности NO в системном кровотоке (рис. 1). Вероятно, эти изменения объясняют возникновение артериальной гипертензии у мышей с Trpv1–/–/Ucp1–/–.
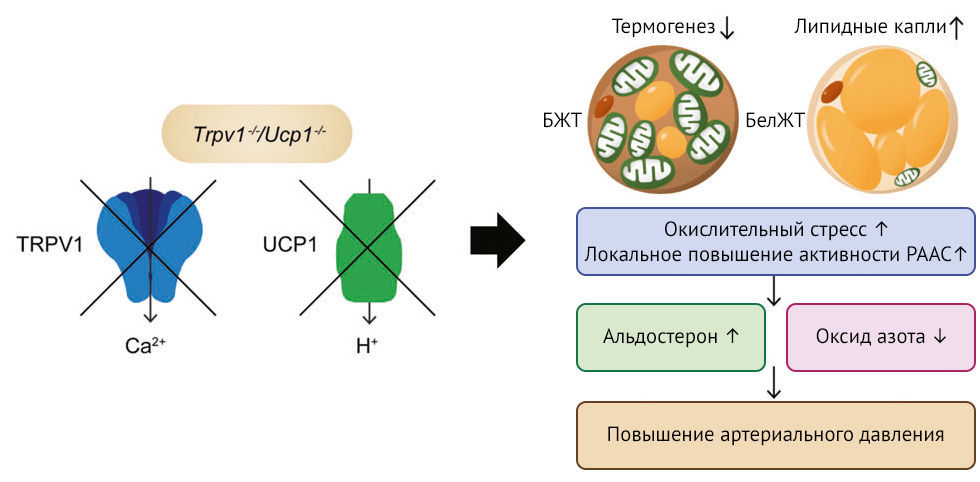
TRPV1 — белок TRPV1 ( ваниллоидный канал переменного рецепторного потенциала)
UCP1 — разобщающий белок 1
БЖТ — бурая жировая ткань
БелЖТ — белая жировая ткань
РААС — ренин-ангиотензин-альдостероновая система
Работа Ли с соавт. предоставляет новые сведения о патогенезе гипертонии, связанной с ожирением, и поднимает некоторые провокационные вопросы [13]. Из настоящего исследования неясно, связаны ли проявления артериального давления, наблюдаемые у мышей с Trpv1–/–/Ucp1–/–, исключительно с изменениями в жировой ткани или с молекулярными сигнальными путями в других тканях, таких как кровеносные сосуды различной локализации, надпочечники, нервная система и почки. Действительно, в предыдущих исследованиях было показано, что модуляция TRPV1-сигнального пути изменяет активность симпатической иннервации, влияет на вазоконстрикцию и экскрецию натрия с мочой [15, 16, 17]. В будущем важно продолжить изучение этих аспектов. Кроме того, в работе показано, что у мышей с Trpv1–/–/Ucp1–/– количество МКР в жировых тканях, а также уровень альдостерона в системном кровотоке оказались значительно увеличены. В связи с этим открытием в недавних исследованиях эффектов финеренона было выявлено, что этот нестероидный антагонист МКР улучшал метаболические показатели у мышей, содержавшихся на высокожировой диете; эффект был опосредован индукцией UCP1 и рецепторов, активируемых пролифераторами пероксисом и гамма-коактиватором 1-α (PGC-1α) в БЖТ [18]. Следует отметить, что было высказано предположение, согласно которому стероидные и нестероидные антагонисты МКР могут различаться по характеру их распределения в тканях и способам связывания с рецептором [19], что может выражаться в различных клинических эффектах. В ходе экспериментальных исследований были получены свидетельства в поддержку этого: термогенные маркеры в БЖТ по-разному реагировали у мышей, которым давали финеренон и спиронолактон соответственно (обе группы мышей содержались на высокожировой диете) [20]. Учитывая это, важно изучить, как существующие ныне антагонисты MКР изменяют течение патологий, наблюдаемых у мышей Trpv1–/–/Ucp1–/–.
В ходе исследований удалось продемонстрировать, что у пациентов с сахарным диабетом и артериальной гипертензией, получающих ингибиторы натрий-глюкозного котранспортера 2 (ингибиторы SGLT2; например, эмпаглифлозин), выявляется клинически значимое снижение артериального давления. В особенности, это касается пациентов с солечувствительной гипертензией [21, 22]. Кроме того, в ходе экспериментальных исследований обнаружилось, что ингибиторы SGLT2 могут снижать солечувствительность [артериального давления] [23]. Учитывая полученные ранее сведения, согласно которым ингибиторы SGLT2 способствуют липолизу в жировых тканях и приобретению последними признаков БЖТ [24], важно изучить, может ли ингибирование [ингибиторов] SGLT2 замедлять процесс трансформации адипоцитов и местную активацию ренин-ангиотензин-альдостероновой системы (РААС) в этой модели.
Таким образом, исследование Ли с соавт. показало, что делеция катионного канала TRPV1 у мышей, у которых отсутствует UCP1, нарушает функцию митохондрий в БЖТ, что приводит к увеличению массы тела. Этот эффект сопровождается локальной активацией РААС, повышением концентрации альдостерона и артериальной гипертензией. Все это предоставляет новую информацию о связи между ожирением, уровнем альдостерона и высоким кровяным давлением, для дальнейшего изучения которой необходимы будущие исследования.
