Пироптоз: молекулярные основы и роль в онкогенезе

Пироптоз — один из вариантов программируемой клеточной гибели (ПКГ), основным отличием которого является обязательный воспалительный компонент. ПКГ — собирательное название для различных вариантов клеточной гибели, куда, помимо пироптоза, относят апоптоз, аутофагию, онкоз и т.д. (всего их больше десятка). Пироптоз известен с конца ХХ столетия (описан А. Зихлински в 1992 году) и активно изучается в основном в связи с инфекционными заболеваниями.
Однако не так давно оказалось, что помимо своего противоинфекционного влияния, пироптоз также может участвовать и в онкогенезе, причем участие это совсем не однозначно. Но обо всем по порядку.
При апоптозе воспалительные процессы активно ингибируются. Пироптоз же ведет себя в этом отношении прямо противоположным образом: воспаление является едва ли не центральным его компонентом. Благодаря этой своей особенности такая клеточная гибель и получила свое название [1].
Ключевую роль в пироптозе играет каспаза-1 (которая не участвует в апоптозе). В вышеупомянутой работе был описан следующий механизм на примере инфицирования Salmonella и Shigella. Под их влиянием в макрофагах происходит активация каспазы-1. Каспаза превращает предшественники цитокинов IL-1β и IL-18 в их активные формы, и все это оканчивается гибелью самого макрофага. Впоследствии было обнаружено, что пироптоз может быть инициирован и другими бактериями (Francisella, Legionella), и неинфекционными факторами [2].
Механизмы пироптоза
Как уже было отмечено, ключевые медиаторы пироптоза отличаются от апоптотических. В последнем случае основная роль принадлежит каспазам 3, 6 и 8. В случае пироптоза эти ферменты остаются незадействованными, и главным медиатором является каспаза-1. Также при пироптозе не происходит нарушение целостности мембраны митохондрий и высвобождение цитохрома С [2].
Имеются отличия и в поражении ДНК клетки. В случае апоптоза ДНКазы расщепляют участки ДНК между нуклеосомами. При пироптозе вместо этого происходит активация каспазо-1-зависимой нуклеазы (выделить и изучить ее пока что не удалось), что приводит к конденсации хроматина. В отличие от апоптоза, целостность ядра при этом сохраняется (рис. 1).
.
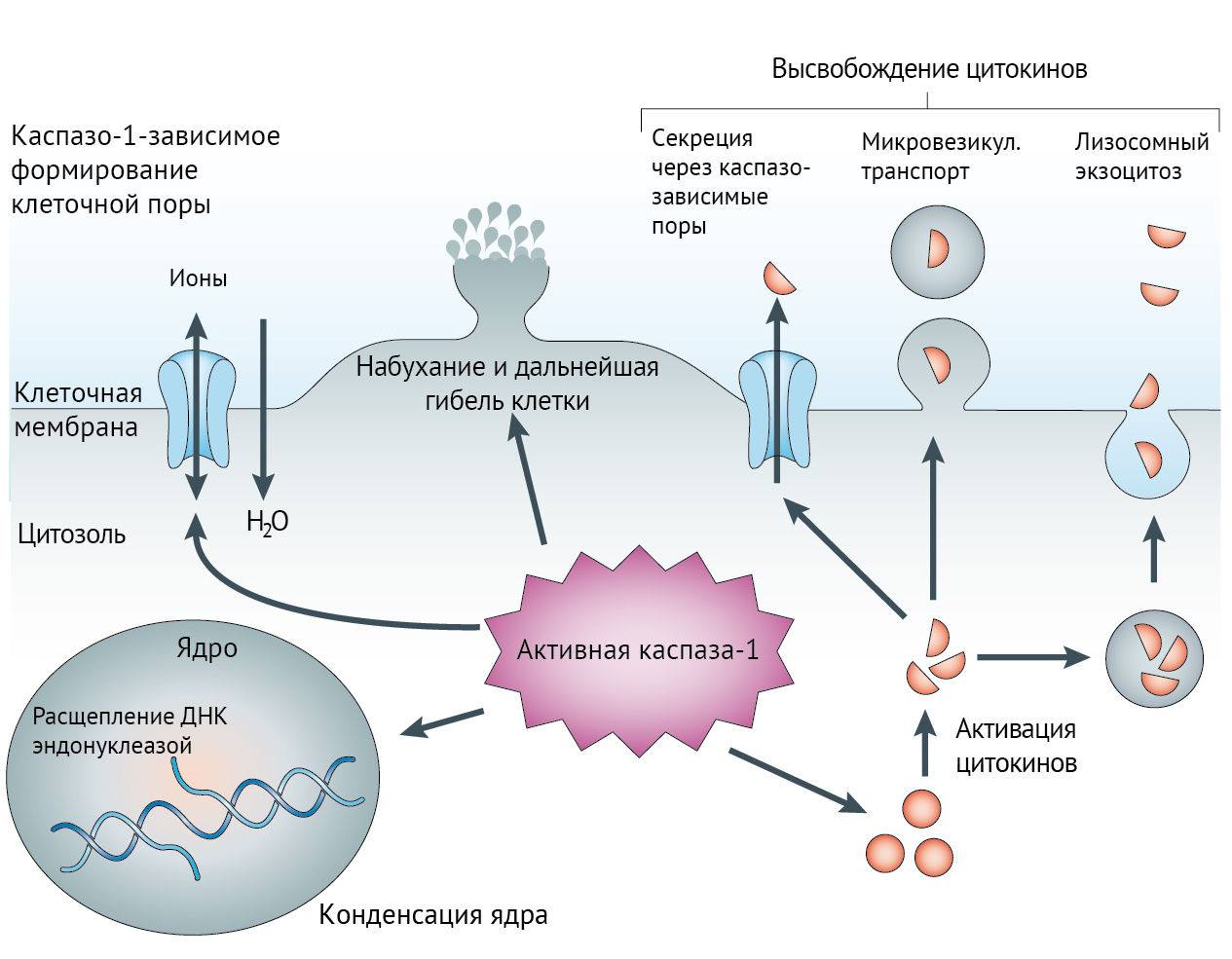
Инициация пироптоза происходит с помощью Toll- и Nod-подобных рецепторов (TLR и NRL; первые трансмембранные, вторые внутриклеточные). TLR в ответ на разнообразные PAMP или DAMP (pathogen- and damage-associated molecular patterns) активирует каскадный механизм, приводящий к синтезу провоспалительных цитокинов (IL-1, -6, TNF). NLR воспринимает цитозольные паттерны — нуклеиновые кислоты вирусов, АТФ, мочевину, токсины, силикаты и т.д. Активация NLR приводит к двум важным следствиям: формированию инфламмасомы и активации собственно каспазы-1.
Существует и еще один класс рецепторов, инициирующих апоптоз — AIM2-подобные (ALR). Активация этих рецепторов также приводит к образованию инфламмасомы. Лигандом для него часто является гасдермин-D (см. ниже) [3].
Конечным результатом пироптоза является нарушение целостности клеточной мембраны и выход провоспалительных субстанций в плазму крови [2]. Также следует заметить, что распознавание паттернов и образование инфламмасом носит специфичный характер (особенно это выражено при различных инфекциях). При сибирской язве, токсоплазмозе, листериозе и т.п. будут активированы специфичные сигнальные пути [3].
Каспаза-1
Активация данного фермента приводит к целому ряду разнообразных следствий, и не все они напрямую связаны с клеточной смертью.
Одно из таких следствий — активация цитокинов IL-1β и IL-18 из неактивных предшественников. IL-1β («потенциальный эндогенный пироген», который, предположительно, ответственен за лихорадку) способствует миграции лейкоцитов в ткань, повышает экспрессию других цитокинов и хемокинов. IL-18 увеличивает секрецию интерферона-γ и активирует лейкоциты (преимущественно T-клетки и макрофаги).
Также при активации каспазы-1 формируются т.н. «каспазо-1-зависимые поры» — неселективные каналы в мембране, через которые во внеклеточное пространство или плазму крови выходит внутриклеточное содержимое с множеством провоспалительных молекул. Вместе с этим происходит дисбаланс ионов вне и внутри клетки, через поры заходит вода и клетка погибает. Вероятнее всего, это происходит под влиянием гасдермина-D [2, 3].
Пироптоз может быть инициирован и «неклассическим» путем — посредством работы каспаз -4, -5, -11. Известно, что активация данных каспаз приводит к пироптозу под влиянием липополисахарида грамотрицательных бактерий. Они также способны воздействовать на гасдермин-D и формировать поры в мембране [3].
Гасдермин-D
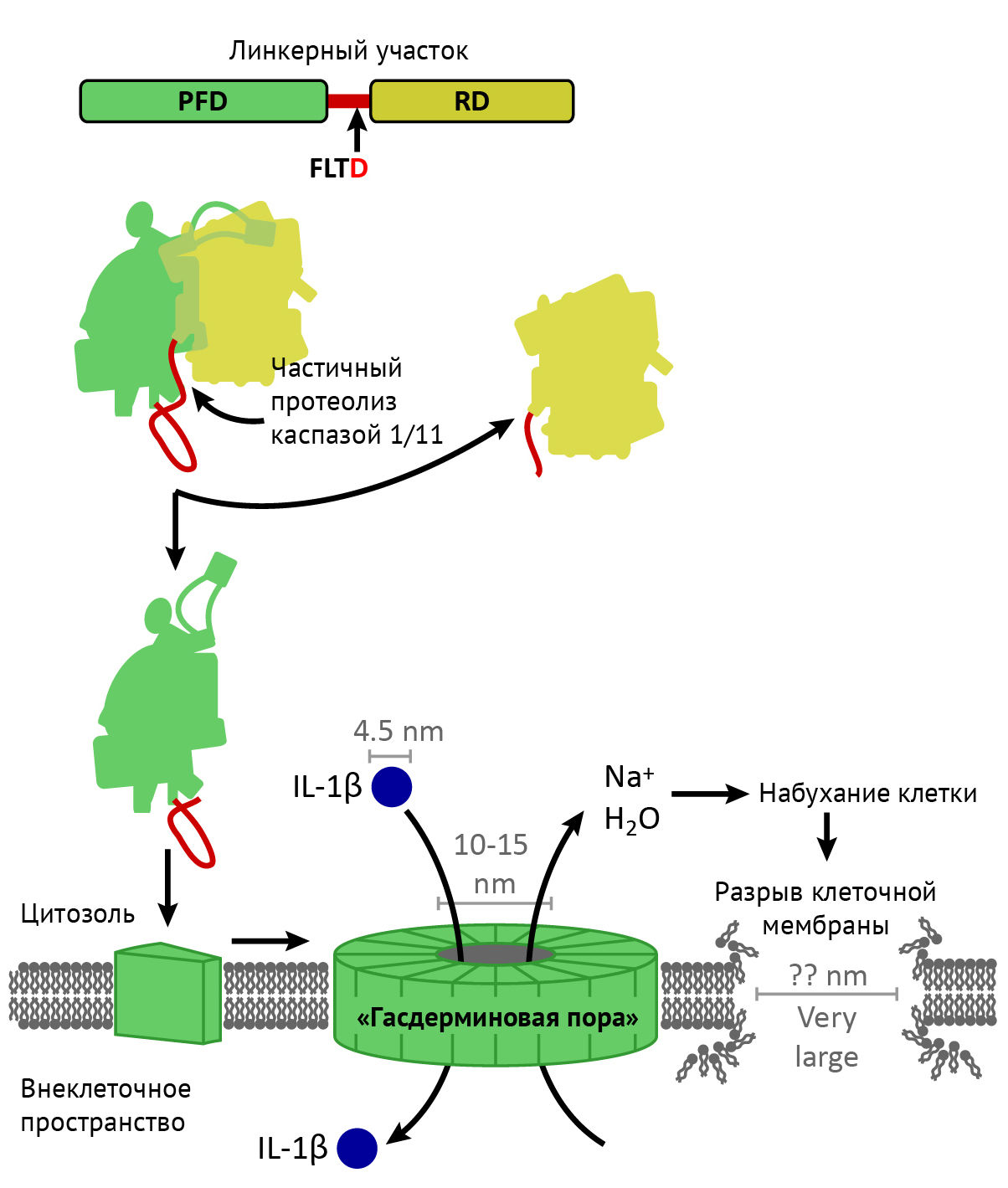
Помимо каспазы, был обнаружен и другой важный медиатор пироптоза — гасдермин-D (GSDMD). Хотя точнее было бы назвать его основным эффектором этого варианта клеточной гибели. Данный белок в норме находится в ингибированном виде, но каспаза-1 приводит его в активное состояние. После частичного протеолиза N-концевая часть GSDMD (NT-GSDMD) приобретает литическую активность и перфорирует клеточную мембрану [3].
Происходит это следующим образом: NT-GSDMD приближается к внутренней поверхности мембраны и связывается с рядом молекул — фосфатидилинозитол-фосфатом, фосфатидилсерином, кардиолипином. Несколько таких NT-GSDMD способны «встраиваться» в мембрану, превратившись в олигомер, формируя таким образом подобие трансмембранного канала (рис. 1). Предположительно, для образования одного такого канала требуется 16 мономеров GSDMD. Вода тут же проходит сквозь канал, клетка набухает, и формируются крупные разрывы в клеточной мембране [4], [5].
.
Помимо гасдермина D существуют и другие белки этого же семейства. Один из них также интересен в рамках нашей темы — GSDME/DFNA5, кодируемый одноименным геном (или просто гасдермин-Е). Данный ген отвечает за развитие наследственной несиндромальной глухоты. Однако белок GSDME в тканеспецифичной форме обнаруживается в эпителии кожи и ЖКТ. Еще более интересно, что данный белок рассматривается как предполагаемый супрессор онкогенеза [6]. Правда, как это работает, пока что не совсем ясно.
Роль пироптоза в онкогенезе и метастазировании
На онкогенез влияет множество различных процессов: микроокружение, иммунная система, активность про- и антионкогенов, оксидативный стресс. Немаловажным также является воспаление (больше данных о роли хронического воспаления). Помимо очевидной роли инфекционных агентов в качестве канцерогенов (а иногда и этиологических факторов конкретных заболеваний), хроническое воспаление и само по себе может способствовать развитию опухолей.
Одна из гипотез это объясняет следующим образом: при длительном и частом повреждении клеток повышается их пролиферативная активность, равно как и активность иммунокомпетентных клеток (ИКК). Последние вырабатывают большое количество активных форм кислорода (АФК) и азота, которые являются мутагенами. И если в пролиферирующей клетке возникнет мутация, то это вполне может привести к развитию злокачественного новообразования [7]. А поскольку пироптоз невозможен без его воспалительного компонента, можно сделать предположение о существовании связи между ним и онкогенезом. И такая связь относительно недавно нашлась.
В процессе пироптоза резко увеличивается уровень IL-1 и -18, которые могут способствовать развитию опухолей самыми разными способами. К примеру, провоспалительные цитокины способствуют ангиогенезу, а в случае длительного воспаления в сочетании с мутантными клетками — способны привести к неоваскуляризации опухоли и ее быстрому росту [7].
Но влияние пироптоза на процесс онкогенеза достаточно неоднозначен. Это подтверждают опыты на мышах с нокаутом генов, отвечающих за NLR и/или каспазы-1. В клетках таких животных не образуется инфламмасом, не происходит пироптоз и, как оказалось, они более восприимчивы к искусственно вызванному колит-ассоциированному раку толстого кишечника [3].
В ходе дальнейших исследований были изучены особенности связи пироптоза и различных онкологических заболеваний. Среди них:
1. Гепатоцеллюлярная карцинома (ГЦК). Было обнаружено, что в опухолевых клетках резко снижен уровень NLRP3 — одного из NLR рецепторов, ответственных за образование инфламмасомы. Также оказалось, что 17β-эстрадиол, который обладает противоопухолевым эффектом, действует именно через NLRP3, запуская пироптоз [3]. Помимо этого, в клетках опухоли практически отсутствовала каспаза-1 [8]. Таким образом, активность сигнальных путей пироптоза находится в обратной зависимости от прогрессии ГЦК;
2. Рак молочных желез. В этом случае повышенная экспрессия GSDMD — белка-эффектора пироптоза — ассоциирована с более низкой выживаемостью и более активным процессом метастазирования [3];
3. Колоректальный рак. Уже было сказано, что у мышей с дефектом каспазы-1 или NLR проще вызывать данный вид опухоли. При исследовании ткани таких опухолей, полученных от пациентов, было обнаружено снижение уровня AIM2. С другой стороны, в нормальных клетках толстого кишечника нет GSDMD — в отличие от опухолевых [3];
4. Меланома. В нормальном покровном эпителии также не определяется GSDMD, зато в злокачественных клетках наблюдается его повышенная экспрессия. Вероятно, это может способствовать инвазии и метастазированию опухолевых клеток. Здесь также играет роль фермент eEF-2K (эукариотический фактор элонгации 2 киназа), ингибирующий синтез белка в клетке. В случае меланомы, eEF-2K способствует аутофагии и пироптозу опухолевых клеток, а также повышает чувствительность меланомы к доксорубицину[3]. Также имеются данные, что в опухолевых клетках снижается концентрация GSMDE, что способствует развитию резистентности меланомы к этопозиду [6];
5. Рак легких. В случае немелкоклеточных вариантов этого заболевания наблюдается повышенная экспрессия GSDMD, что связано с инвазией опухоли, увеличением ее размеров и скорости метастазирования. В клетках с нокаутом гена GSDMD, напротив, наблюдалось снижение роста опухоли. К слову, в отсутствие GSDMD активация каспазы-1 вызывает не пироптоз, а апоптоз. С другой стороны, GSDMD может способствовать деятельности цитотоксических Т-лимфоцитов и элиминации опухолевых клеток при аденокарциноме и плоскоклеточном ороговевающем раке легких [3];
6. Рак желудка. В опухолевой ткани этого вида рака было обнаружено снижение экспрессии упомянутого GSDME/DFNA5. Предположительно, белок GSDMЕ активирует каспазо-3-зависимый сигнальный путь, следствием которого обычно является апоптоз. Но с помощью химиотерапевтических лекарственных средств возможно осуществить «переход» от апоптоза к пироптозу. Это может быть крайне важно при лечении рака желудка, в особенности, если наблюдается стойкое ингибирование про-апоптотических ферментов и медиаторов. В этом случае пироптоз является альтернативным способом уничтожения опухолевых клеток [3, 6].
Если постараться обобщить вышесказанное, мы обнаружим, что в определенных случаях механизмы пироптоза могут как способствовать, так и препятствовать развитию опухоли. И конечно, исследователи не могли не задуматься — а как это использовать в клинической практике?
Даже в условиях дефицита данных о механизмах пироптоза, обнаруживаются исследования, авторы которых сообщают о возможности инициирования пироптоза в опухолевых клетках.
Например, препарат симвастатин — гиполипидемическое средство — может обладать и противоопухолевым эффектом. В одном из исследований [9] было изучено, как симвастатин будет влиять на немелкоклеточные формы рака легких (для этого использовалось несколько клеточных линий). В результате оказалось, что препарат увеличивает концентрацию NLRP3, IL-1β, IL-18 и способствует активации каспазы-1.
В другом исследовании [10] было выявлено, что противоопухолевое средство сорафениб также способно вызывать пирокинез в клетках гепатоцеллюлярной карциномы. Помимо других механизмов, с помощью которых достигается противоопухолевый эффект, препарат стимулирует активность каспазы-1 и способствует таким образом пирокинетическому варианту гибели клеток.
Существуют и другие подобные публикации, изучающие возможность активации пирокинеза в опухолевых клетках. Но хотя перспективность таких исследований не вызывает сомнений, без грамотных клинических исследований пока что сложно говорить о новом классе противоопухолевых препаратов.
Источники:
1. S. L. Fink and B. T. Cookson, ‘Apoptosis, Pyroptosis, and Necrosis: Mechanistic Description of Dead and Dying Eucaryotic Cells’, Infect. Immun., vol. 73, no. 4, pp. 1907–1916, 2005.
2. T. Bergsbaken, S. L. Fink, and B. T. Cookson, ‘Pyroptosis: Host cell death and inflammation’, Nat. Rev. Microbiol., vol. 7, no. 2, pp. 99–109, 2009.
3. X. Xia et al., ‘The role of pyroptosis in cancer: pro-cancer or pro-“host”?’, Cell Death Dis., vol. 10, no. 9, 2019.
4. S. B. Kovacs and E. A. Miao, ‘Gasdermins: Effectors of Pyroptosis’, Trends Cell Biol., vol. 27, no. 9, pp. 673–684, 2017.
5. X. Liu et al., ‘Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores’, Nature, vol. 535, no. 7610, pp. 153–158, 2016.
6. Y. Wang, B. Yin, D. Li, G. Wang, X. Han, and X. Sun, ‘GSDME mediates caspase-3-dependent pyroptosis in gastric cancer’, Biochem. Biophys. Res. Commun., vol. 495, no. 1, pp. 1418–1425, 2018.
7. L. M. Coussens and Z. Werb, ‘Inflammation and cancer’, Nature, vol. 420, no. December, 2002.
8. Q. Chu et al., ‘Pyroptosis is involved in the pathogenesis of human hepatocellular carcinoma’, Oncotarget, vol. 7, no. 51, pp. 84658–84665, 2016.
9. F. Wang et al., ‘Simvastatin suppresses proliferation and migration in non-small cell lung cancer via pyroptosis’, Int. J. Biol. Sci., vol. 14, no. 4, pp. 406–417, 2018.
10. C. Hage et al., ‘Sorafenib Induces Pyroptosis in Macrophages and Triggers Natural Killer Cell–Mediated Cytotoxicity Against Hepatocellular Carcinoma’, Hepatology, 2019.
