Дендритные клетки

Дендритные клетки (ДК), названные так из-за их «древовидной», имеющей отростки (дендриты), формы, являются антигенпрепрезентирующими клетками (АПК) иммунной системы, то есть обрабатывают антигенный материал и представляют его на своей поверхности для Т-клеток иммунной системы. Они служат связующим звеном между врожденной и приобретенной иммунными системами.
Пауль Лангерганс впервые описал ДК, найденные в человеческой коже в 1868 году, но ошибочно принял их за нервные клетки. Ральф Штейнман и Занвил Кон открыли ДК в 1973 году, но идея о том, что ДК имеют уникальную роль в иммунной системе, десятки лет воспринималась скептически. В XXI веке стало понятно, как именно ДК инициируют приобретенные иммунные ответы. Сейчас все более очевидным становится их вклад в индукцию толерантности к аутоантигенам. Изучаются связи и сигнальные пути ДК с другими иммунными клетками, их роль в развитии различных патологий, разрабатываются лекарства и вакцины против некоторых патогенов, опухолей и аутоиммунных заболеваний. В знак признания важности открытия дендритных клеток Ральф Штайнман был удостоен нескольких престижных премий, в том числе международной премии Фонда Гарднера в 2003 году, премии Альберта Ласкера в 2007 году и Нобелевской премии по физиологии и медицине в 2011 году.
ДК — это образующиеся в костном мозге лейкоциты, которые являются наиболее эффективным типом антигенпредставляющих клеток. ДК также могут быть получены in vitro из костного мозга и крови с использованием различных комбинаций факторов роста, таких как гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и Flt3-лиганд. ДК специализированы для захвата и обработки антигенов, превращения белков в пептиды и их представления на основных комплексах гистосовместимости (MHC-II), распознаваемых Т-клетками. Они являются гетерогенной, т. е. разнородной по происхождению и составу, группой клеток, включающей в себя миелоидную (или классическую, открытую Штайнманом) и плазмоцитоидную субпопуляции. Отдельно в классической субпопуляции выделяют ДК лимфоидной и нелимфоидной ткани, а также те самые клетки Лангерганса кожи. Хотя все ДК способны поглощать, обрабатывать и представлять антигены наивным Т-клеткам, вышеперечисленные подвиды имеют свои четкие фенотипические маркеры и различаются по местоположению, миграционным путям, специфическим иммунологическим функциям, а также по наличию зависимости их образования от инфекций или воспалительных стимулов.
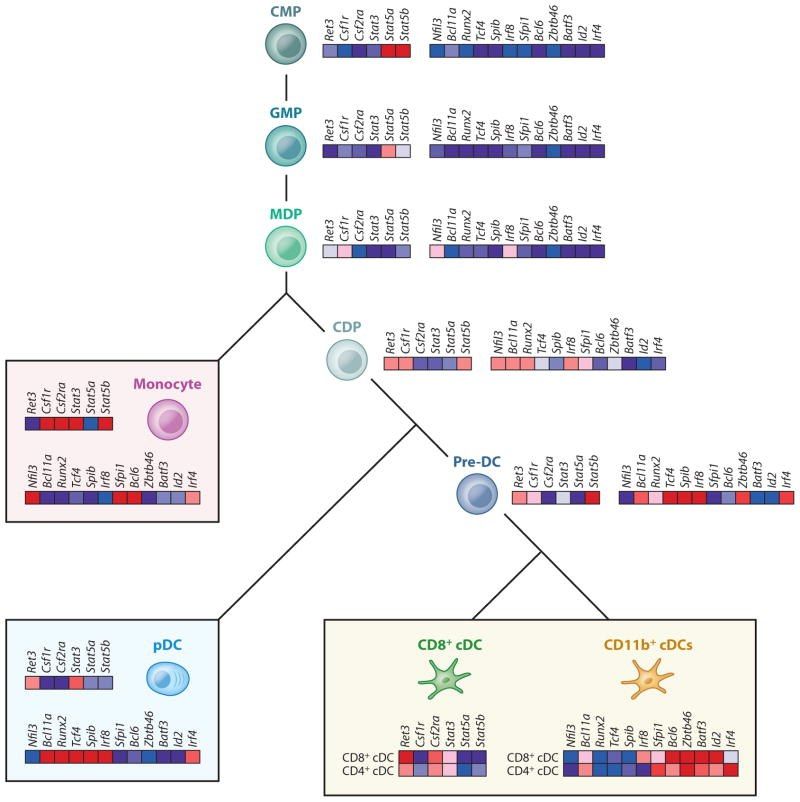
Рисунок 1 | Транскрипционный контроль дифференциации ДК. На иллюстрации изображена тепловая карта цитокинов, TLR и некоторых факторов транскрипции, которые экспрессируются в миелоидной линии, начиная от обычных миелоидных предшественников (CMP) до предшественников гранулоцитов макрофагов (GMP), предшественников макрофагов ДК (MDP), общих предшественников ДК (CDPs), циркулирующих кДК-предшественников (pre-cDCs), моноцитов, плазмоцитоидных ДК (pDCs) и клеток лимфоидной ткани CD8+ и CD11b+ ДК.
Плазмоцитоидные ДК (пДК) представляют собой небольшую субпопуляцию, происхождение которой сходно с классической, но их жизненный цикл протекает иначе. Они накапливаются преимущественно в крови и лимфоидных тканях и попадают в лимфатические узлы через кровоток, экспрессируют низкие уровни MHC-II, костимулирующих молекул и интегрина CD11c в неактивном состоянии, а также узкий диапазон паттерн-распознающих рецепторов (PRR), которые включают в себя Toll-подобные рецепторы (TLR) 7 и 9. При распознавании чужеродных нуклеиновых кислот пДК продуцируют интерфероны типа I и приобретают способность представлять чужеродные антигены.
Классические ДК (кДК) являются субпопуляцией тканевых гемопоэтических клеток, которые заполняют большинство лимфоидных и нелимфоидных тканей. Они более тонко ощущают тканевые повреждения, захватывая связанные с окружающей средой и чужеродными клетками антигены, обрабатывая и представляя их Т-лимфоцитам. Благодаря этому кДК индуцируют иммунитет к любым чужеродным антигенам, нарушающим целостность тканей, и обеспечивают толерантность к аутоантигенам. Они отлично подходят для выполнения этих функций из-за нескольких ключевых особенностей:
- они локализованы практически в любой нелимфоидной ткани и в маргинальной зоне селезенки, где они постоянно контактируют с антигенами;
- вырабатывают ферменты для обработки и представления антигенов;
- в ответ на взаимодействие с некоторыми хемокинами, такими как CCL19 и CCL21, они «проползают» через клетки тканей, пересекают эндотелий лимфатических сосудов и начинают перемещаться в лимфоузлы. Активированные ДК не захватывают новые антигены, синтезируют костимулирующие молекулы, такие как CD80, CD86 и C-C-рецептор хемокина 7 типа, а также провоспалительные цитокины TNF-α и IL-12;
- в лимфоузлах ДК мигрируют в Т-зону, где и вызывают ответ CD4 и CD8 T-лимфоцитов, при этом одна ДК вызывает ответ нескольких Т-клеток.
Дендритные клетки присутствуют в тканях, контактирующих с внешней средой — например, в коже (где имеется специализированный тип дендритных клеток — клетки Лангерганса), слизистых оболочках дыхательных путей, легких, желудка и кишечника. Также они могут быть обнаружены в незрелом состоянии в крови и соединительной ткани. Зрелые/активные формы ДК мигрируют в лимфоузлы.
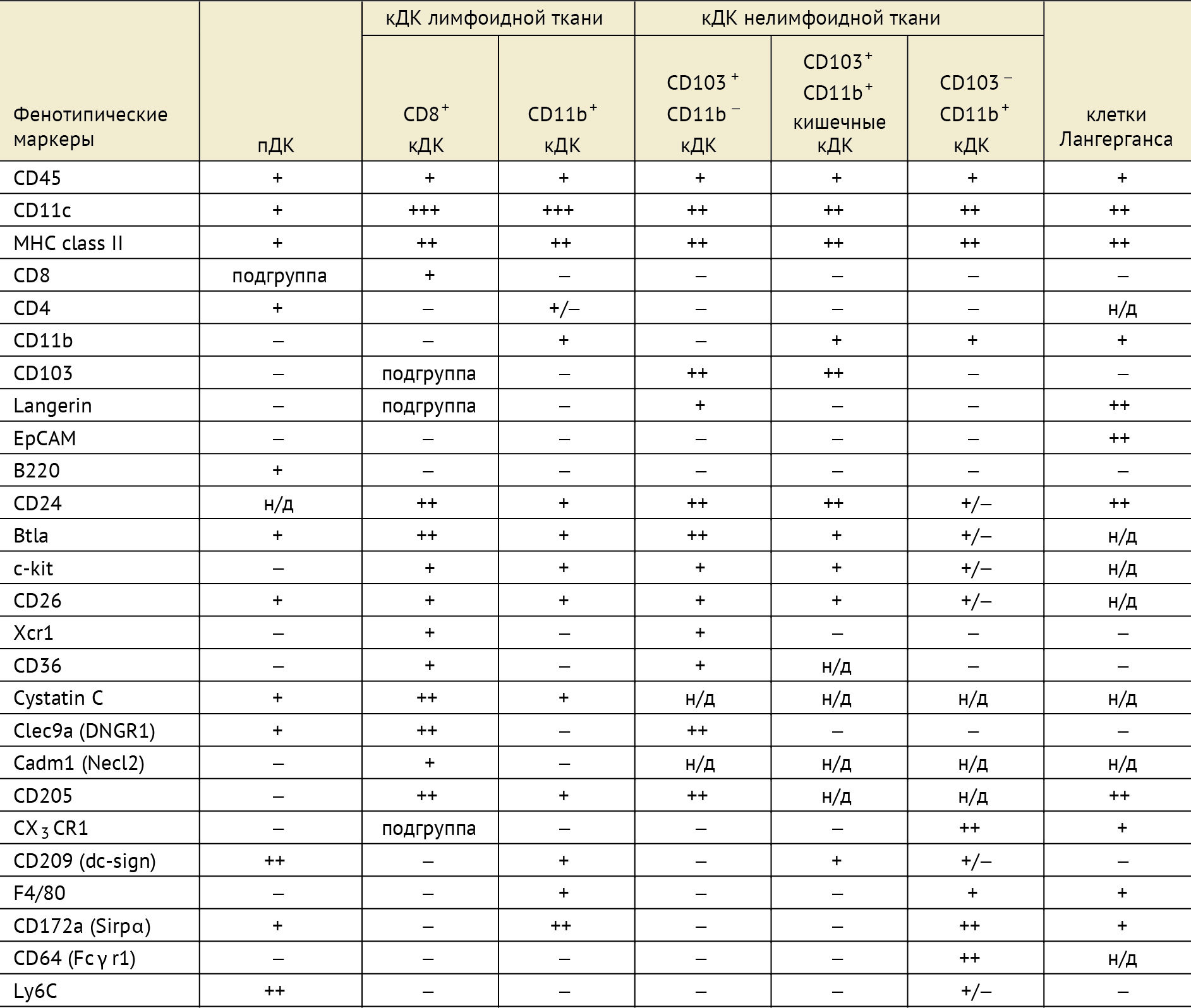
Таблица 1 | Фенотипы мышиных кДК лимфоидной и нелимфоидной тканей.
Дефицит дендритных клеток у человека
У людей описано три генетических синдрома дефицита ДК. Первый — синдром дефицита DCML, вызван мутацией GATA-связывающего фактора 2 (GATA2), ведущей к полному отсутствию ДК, циркулирующих моноцитов, B- и NK-лимфоцитов, но не влияющей на гранулоциты и тромбоциты. Этот синдром также связан с отсутствием лимфоидных предшественников и уменьшением предшественников гранулоцит-макрофагов (GMP), что указывает на то, что дефицит GATA2 предотвращает дифференциацию этих предшественников в ДК. У пациентов с DCML значительно (примерно в 100 раз) был повышен уровень сывороточного FLT3L без признаков миелопролиферации.
Второй синдром связан с мутациями регуляторного фактора интерферона 8 (IRF8), который участвует в дифференциации общего миелоидного предшественника в ДК и моноциты. У одного пациента с ноль-мутацией IRF8 наблюдалось увеличенное количество гранулоцитов, полное отсутствие циркулирующих моноцитов, пДК, кДК и дермальных ДК, а также недостаточная продукция IL-12. Интересно, что эпидермальные клетки Лангерганса у этого пациента присутствовали в нормальном количестве, из чего можно сделать предположение, что эпидермальные клетки Лангерганса и кДК имеют различное происхождение. Другой вид мутации IRF8, наблюдаемой у двух пациентов, приводил к уменьшению количества CD1c+ кДК в крови и дефектам в продукции IL-12, но нарушения образования гранулоцитов, моноцитов или пДК не происходило.
Третий синдром связан с мутацией аденилаткиназы 2-фосфотрансферазы, необходимой для нуклеотидного гомеостаза. Эта мутация вызывает особую форму тяжелого комбинированного иммунодефицита, известную как ретикулярный дисгенез. Синдром характеризуется нарушением образования всех зародышевых клеток крови, включая нейтрофилы, лимфоциты, моноциты, кДК и клетки Лангерганса.
Иммунотерапия
Использование иммунорегуляторных возможностей дендритных клеток имеет большие перспективы в лечении онкозаболеваний, аутоиммунных заболеваний и профилактики отторжения трансплантата. Манипуляции с ДК могут превратить их в наиболее эффективный адъювант для усиления иммунной защиты хозяина. Было показано, что злокачественные новообразования подавляют ДК, выделяя противовоспалительные цитокины, такие как IL-10, чем обусловливают образование супрессивных Т-клеток. Для того, чтобы подорвать эти механизмы, можно создать нацеленные на опухолевые антигены ДК ex vivo и ввести их пациенту для повышения иммунитета к опухолевым клеткам. Дендритные клеточные вакцины, создаваемые таким образом, безопасны, имеют минимум побочных эффектов и в целом выглядят как выполнимый, перспективный и эффективный метод лечения.
Источники:
- Merad M. et al. The dendritic cell lineage: ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting //Annual review of immunology. – 2013. – Т. 31. – С. 563-604.
- Ali Roghanian. Dendritic Cells. Ali Roghanian, University of Southampton Faculty of Medicine, UK
- Luckashenak N., Eisenlohr L. C. Dendritic cells: Antigen processing and presentation //Cancer immunotherapy. – Academic Press, 2013. – С. 55-70.
