«Цветочный код» клеточного отбора

Обнаружение и устранение чужеродных или поврежденных клеток организма возможно как в рамках активности адаптивной иммунной системы, так и вне ее. Например, при селекции клеток у Drosophila используется механизм отбора клеток, связанный с характерным паттерном на поверхности клеточной мембраны. На молекулярном уровне эти «отпечатки пальцев» состоят из комбинаций мембранных белков семейства FLOWER (FWE) [1].
«Цветочный код», в соответствии с которым определяется относительная профпригодность клеток, позволяет наиболее приспособленным клеткам распознавать, устранять и заменять наименее благоприятные для эволюции клеточные популяции [2].
Белки, которые указывают на снижение приспособленности, называются FWELose; они экспрессируются на клетках, «приговоренных» к ликвидации. Однако само присутствие изоформ FWELose на клеточной мембране не всегда приводит к элиминации этих клеток. Если окружающие клетки имеют сходный профиль экспрессии, то клетка не будет уничтожена. Для приведения приговора в действие нужны «палачи» — клетки с молекулярным профилем, представленным иной формой FWЕ белка — FWEWin [3]. При этом варианты Lose и Win — это не обозначение конкретной структуры, какого-либо подтипа белка, а описательное наименование состояния в конкретной ситуации межклеточного взаимодействия.
В недавнем исследовании сходные механизмы были обнаружены и у людей. Мадан Е. с коллегами выяснили, что альтернативный сплайсинг обеспечивает четыре версии человеческого белка FWE: FWE1, FWE2, FWE3 и FWE4. Используя клетки рака молочной железы человека, выращенные in vitro, ученые изучили, ведут ли себя какие-либо из этих версий FWE как формы белка-победителя или белка-проигравшего. Они сообщили, что когда клетки человека, экспрессирующие FWE1 либо FWE3 (FWE1+/FWE3+), культивируют с клетками, экспрессирующими FWE2 либо FWE4 (FWE2+/FWE4+), то первая популяция клеток погибает, а популяция FWE2+/FWE4+ пролиферирует, чтобы компенсировать потерю общей клеточной массы. Таким образом, в этой системе клетки FWE1+/FWE3+ являются клетками-неудачниками, а клетки, FWE2+/FWE4+, соответственно, клетками-победителями. Клетки-неудачники подвергаются апоптозу, который инициируется путем прямого контакта между клетками-победителями и проигравшими.
Затем та же группа ученых исследовала экспрессию версий FWE в образцах ткани опухолевой патологии человека. Экспрессия FWEWin была выше в злокачественных опухолях, чем в доброкачественных. Также обнаружено, что экспрессия FWELose в нормальных клетках, расположенных ближе к опухоли — выше, чем на расстоянии от нее. Более того, уровень FWELose был выше в нормальных тканях, прилегающих к злокачественным опухолям, чем в нормальных тканях, окружающих доброкачественную опухоль.
При трансплантации раковых клеток молочной железы человека с экспрессией FWEWin мышиные клетки, которые оказывались расположены рядом с трансплантированными опухолевыми клетками, увеличивали свою экспрессию FWELose по сравнению с организмами, которые не получали трансплантат опухоли. Все выше описанные результаты свидетельствуют о том, что экспрессия FWEWin в опухолевых клетках индуцирует экспрессию FWELose в соседних нормальных клетках (рис. 1). Механизм, ответственный за данную индукцию, неизвестен.
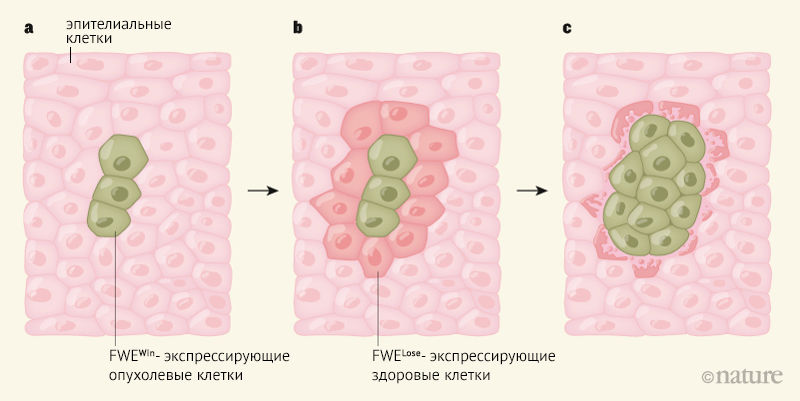
а — опухолевые клетки экспрессируют FWEWin;
b — это приводит к экспрессии FWELose в соседних здоровых клетках;
c — конкуренция между клетками, экспрессирующими FWEWin или FWELose, приводит к гибели FWELose-экспрессирующих клеток, а FWEWin-экспрессирующие клетки делятся, чтобы заполнить утраченный объем ткани [4].
Опухолевые клетки, экспрессирующие FWEWin, генерировали более агрессивные опухоли, чем FWELose-позитивные опухолевые клетки [4].
При этом FWEWin-позитивные клетки пролиферируют в присутствии Lose-экспрессирующих клеток стромы, что дает конкурентное преимущество роста данному пулу раковых клеток. Ингибирование экспрессии FWE белков уменьшает рост опухоли и ее метастазирование, а также индуцирует чувствительность к химиотерапии [5]. В связи с этим «цветочные» белки могут стать перспективным игроком таргетной терапии в онкологии.
Список литературы:
- Maruyama T., Fujita Y. Cell competition in mammals - novel homeostatic machinery for embryonic development and cancer prevention. Curr Opin Cell Biol.2017;48:106-112.
- Kon S. Physiological and pathological relevance of cell competition in fly to mammals. Dev Growth Differ. 2018;60(1):14-20.
- Baker N. E. Mechanisms of cell competition emerging from Drosophila studies.Curr Opin Cell Biol. 2017;48:40-46.
- Madan E. et al. Flower isoforms promote competitive growth in cancer. Nature. 2019 Jul.[Epub ahead of print]
- Gogna R., Shee K. , Moreno E. Cell Competition During Growth and Regeneration.Annu Rev Genet. 2015;49:697-718.
