Уютная ниша в «железном» мире
В данном исследовании Ubellacker с соавт. показывают, что лимфогенный путь является более эффективным способом метастазирования опухоли по сравнению с гематогенным за счет более благоприятной окислительно-восстановительной среды, при которой распространяющиеся раковые клетки получают дополнительную защиту от ферроптоза путем встраивания мононасыщенных жирных кислот в свои липидные бислои [1].
Gemütlichkeit — немецкое слово без точного перевода на другие языки, используемое для описания состояния пребывания в «расслабленности и уюте». Обычно это относится к особенной атмосфере, например, когда человек отдыхает в компании друзей, наслаждаясь напитками, в приятном месте вроде сада. Похоже, что распространяющиеся раковые клетки, долго и одиноко путешествующие по внутренним средам организма для формирования отдаленных метастазов, предпочитают перемещаться по лимфатическим сосудам, которые оказываются довольно приятной и «уютной» средой для них, а не по кровотоку (рис. 1). Чтобы избежать тяжелых и потенциально проферроптотических условий, мигрирующие раковые клетки не только выбирают лимфу в качестве основного транспортного пути, но и изменяют состав своей мембраны: в данной ситуации это служит внутриклеточным механизмом защиты гомеостаза опухолевой клетки от ферроптоза.
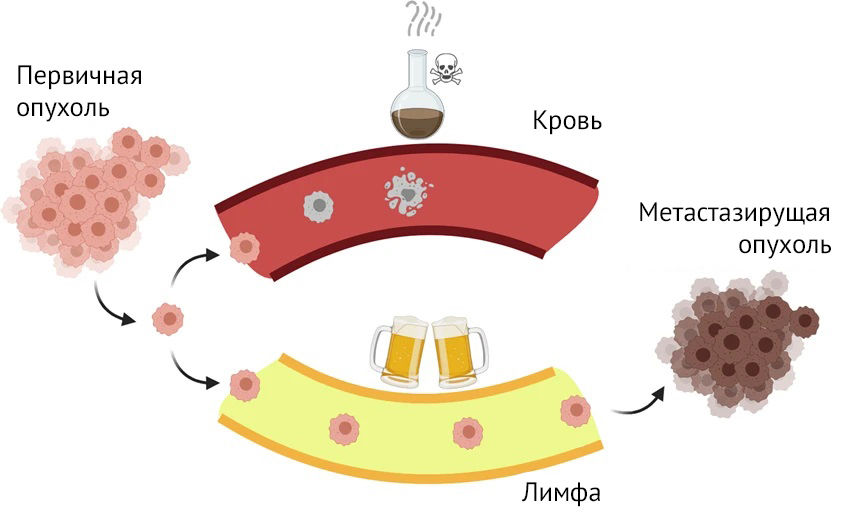
Рисунок 1 | Благоприятная восстановительная среда способствует более активному лимфогенному метастазированию опухолей по сравнению с гематогенным
Ферроптоз — это метаболическая форма клеточной гибели, характеризующаяся железозависимым перекисным окислением мембранных полиненасыщенных жирных ацилфосфолипидов. Глутатионпероксидаза 4 (GPX4) — основной супрессор ферроптоза, катализирующий глутатионзависимое (GSH) восстановление гидроперекисей липидов до соответствующих им спиртов. Благодаря активности этого фермента предотвращается накопление гидроперекисей фосфолипидов. Хотя этот фермент очень важен для оптимального функционирования нормальных клеток, появляется все больше доказательств существования серьезной зависимости роста и выживаемости раковых клеток от GPX4 [2]. Например, неоднократно было показано, что устойчивые к терапии раковые клетки и клетки, находящиеся в мезенхимальном (низкодифференцированном) состоянии, становятся зависимыми от активности GPX4 и других ферментов, участвующих в метаболизме полиненасыщенных жирных кислот [3]. Эта зафиксированная исследователями зависимость от пути, который защищает от смертельно опасного перекисного окисления липидов, превращает резистентное к терапии высокомезенхимальное состояние в особенно чувствительное к ферроптозу, открывая таким образом новые возможности для терапевтического вмешательства.
Можно предположить, что повышенный ферроптоз теоретически может служить объяснением низкой выживаемости раковых клеток, метастазирующих по кровяному руслу. Доказательства, подтверждающие связь процессов ферроптоза и опухолевого метастазирования, были представлены в исследовании Ubellacker с соавт. [1], в котором авторы сосредоточились на сравнении гематогенного и лимфогенного путей распространения клеток меланомы. С этой целью исследователи вводили мышам клетки меланомы, полученные от пациентов или мышей, и обнаружили, что клетки меланомы гораздо лучше формируют метастазы при введении их в лимфоузлы, чем при внутривенных инъекциях. Дальнейшие эксперименты, в которых клетки меланомы вводили подкожно, показали, что раковые клетки были более многочисленны в лимфоузлах, дренирующих опухоль, чем в соответствующих кровеносных сосудах. Это свидетельствует о более высокой приспособленности и лучшей выживаемости раковых клеток в лимфе, чем в крови. Эта явная разница в выживаемости циркулирующих метастазирующих клеток была связана с повышенным содержанием активных форм кислорода и более низким соотношением восстановленного и окисленного GSH в опухолевых клетках, распространяющихся по крови, что указывает на повышенный внутриклеточный окислительный стресс. Это может быть следствием существования угрожающей для опухолевых клеток окислительной среды в крови, характеризующейся более высокой концентрацией свободного железа и более низкой концентрацией восстановленного GSH. Интересно, что в клетках, которые спонтанно метастазировали гематогенным путем, выявлено повышенное образование перекиси липидов. Чтобы установить, действительно ли ферроптоз способствует нарушению метастазирования, клетки меланомы были обработаны ингибитором ферроптоза липрокстатином 1 (мощным антиоксидантом, улавливающим свободные радикалы). Если после трансплантации в лимфоузлы клеток, обработанных липрокстатином 1, степень тяжести метастазирования не изменялась, то после внутривенного введения этих клеток наблюдалось значительное усиление метастазирования. Это свидетельствует о том, что ферроптоз сдерживает метастазирование опухоли по кровеносной системе. Подтверждением этому послужили эксперименты с использованием клеток меланомы мыши, генетически запрограммированных на отсутствие экспрессии гена Gpx4. При целенаправленном нокауте гена Gpx4 снижалась доля мышей с образовавшимися метастатическими опухолями после внутривенного введения клеток меланомы с отсутствием гена Gpx4. После введения таких клеток внутрь лимфоузла подобный эффект не достигался. Эти результаты ясно показывают, что раковые клетки подвержены ферроптозу и становятся зависимыми от активности GPX4 во время гематогенного метастазирования.
Для выявления дополнительных внутриклеточных механизмов, которые могли бы влиять на защиту раковых клеток от ферроптоза в лимфе, авторы провели метаболомический и липидомический анализы метастазирующих клеток меланомы. В результате было обнаружено, что извлеченные из лимфы клетки обогащены олеиновой кислотой (мононенасыщенной жирной кислотой, которая известна как важный фактор для придания клетке надежной антиферроптотической активности) [4]. Это коррелирует с выводом о том, что уровни липидов, содержащих олеиновую кислоту, были выше в лимфе, где эта кислота в подавляющем большинстве присутствует в триацилглицеролах внутри везикул Аполипопротеина В. Следовательно, предварительная обработка клеток меланомы олеиновой кислотой усиливает метастазирование опухоли после внутривенного введения [1]. Далее было показано, что встраивание олеиновой кислоты в клеточные мембраны невозможно без отдельной лигазы жирных кислот — члена семьи длинноцепочечных ацетил-CoA-синтетаз [3]. В качестве окончательного доказательства своей концепции авторы рассмотрели вопрос о том, дает ли лимфатическая среда какие-либо преимущества раковым клеткам для последующего формирования и распространения отдаленных метастазов по кровеносному руслу. С этой целью раковые клетки, полученные из метастазов лимфатических узлов, вводили внутривенно. В итоге процесс метастазирования шел более ускоренными темпами по сравнению с контролем, когда клетки вводили внутривенно из подкожной опухоли. Кроме того, эти клетки, как правило, более устойчивы к воздействию индуктора ферроптоза эрастина in vitro. Интересно, что клетки, изъятые из лимфоузла и пересаженные под кожу для временного роста, полностью лишались способности эффективно гематогенно метастазировать, что предполагает возникновение у них обратимого механизма активации лимфоассоциированного антиферроптотического фенотипа.
Таким образом, результаты этого увлекательного исследования убедительно подтверждают концепцию того, что лимфа является более «комфортной» и благоприятной средой для распространения раковых клеток. После пребывания в лимфе клетки становятся более агрессивными при последующем гематогенном метастазировании. Это исследование может иметь отдаленное применение, например, на цистин/глютаматный антипортер, известный как система Xc- (гетеродимерный аминокислотный переносчик, поставляющий в клетку цистеин — компонент глутатиона), который считается ведущим участником системы ферроптоза. Помимо своей функции по доставке цистеина к клеткам, было обнаружено, что система Xc- также управляет окислительно-восстановительным циклом цистин/цистеин, крайне важным для создания среды, насыщенной протонами водорода, которая может быть благоприятной для соседних клеток. В этом контексте недавнее исследование показало, что генетический нокаут специфичной для системы Xc- субъединицы xCT в клетках меланомы B16F10 почти полностью прекращал метастазирование опухоли. Это позволяло резко увеличить выживаемость мышей с опухолью [5]. Таким образом, результаты, представленные в этом и более ранних исследованиях, служат подтверждением того, что фармакологическое прицельное воздействие на xCT, возможно, является одной из наиболее перспективных стратегий борьбы с опухолевой диссеминацией.
