Современные разработки в области рака желудка: от молекулярного профилирования до стратегий лечения

Аннотация
Рак желудка и рак пищеводно-желудочного перехода представляют собой глобальную проблему здравоохранения. Несмотря на эффективность улучшенной химиотерапии и вариантов хирургии, прогноз у этих пациентов по-прежнему плохой. На поздних стадиях заболевания только трастузумаб и некоторые ингибиторы иммунных контрольных точек, такие как ниволумаб и пембролизумаб, в дополнение к химиотерапии продемонстрировали стабильную и надежную эффективность у пациентов с HER2- и PDL1-положительными опухолями, соответственно. В этом обзоре обсуждаются внутренние характеристики рака желудка и пищеводно-желудочного перехода с молекулярной и клинической точек зрения и предоставляется всесторонний обзор ранее опубликованных и продолжающихся клинических испытаний II и III фазы с таргетными агентами и иммунотерапией в запущенных и локализованных случаях. Наконец, авторы предлагают альтернативные стратегии, которые помогут преодолеть текущие проблемы в прецизионной медицине и улучшить результаты для этих пациентов.
Основные положения
- Особенности пространственной и временной гетерогенности опухолей желудка и пищеводно-желудочного перехода поставили под угрозу успех II и III фаз большинства клинических испытаний таргетной терапии.
- Текущие биомаркеры для принятия решения о лечении у пациентов с раком желудка и пищеводно-желудочного перехода включают тестирование на гиперэкспрессию и амплификацию HER2, комбинированную положительную экспрессию PDL1 и высокий статус микросателлитной нестабильности.
- Было показано, что химиотерапевтические препараты с пониженной токсичностью вместе с некоторыми таргетными методами лечения на молекулярном уровне особенно ценны для стратегий последовательного лечения для оптимизации выживаемости пациентов с раком желудка и пищеводно-желудочного перехода.
- Национальные стратегии с массовым молекулярным скринингом пациентов с раком желудка и пищеводно-желудочного перехода стали многообещающими подходами для выявления тех пациентов, которым может помочь таргетная терапия.
Введение
Рак желудка представляет собой глобальную проблему здравоохранения. По оценкам, в 2020 году было зарегистрировано 1 089 103 новых случая рака желудка и 768 793 случая смерти, что делает его пятым по распространенности злокачественным новообразованием и четвертой по значимости причиной смерти от онкологических заболеваний в мире [1].
Распространенность рака желудка варьирует в зависимости от биологического пола и географического региона, при этом у мужчин заболеваемость в два раза выше, чем у женщин, и частота заболевания выше в Восточной Азии и Восточной Европе. Несмотря на то, что рак желудка часто рассматривается как одно уникальное заболевание, его можно классифицировать на основе двух анатомических подвидов; он включает в себя различные гистологические образования [2] и молекулярные подтипы [3, 4]. Эти различия объясняются отличиями канцерогенеза и отчасти вторичны по отношению к различным факторам риска и индивидуальным особенностям. К факторам риска, связанным с некардиальным раком желудка (то есть раком нижнего отдела желудка), в основном включают хроническую инфекцию Helicobacter pylori, употребление алкоголя, курение табака и диету с высоким содержанием натрия, копченостей и консервов. Рак кардиального отдела (то есть верхней части желудка) может иметь двойную этиологию: некоторые виды рака связаны с инфекцией H. pylori, а другие связаны с избыточной массой тела и желудочно-пищеводным рефлюксом. Два последних фактора также ответственны за рак пищеводно-желудочного перехода (РПЖП) и дистальную аденокарциному пищевода [5], которые связаны с аналогичными молекулярными подтипами кардиального рака желудка [6].
Снижение заболеваемости некардиальным раком желудка, наблюдаемое в большинстве стран за последние несколько десятилетий, вероятно, вторично по отношению к снижению распространенности H. pylori и улучшениям в хранении и консервировании пищевых продуктов. Тем не менее, как это ни парадоксально, заболеваемость кардиальным раком желудка, РПЖП и аденокарциномой дистального отдела пищевода несколько увеличивается, в основном в развитых странах, что неразрывно связано с изменением образа жизни. Наконец, частота некардиального рака желудка увеличивается среди молодых людей (младше 50 лет), особенно на территориях с низкой заболеваемостью. Эти опухоли известны как рак желудка с ранним началом; считается, что они связаны с растущей распространенностью аутоиммунного гастрита и дисбиозом микробиома желудка, что, возможно, связано с увеличением частоты применения антибиотиков и кислотоподавляющих средств [1]. Что касается генетических факторов, около 10% глобальных случаев связаны с семейным накоплением, тогда как ~1–3% ассоциированы с наследственной генетической предрасположенностью [7].
Пациенты с распространенным раком желудка и РПЖП (РЖ–РПЖП) имеют плохой прогноз с относительной пятилетней выживаемостью 6% [8]. Агрессивность этого заболевания следует рассматривать вместе с вытекающей из этого слабостью здоровья соответствующей популяции пациентов. Средний возраст начала рака желудка составляет ~ 65 лет, что влечет за собой сопутствующие заболевания. У пациентов с раком желудка наблюдается незначительное количество симптомов, таких как дисфагия или диспепсия, в зависимости от локализации опухоли, рвота и тупая боль, вторичная по отношению к первичным или метастатическим очагам [7]. Наконец, с раком желудка часто связаны анемия и недоедание [7]. Дополнительные линии терапии коррелируют с лучшей выживаемостью [9–11], хотя число пациентов, получающих последующую терапию, прогрессивно снижается [10–12]. Всегда следует учитывать ожидания, сопутствующие заболевания, функции органов и функциональное состояние каждого пациента и принимать соответствующие меры.
Глубокое понимание внутренних характеристик каждой опухоли необходимо для реализации потенциала прецизионной медицины в онкологии и повышения выживаемости пациентов. В этом обзоре обсуждаются текущие представления о молекулярных основах канцерогенеза рака желудка, сообщается обновленная информация о разрабатываемых терапевтических стратегиях и указываются будущие направления в терапевтических подходах.
Молекулярные особенности рака желудка
Молекулярную характеристику рака желудка впервые описали Deng с соавт. [13] и Dulak с соавт. [14] в статьях, опубликованных в различных журналах. Они также обнаружили, что около 40% этих опухолей содержат амплификацию генов, кодирующих рецепторные тирозинкиназные белки (RTK, такие как EGFR, ERBB2 [также известный как HER2], ERBB3, FGFR2, JAK2 и MET), KRAS или NRAS, медиаторы клеточного цикла и VEGFA. Важно отметить, что, благодаря знаниям о том, что на эти молекулярные характеристики каким-то образом можно воздействовать, большинство клинических испытаний фазы II и III рака желудка, проведенных в течение следующего десятилетия, включали методы лечения, нацеленные на эти молекулярные аберрации.
В 2014 г. в рамках программы «Атлас опухолевого генома» (The Cancer Genome Atlas [TCGA]) [3] был проведен неконтролируемый кластерный анализ данных образцов опухолей, полученных от 295 пациентов с раком желудка из разных регионов мира с использованием шести молекулярных платформ; анализ выявил четыре подтипа рака желудка: с вирусом Эпштейна–Барр (EBV), с микросателлитной нестабильностью (МSI), с хромосомной нестабильностью (CIN) и геномно стабильный рак (таблица 1). Сходным образом, Азиатская группа по исследованию рака (ACRG) [4] провела подобный анализ 300 образцов из Южной Кореи и пришла к аналогичным выводам. Однако, несмотря на молекулярную классификацию рака желудка, эти идеи еще не воплотились в клинической практике.
Таблица 1 | Основные характеристики молекулярных подтипов рака желудка по TCGA
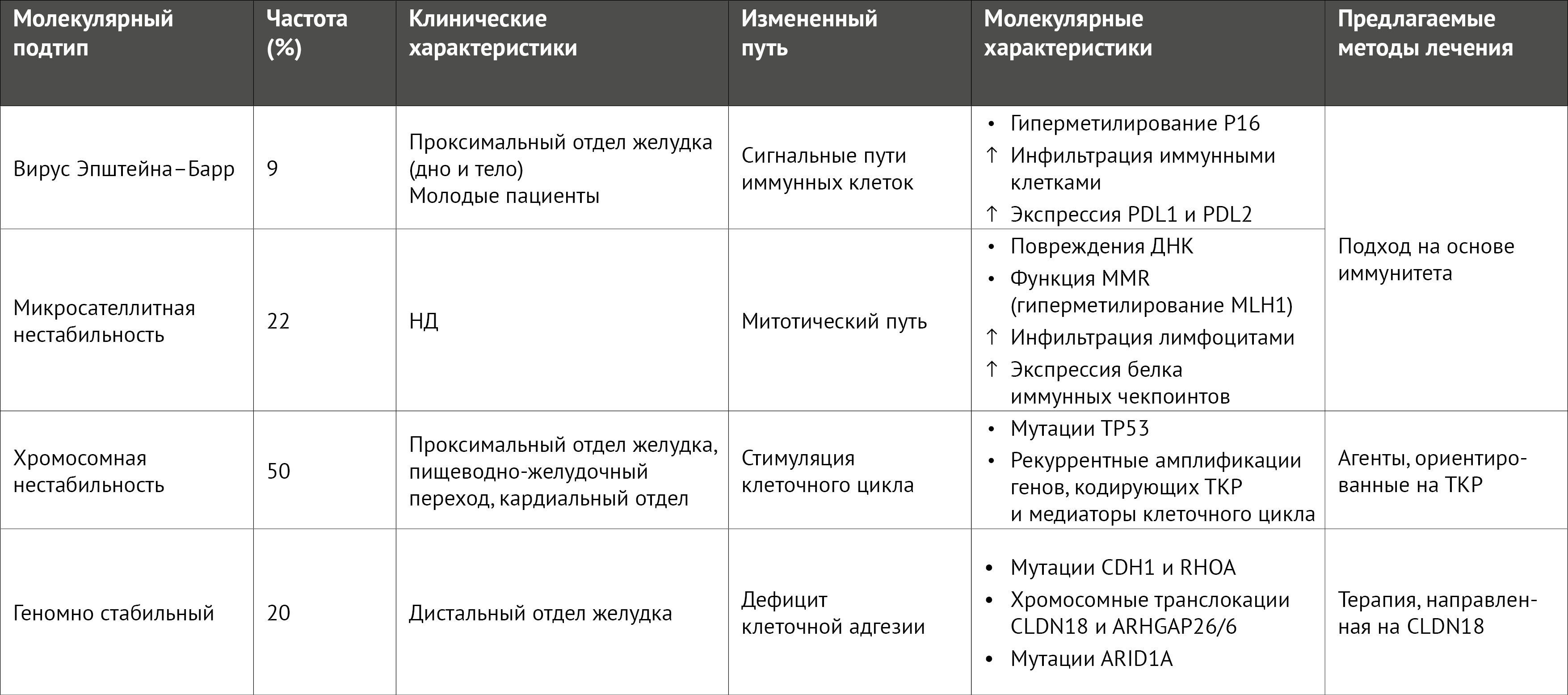
Сопоставляя молекулярные подтипы с прогнозом, можно отметить, что у пациентов с резектабельными опухолями желудка подтипов MSI и EBV, по-видимому, после операции течение заболевания благоприятнее, чем у пациентов с другими подтипами опухолей; у пациентов с геномно стабильными опухолями желудка худшие результаты с точки зрения безрецидивной выживаемости, а пациенты с подтипом CIN больше всего выигрывают от адъювантной химиотерапии [15]. В условиях метастазирования пациенты с опухолями MSI-high (MSI-H) хорошо реагируют на лечение ингибиторами иммунных контрольных точек (ICI) [16].
Впоследствии, в 2017 году, элегантная работа исследовательской сети TCGA показала постепенный молекулярный переход от средне-нижней аденокарциномы пищевода к аденокарциноме дистального отдела желудка [6]. Аденокарцинома пищевода и РПЖП обнаруживает сходство с вариантом CIN аденокарциномы желудка, хоть и не идентична ей. Действительно, РПЖП, по-видимому, представляет собой комбинированное заболевание с чертами аденокарциномы пищевода и рака кардиального отдела желудка с различными молекулярными характеристиками; например, частота опухолей с амплификацией и гиперэкспрессией HER2 постепенно снижается от тех, которые развиваются в пищеводе, к тем, которые формируются в желудке [17]. Предположение, что РПЖП и рак желудка можно рассматривать как одно и то же заболевание, соответствует историческому и широко применяемому подходу к отбору пациентов с любым типом опухоли без дифференциации для включения в клинические испытания фазы II и III. Таким образом, чтобы облегчить дальнейшее чтение этого обзора, авторы далее называют эти виды рака единым понятием «рак желудка» и упоминают их отдельно только при необходимости.
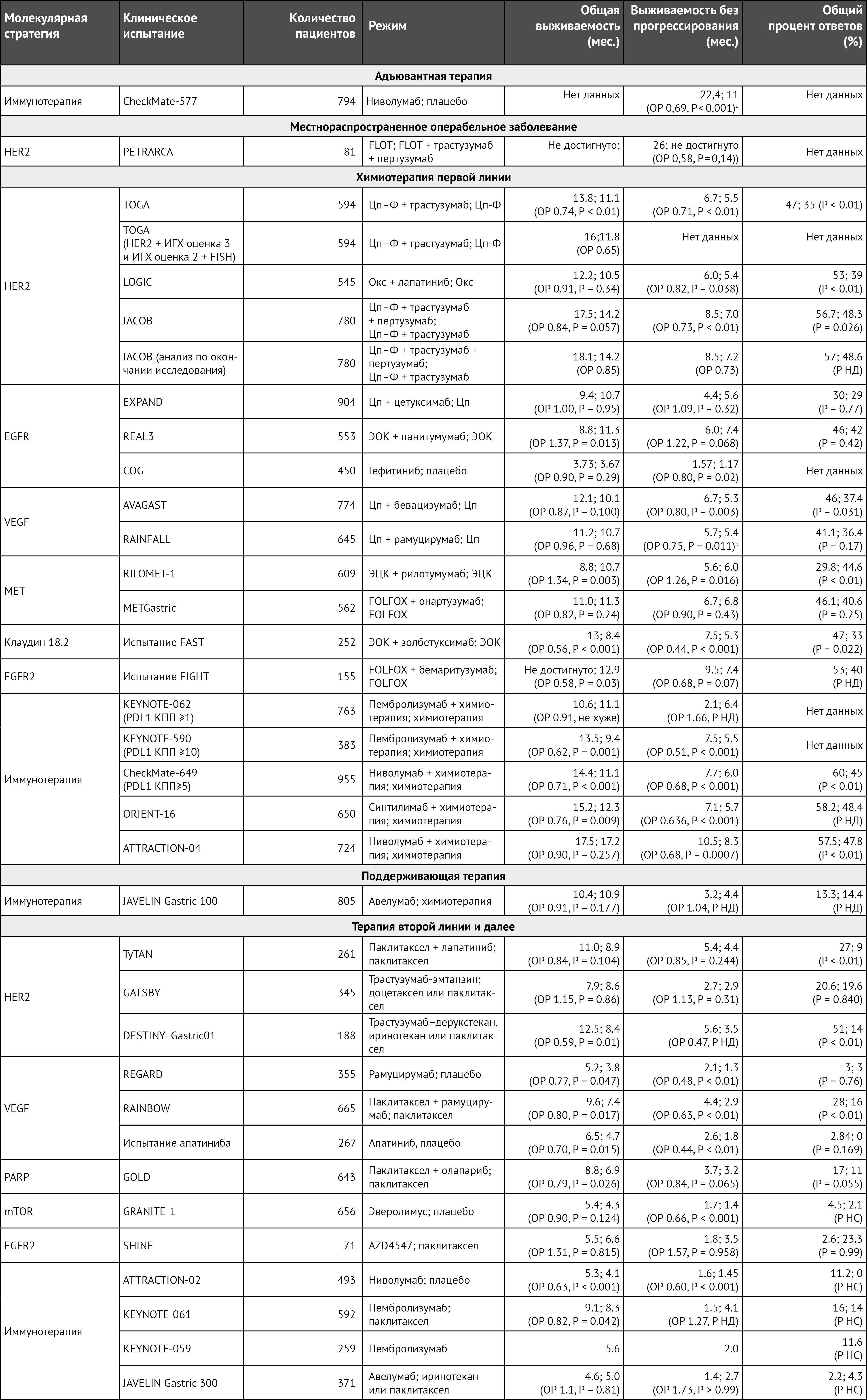
Описанные молекулярные особенности определяют хорошо известную гетерогенность пациентов, которая была основной причиной неудач в длинном списке клинических испытаний II и III фазы [18–26] (таблица 2). Кроме того, также были описаны вариации в пределах одной и той же опухоли как с пространственной, так и с временной точек зрения (внутрипациентная и/или внутриопухолевая гетерогенность) [27, 28]. Пространственная гетерогенность между пациентами была отмечена в 36% случаев рака желудка с несоответствием между первичными и повторными метастатическими поражениями [29, 30]. Аналогичные результаты были получены при сравнении образцов опухоли одного и того же пациента до и после таргетной терапии [31], что свидетельствует о временной гетерогенности отдельного пациента. Последнее часто связано с механизмом резистентности, в основном затрагивающим терапию, направленную на амплификацию EGFR, HER2 и MET, а также на слияния FGF2 [31–33].
Таблица 2 | Основные клинические исследования II и III фазы таргетных препаратов у пациентов с раком желудка и пищеводно-желудочного перехода
Для более глубокого понимания молекулярного профиля рака желудка и рассмотрения желудка как привилегированного места обитания микробов возрастает интерес к роли желудочного бактериального микробиома в канцерогенезе желудка. Хотя роль инфекции H. pylori как фактора, способствующего некардиальному канцерогенезу [34], хорошо описана, до сих пор не было представлено убедительных доказательств роли желудочного микробиома, и повреждение, вызванное хроническим воспалением, вторичным по отношению к бактериальной инфекции, может выступать в качестве основной причины патогенеза рака [35–37]. Действительно, было показано, что микробиота рака желудка характеризуется сниженным микробным разнообразием, представленным в основном H. pylori и другими бактериями из числа кишечных комменсальных микроорганизмов [38].
Начальные предпосылки
Несмотря на понимание важных молекулярных, гистологических и топографических различий при раке желудка, подход к лечению пациентов исторически разрабатывался в основном с учетом рака желудка как отдельного заболевания. В западных регионах в условиях местного распространения периоперационная химиотерапия стала стандартом лечения на основании результатов рандомизированных исследований III фазы [39, 40], особенно с комбинацией FLOT (доцетаксел, оксалиплатин, 5-фторурацил, лейковорин). У пациентов, перенесших предоперационное вмешательство, предпочтение отдается послеоперационной адъювантной химиотерапии [41]. У пациентов с нерезектабельным местнораспространенным или метастатическим заболеванием химиотерапия улучшает общую выживаемость и качество жизни по сравнению с наилучшей поддерживающей терапией, как показано в двух рандомизированных исследованиях фазы III с участием 208 пациентов [42, 43]. Кроме того, дополнительные линии лечения коррелируют с улучшением выживаемости [44]. Как правило, рекомендуемая терапия первой линии состоит из комбинации препаратов платины и фторпиримидина [7]. Оксалиплатин и цисплатин являются наиболее часто используемыми препаратами, тогда как фторпиримидины можно вводить в виде инфузий (5-фторурацил) или перорально (например, капецитабин). Было показано, что цисплатин и оксалиплатин одинаково эффективны [45], хотя в последние несколько лет оксалиплатин заменил цисплатин, вероятно, из-за своей лучшей переносимости. Пероральный капецитабин не менее эффективен, чем инфузионный 5-фторурацил [45]. В исследовании III фазы с участием 94 пожилых пациентов (старше 65 лет) оксалиплатин имел более высокий профиль безопасности по сравнению с цисплатином и был связан с тенденцией к улучшению общей выживаемости (13,9 мес против 7,2 мес) [46]. У пожилых или ослабленных пациентов химиотерапия на основе оксалиплатина со сниженной дозой может обеспечить сравнимую эффективность и лучшую переносимость, чем стандартная дозировка [47]. Тройная терапия доцетакселом может быть с осторожностью показана отдельным пациентам с опасным для жизни заболеванием, вторичным по отношению к высокой опухолевой массе [7]. Трастузумаб следует добавлять при лечении пациентов с HER2-положительными опухолями [48]. Кроме того, иммунотерапия препаратами против PD1 была включена в схему лечения первой линии у пациентов с PDL1-положительным заболеванием [49, 50]. Химиотерапия второй линии с использованием таксана (доцетаксел или паклитаксел), иринотекана или рамуцирумаба в сочетании с паклитакселом рекомендуется пациентам с сохраненным общим статусом [41] (рис. 1).
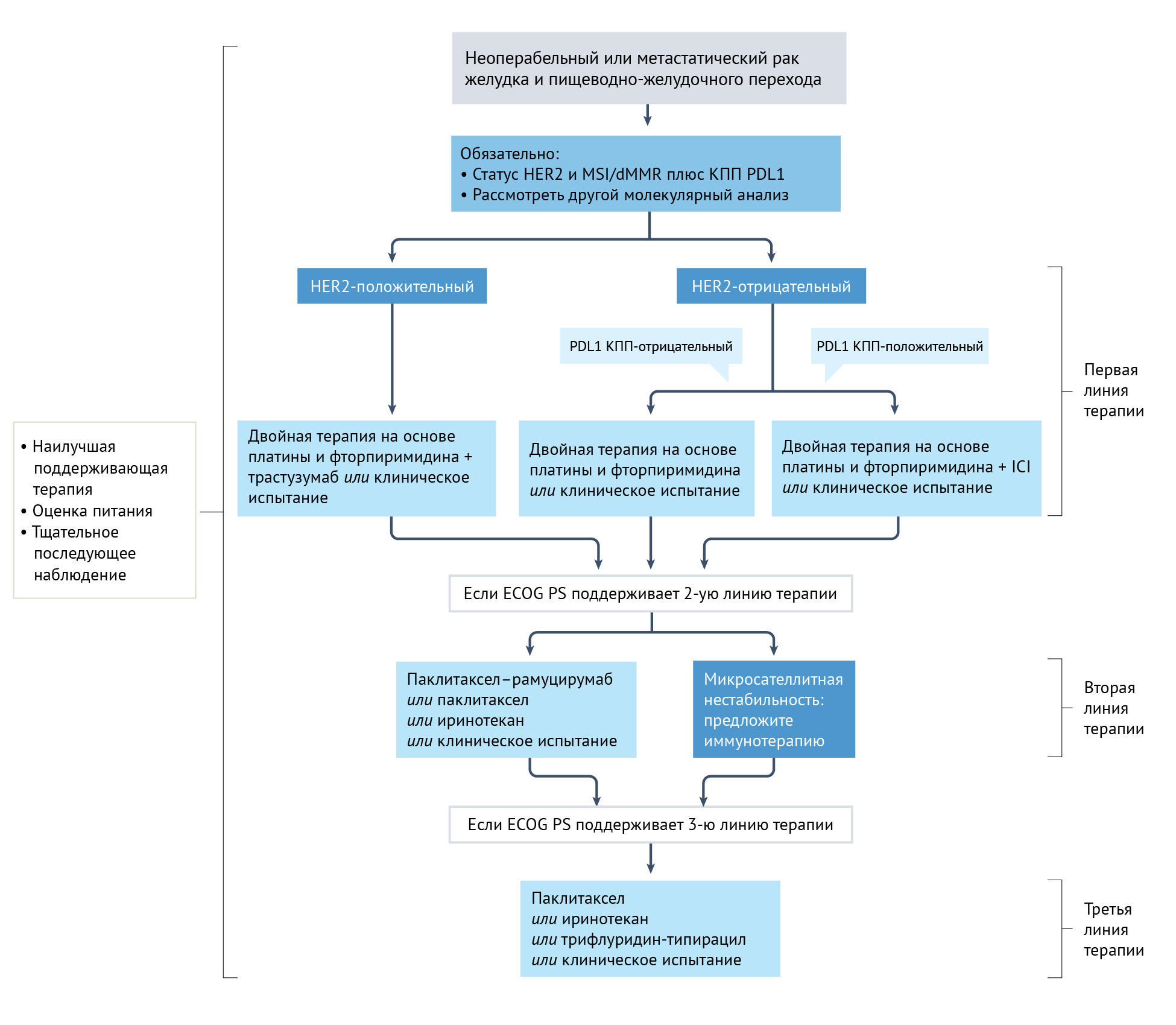
КПП— комбинированный показатель положительности; dMMR — дефицит репарации неправильно спаренных оснований; ECOG PS — статус работы Восточной кооперативной онкологической группы; HER2 — рецептор эпидермального фактора роста человека; ICI — ингибиторы иммунных чекпоинтов
Терапевтические подходы на основе молекулярных механизмов, хотя и сложны, могут улучшить прогноз пациентов с раком желудка. Многие клинические испытания фазы II и III с таргетными агентами, к сожалению, потерпели неудачу (таблица 2). Отсутствие успеха может быть связано с неоптимальным выбором биомаркеров (или его отсутствием). Хотя пациентов необходимо отбирать на основе молекулярной аберрации, которая может служить мишенью у каждого пациента (т. е. на основе пространственной неоднородности), несоответствие между первичной опухолью и метастазом (т. е. временная неоднородность) в некоторых случаях затрудняло точную оценку [20, 22–26, 51–53]. Персонализированная медицина требует надлежащей оценки опухоли с молекулярной точки зрения и — особенно в контексте этого типа опухоли — целостного подхода к лечению и уходу за пациентом. Междисциплинарная команда должна учитывать слабое здоровье пациентов с раком желудка не только для замедления прогрессирования опухоли, но и для контроля их симптоматики с целью улучшения качества жизни.
Анти-HER2-терапия
Пациенты с раком желудка на поздних стадиях и с HER2-позитивными опухолями были первой подгруппой, отобранной для таргетной терапии. В качестве препарата первой линии благоприятный эффект у пациентов с HER2-положительными опухолями, включенных в исследование III фазы TOGA в 2010 г., показало антитело против HER2 — трастузумаб [48]. Критерии включения требовали амплификации HER2, которую оценивали с помощью флуоресцентной гибридизации in situ (FISH). Пациенты были рандомизированы для получения химиотерапии (цисплатин и фторпиримидин) и трастузумаба или только химиотерапии. В экспериментальной группе улучшилась медиана общей выживаемости пациентов, особенно у лиц с оценкой иммуногистохимии (ИГХ) 3+ или с положительным результатом FISH и оценкой ИГХ 2+. Медиана общей выживаемости составила 13,8 месяца в группе, получавшей химиотерапию и трастузумаб, и 11,1 месяца в группе, получавшей только химиотерапию (ОР 0,74, 95% ДИ 0,60–0,91; P = 0,0046) [48]. За этим исследованием последовали три важных события. Во-первых, в результате был адаптирован стандарт лечения пациентов с HER2-положительными опухолями, сочетающий трастузумаб и химиотерапию цисплатином и фторпиримидинами. При метастазировании стало обязательным определение HER2-позитивных клеток для принятия клинического решения. Наконец, в Европе положительность по HER2 определяют как оценку ИГХ 3+ или оценка ИГХ 2+ с положительным результатом FISH.
Следующими шагами было тестирование блокады HER2 в последовательных линиях терапии и оптимизация этого подхода в условиях первой линии. Однако результаты различных исследований фазы II и III, проведенных в этой популяции (пациенты с раком желудка и HER2-позитивными опухолями), разочаровали. В исследовании JACOB сравнивали химиотерапию в сочетании с трастузумабом и пертузумабом — гуманизированным моноклональным антителом, которое связывает другой эпитоп на белке рецептора HER2, нежели трастузумаб, — с химиотерапией в сочетании с трастузумабом. Окончательный анализ не показал значительного улучшения общей выживаемости (ОР 0,84, 95% ДИ 0,71–1,00; P = 0,057). Тем не менее, в анализе в конце исследования сообщаемый коэффициент риска составил 0,85 (95% ДИ 0,72–0,99) при медиане общей выживаемости 18,1 месяца в экспериментальной группе по сравнению с 14,2 месяца в контрольной группе [18, 51].
Лапатиниб, низкомолекулярный двойной ингибитор тирозинкиназы EGFR и HER2, не показал эффективности ни в первой линии (испытание LOGIC), ни во второй линии (испытание TyTAN) у пациентов с опухолями с амплификацией HER2 [19, 20]. Наконец, трастузумаб–эмтанзин, конъюгат антитела с лекарственным средством (ADC), который содержит трастузумаб, связанный с эмтанзином (ингибитором тубулина), также оказался неэффективным в терапии второй линии у пациентов с опухолями с амплификацией HER2 (испытание GATSBY) [21] (таблица 2).
Терапия, направленная на HER2, также оценивалась при местно-распространенном операбельном раке желудка. Испытание фазы II NEOHX стало первым опубликованным исследованием, в котором была показана активность блокады HER2 в этих условиях [54]. В этом нерандомизированном исследовании II фазы изучалась комбинация оксалиплатина и капецитабина с трастузумабом у 36 пациентов с HER2-положительным раком желудка. Первичная конечная точка была достигнута: 18-месячная безрецидивная выживаемость составила 71% (95% ДИ 53–83%). Другие вторичные конечные точки, такие как частота полного ответа (9,6%) и негативные в плане метастатического поражения лимфатические узлы (51%), показали умеренную эффективность комбинированного лечения. Рандомизированное испытание II фазы PETRARCA, которое было закрыто досрочно, оценивало комбинацию трастузумаба и пертузумаба со стандартной комбинацией FLOT по сравнению с одной только химиотерапией [55]. Двойная блокада HER2 в сочетании с химиотерапией FLOT значительно улучшила частоту полного патологического ответа (12% по сравнению с 35%; P = 0,02) и процент негативных лимфоузлов (39% по сравнению с 68%). Хотя у пациентов экспериментальной группы наблюдалась большая токсичность, частота резекций и хирургическая заболеваемость оказались сопоставимы. В текущем испытании III фазы INNOVATION пациентам с раком желудка рандомизированно назначали химиотерапию, химиотерапию и трастузумаб или химиотерапию, трастузумаб и пертузумаб [56] (таблица 3). Окончательные результаты (предполагаемая дата завершения 31 декабря 2028 г.) могут стать поворотным моментом в установлении значения блокады HER2 в периоперационных условиях.
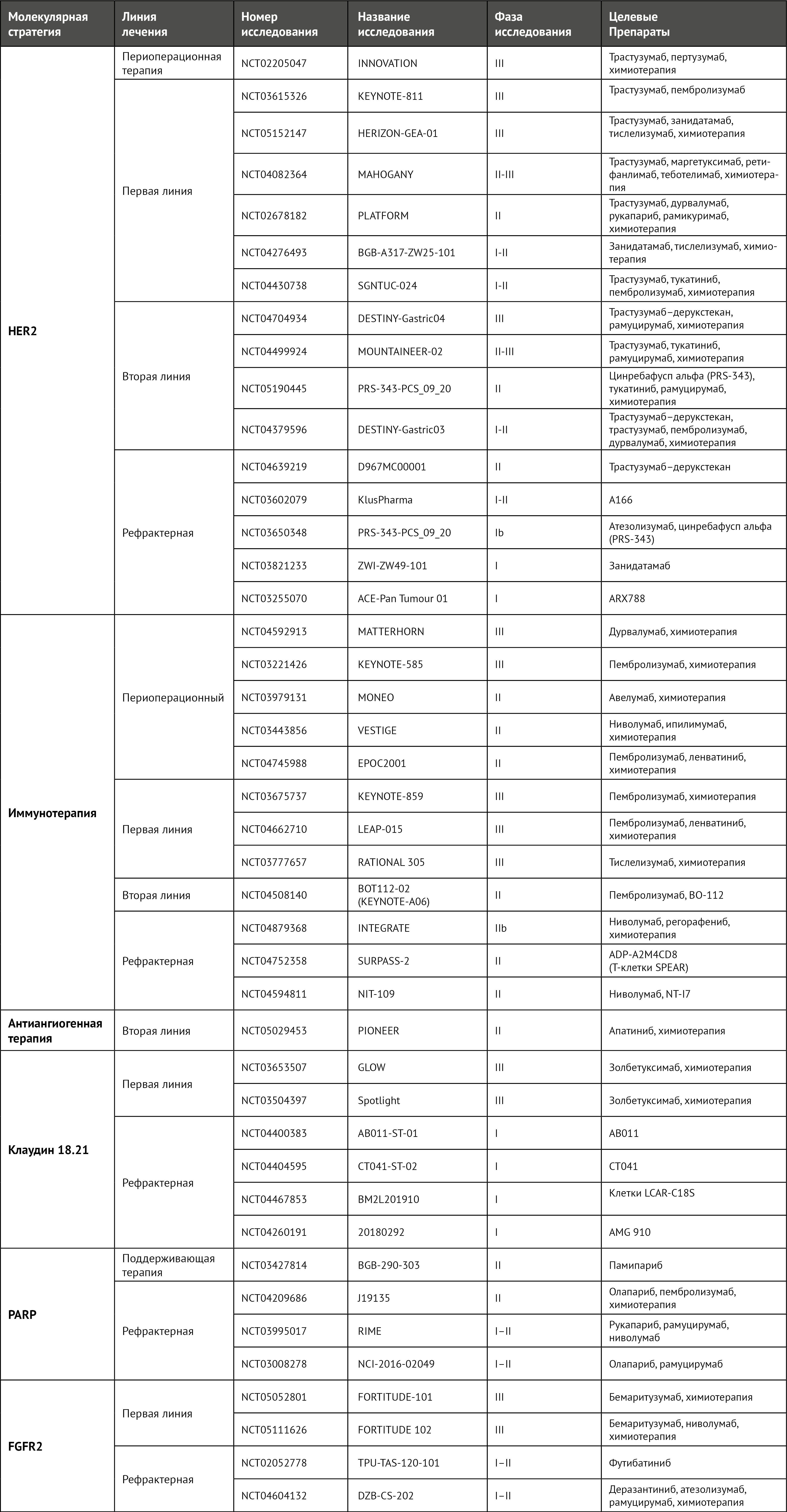
Таблица 3 | Текущие клинические испытания таргетных препаратов для пациентов с раком желудка и пищеводно-желудочного перехода
Оценка HER2 при раке желудка неоднократно описывалась как сложная, что ставит под сомнение возможные факторы, которые могли бы предсказать реакцию и устойчивость к блокаде HER2. Опубликованные руководства вызывают споры, поскольку HER2-позитивность определяется как ситуация, в которой положительно на HER2 окрашиваются по крайней мере 10% опухолевых клеток в хирургических образцах и 5% — в образцах биопсии [57]. Однако более высокая экспрессия белка HER2 и амплификация HER2 были связаны с большей эффективностью трастузумаба. В исследовании TOGA у пациентов с опухолями по шкале ИЦХ 3+ медиана общей выживаемости ИЦХ 17,9 месяцев, а у пациентов с оценкой ИЦХ 2+ и положительным результатом FISH средняя общая выживаемость составила 12,3 месяца [48]. Эти данные ставят под сомнение точку отсечения в соответствующих рекомендациях [19, 48, 58, 59]. В исследовании с участием 88 пациентов с раком желудка внутриопухолевая гетерогенность HER2 была обнаружена у 26% пациентов и была связана с худшей выживаемостью (25,7 мес в группе с гомогенным HER2 и 12,5 мес в группе с гетерогенным HER2; ОР 2,430, 95% ДИ 1,389–4,273; P = 0,002) [60]. Действительно, внутриопухолевая гетерогенность может возникать в разных областях опухоли (пространственная гетерогенность) или между первичным и рецидивирующим или метастатическим заболеванием (временная гетерогенность), поэтому некоторые определения HER2 могут не отражать истинной важности сигнального пути HER2 в каждой опухоли.
Помимо сложности оценки HER2, описаны первичные механизмы резистентности к терапии, направленной на HER2. Некоторые генетические изменения могут компенсировать блокаду HER2-сигналинга: например, потеря PTEN, активирующие мутации в PIK3CA, слияния FGFR2 и амплификации CCNE1 или EGFR [61]. Наконец, после анти-HER2-терапии может развиться приобретенная резистентность к противоопухолевым препаратам [62]. Потеря экспрессии HER2 является одним из наиболее распространенных механизмов вторичной резистентности, поэтому в испытаниях второй линии рекомендуется переоценка HER2. Кроме того, амплификация EGFR и MET может активировать сигнальный путь PI3K, преодолевая вышестоящее в этом пути ингибирование HER2 [62].
Для преодоления этих проблем разрабатываются новые исследовательские стратегии с новыми ADC и более мощными антителами. Трастузумаб–дерукстекан представляет собой ADC, состоящий из антитела против HER2, расщепляемого линкера на основе тетрапептида и цитотоксического ингибитора топоизомеразы I. Этот препарат обладает «эффектом свидетеля», который позволяет разрушать окружающие клетки, в том числе HER2-отрицательные. Такой эффект представляет собой интересный механизм с учетом гетерогенности опухоли. Исследование DESTINY-Gastric01 было рандомизированным испытанием фазы II у пациентов с прогрессированием заболевания на двух или более линиях терапии, включая трастузумаб [63]. Первичная цель общей частоты ответа (ОЧО) была достигнута при значительной разнице между группами: 51% в группе, получавшей трастузумаб–дерукстекан и 14% в группе, получавшей лечение по выбору врача (состоящее из паклитаксела или иринотекана) (P < 0,001). В настоящее время трастузумаб–дерукстекан сравнивают с паклитакселом–рамуцирумабом в терапии второй линии [64]. Другие направленные на HER2 ADC в настоящее время оцениваются для применения у пациентов с HER2-положительным раком желудка в текущих клинических испытаниях [65–67]. Маргетуксимаб представляет собой антитело против HER2 с высокой аффинностью, которое показало многообещающую активность в виде монотерапии в исследовании фазы I, включавшем 66 пациентов с предварительно пролеченным HER2-положительным раком молочной железы или желудка [68]. Общий уровень в контроле составил 62%, у 50% пациентов наблюдалось стабильное заболевание и у 12% — частичный ответ [68]. Тукатиниб — низкомолекулярный препарат, который обратимо связывается с АТФ-связывающим карманом внутреннего домена рецептора HER2. В настоящее время продолжается исследование фазы II–III, в котором тестируют тукатиниб, трастузумаб, паклитаксел и рамуцирумаб в сравнении с паклитакселом и рамуцирумабом в условиях второй линии [69]. Наконец, в настоящее время исследуется занидатамаб — биспецифическое антитело, которое ингибирует внеклеточные домены 2 и 4 HER2 (таблица 3).
Еще одним новым подходом к лечению пациентов с раком желудка является сочетание терапии, направленной на HER2, с иммунотерапией или антиангиогенной терапией. Клиническое испытание III фазы KEYNOTE-811 было начато для сравнения преимуществ трастузумаба и химиотерапии с пембролизумабом по сравнению с трастузумабом и химиотерапией [71]. Предварительные результаты для первых 264 включенных пациентов показали обнадеживающую ОЧО 74,4% в группе «пембролизумаб плюс химиотерапия и трастузумаб» по сравнению с 51,9% в «группе химиотерапия плюс трастузумаб» (P = 0,0006). Эти результаты предполагают возможный синергетический эффект между ICI и таргетными агентами в HER2-положительных опухолях. Трастузумаб–дерукстекан в настоящее время оценивается в комбинации с дурвалумабом [72]. В исследованиях фазы Ib и II у 95 пациентов с HER2-положительным раком желудка, рефрактерным по крайней мере к одной линии лечения, включая трастузумаб и цисплатин, маргетуксимаб в комбинации с пембролизумабом показали уровень контроля заболевания на уровне почти 20% [73]. В настоящее время маргетуксимаб тестируется с другими ICI, включая ретифанлимаб — гуманизированное антитело к PD1, и теботелимаб — биспецифическую молекулу DART, которая блокирует PD1 и LAG3 [74]. Тукатиниб в настоящее время проходит испытания с трастузумабом и пембролизумабом в качестве препаратов первой линии [75]; и с трастузумабом, рамуцирумабом и паклитакселом — в качестве препаратов второй линии [69]. Занидатамаб в сочетании с химиотерапией оценивается в качестве терапии первой линии с тислелизумабом — гуманизированным моноклональным антителом к PD1, или без него [70, 76] (таблица 3).
Некоторые из этих новых препаратов и комбинаций могут оказаться многообещающими при лечении пациентов с низким уровнем HER2 [77, 78] или пациентов с активирующими мутациями HER2 [79] (таблица 3). Например, в испытании DESTINY-Gastric01 трастузумаб–дерукстекан продемонстрировал предварительную эффективность в двух когортах исследования из 20 и 24 пациентов с опухолями с низким уровнем экспрессии HER2, то есть с оценкой ИЦХ 2+ и с отрицательными результатами FISH и оценкой ИЦХ 1+, соответственно. ОЧО составила 26,3% и 9,5%, а медиана общей выживаемости — 7,8 месяцев и 8,5 месяцев, соответственно [80].
Иммунотерапия
Иммунотерапия, особенно с помощью ICI, изменила направление терапии рака, и опухоли желудка не стали исключением. Рак желудка включает опухоли со средней или высокой опухолевой мутационной нагрузкой (TMB) [81], и некоторые подтипы, такие как опухоли MSI-H или рак, связанный с EBV, особенно чувствительны к иммунотерапии. В этом разделе обсуждаются данные основных испытаний, тестирующих ICI при раке желудка, и таким образом подчеркивается истинная ценность этого нового подхода.
В условиях рефрактерности ниволумаб — антитело к PD1 — продемонстрировал преимущество перед плацебо в исследовании III фазы в Азии с участием 493 пациентов из Японии, Южной Кореи и Тайваня [82]. Медиана общей выживаемости составила 5,26 месяца в группе ниволумаба и 4,14 месяца в группе плацебо (ОР 0,63, 95% ДИ 0,51–0,78; P < 0,001). Международное исследование фазы II было проведено по всему миру в аналогичных условиях рефрактерности у 259 пациентов с сопоставимыми результатами и обнадеживающим преимуществом, наблюдаемым в опухолях, экспрессирующих PDL1, с комбинированным показателем положительности (КПП; количество PDL1-позитивных клеток (опухоль, лимфоциты и макрофаги) по отношению к общему количеству опухолевых клеток) ≥1 [83], оцененное с использованием анализа ИГХ pharmaDx 22C3. Однако испытание III фазы JAVELIN Gastric 300, проведенное для авелумаба в качестве препарата третьей линии, не улучшило общую выживаемость или выживаемость без прогрессирования (ВБП) при сравнении авелумаба (антитело к PDL1) с химиотерапией в неотобранной популяции [84]. Сходным образом, пембролизумаб не продемонстрировал преимуществ с точки зрения ВБП или общей выживаемости по сравнению с паклитакселом в качестве второй линии у 395 пациентов с раком желудка и КПП PDL1 ≥1 (тест 22C3 ИГХ) в исследовании III фазы KEYNOTE-061 [85]. Не менее важно учитывать, что пембролизумаб продемонстрировал превосходство в незапланированном анализе популяции с КПП PDL1 ≥10, что, вероятно, указывает на лучшую точку отсечения КПП PDL1 [85]. Новые комбинации потенциально могут преодолеть резистентность к иммунотерапии в условиях рефрактерности (например, испытания NCT04508140, NCT04879368, NCT04752358 и NCT04594811 [86–89]) (таблица 3).
Несколько препаратов против PD1 оценивались в сочетании со стандартной химиотерапией в условиях первой линии. Ниволумаб продемонстрировал преимущества в комбинации с химиотерапией (оксалиплатин и фторпиримидины) по сравнению с одной только химиотерапией в испытании III фазы CheckMate-649 [49] с участием 1581 пациентов. Основной целью этого исследования была общая выживаемость в популяции с CPS PDL1 ≥5 (проверено с использованием анализа ИГХ pharmaDx 28-8); в экспериментальной группе медиана общей выживаемости составила 13,1 месяца по сравнению с 11,1 месяца в контрольной группе (ОР 0,71, 98,4% ДИ 0,59–0,86; P < 0,0001) [49]. В этом исследовании присутствовала первоначальная группа, участие которой было досрочно прекращено, с комбинацией ниволумаба с антигеном против цитотоксических Т-лимфоцитов 4 — ипилимумабом, — который не смог продемонстрировать превосходство над химиотерапией. Результаты комбинированной иммунохимиотерапии не воспроизводились в испытании KEYNOTE-062 — исследовании пембролизумаба фазы III с применением того же подхода [90]. В испытании KEYNOTE-062 химиотерапия сравнивалась с химиотерапией плюс пембролизумаб и с монотерапией пембролизумабом у 763 пациентов с КПП PDL1 ≥1 (анализ pharmaDx 22C3 ИГХ). Добавление пембролизумаба к химиотерапии не дало никаких преимуществ по сравнению с химиотерапией самой по себе. Несмотря на неоднозначность результатов, пембролизумаб в монотерапии продемонстрировал превосходство над химиотерапией у пациентов с КПП PDL1 ≥10; пересечение кривых Каплана–Мейера в начале поднимает вопрос о том, может ли химиотерапия обеспечить лучшую выживаемость в течение первых месяцев лечения. Испытание фазы III KEYNOTE-590 в основном было сосредоточено на раке пищевода, но у 12% пациентов опухоль локализовалась в ПЖП [50]. Это положительное исследование показало улучшение общей выживаемости при добавлении пембролизумаба к химиотерапии у всех участников (медиана общей выживаемости 12,4 месяца по сравнению с 9,8 месяца; ОР 0,73, 95% ДИ 0,62–0,86; P < 0,0001) и главным образом — у пациентов с PDL1 КПП ≥10 (медиана общей выживаемости 13,5 по сравнению с 9,4 месяца; ОР 0,62, 95% ДИ 0,49–0,78; P < 0,0001). Текущее исследование фазы III пембролизумаба в сочетании с химиотерапией на основе оксалиплатина, вероятно, прояснит, может ли базовая часть химиотерапии повлиять на эти результаты [91]. У населения Японии, Южной Кореи и Тайваня ниволумаб в сочетании с химиотерапией на основе оксалиплатина значительно улучшал ВБП (ОР 0,68, 98% ДИ 0,51–0,90; P = 0,0007), но не общую выживаемость [92]. Кроме того, были разработаны другие ICI, такие как синтилимаб — гуманизированное антитело к PD1, с положительными результатами рандомизированного испытания фазы III, проведенного в Китае [93]. В этом исследовании 650 пациентов были рандомизированы в группы синтилимаба с химиотерапией на основе оксалиплатина или только химиотерапией. У пациентов с CPS > 5 медиана общей выживаемости улучшилась в группе синтилимаба с химиотерапией (18,4 месяца по сравнению с 12,9 месяца; ОР 0,66, 95% ДИ 0,5–0,86; P = 0,0023) [93]. В испытании III фазы RATIONALE 305 с участием 997 пациентов по всему миру [94] тислелизумаб тестировался в комбинации с химиотерапией у пациентов с раком желудка, опухоли которых экспрессировали PDL1 [95]. Предварительные результаты продемонстрировали устойчивый ответ с управляемой переносимостью (таблица 3).
Роль поддерживающей терапии оценивалась в исследовании III фазы JAVELIN Gastric 100, но оно не продемонстрировало более высокой общей выживаемости при поддерживающей терапии авелумабом по сравнению с продолжением химиотерапии первой линии у всех участников или популяции, предварительно определенной как PDL1-положительная [96].
Таким образом, обсуждались расхождения между исследованиями, и тип химиотерапии, выбранный в каждом испытании, мог повлиять на различия в результатах. Линия лечения, в которой вводятся ICI, также отличаются. Наконец, могло различаться количество включенных пациентов, с отчетливым полезным эффектом, включая подгруппы с опухолями, особенно чувствительные к иммунотерапии, такие как MSI-H и EBV. Ответ на вопрос о наилучшей линии лечения с помощью ICI остается неопределенным. Учитывая обнадеживающие результаты сходных исследований и слабое здоровье пациентов с раком желудка, лечение первой линии, вероятно, будет связано с лучшими результатами. Анализ реальных данных поможет разрешить эту дискуссию.
Специально разработанное для опухолей MSI-H панопухолевое исследование фазы II KEYNOTE-158, в котором приняли участие 233 пациента, тестировало пембролизумаб в популяции MSI-H; результаты были исключительными, с ОЧО 45% (95% ДИ 45,8–67,2%) и медианой ВБП 11,0 месяцев (95% ДИ от 2,1 месяца до не достигнутого) в когорте пациентов с раком желудка, получавших предварительное лечение. Результаты этого исследования привели к первому одобрению от FDA вне зависимости от типа опухоли, и EMA последовало его примеру [97]. Рак желудка был вторым типом опухоли, включенным в KEYNOTE-158. Кроме того, апостериорный анализ 84 пациентов с опухолями MSI-H, получавших лечение пембролизумабом в испытаниях KEYNOTE-059, KEYNOTE-061 и KEYNOTE-062, подтвердил эти результаты [98], как и апостериорный анализ 65 пациентов с опухолями MSI-H в испытании III фазы исследования Checkmate-649 [99]. Ретроспективный анализ показал впечатляющий ответ на иммунотерапию при EBV-положительных опухолях. В ретроспективном анализе исследования II фазы все шесть пациентов с EBV-положительным раком желудка достигли частичного ответа со средней продолжительностью ответа 8,5 месяцев [100]. Сходным образом, TMB из десяти или более соматических или приобретенных мутаций (mut) на кодирующую область опухолевого генома (Mb) был постулирован в качестве биомаркера независимой пользы иммунотерапии [101, 102]. Наконец, как описано выше, другим важным прогностическим фактором является PDL1, выраженный в виде КПП. Несмотря на разные пороговые значения, КПП был пропорционально связан с пользой во всех кратко обсуждаемых авторами испытаниях.
Были разработаны альтернативные комбинации нехимиотерапевтических препаратов с иммунотерапией. Комбинация HER2-таргетной терапии с пембролизумабом описана выше. Недавние данные показывают существенное перекрытие (85%) между позитивностью по HER2 и PDL1, что говорит в пользу эффективности двойной терапии анти-HER2 и анти-PDL1 [103]. Кроме того, в настоящее время совместно с ICI исследуются мультикиназные ингибиторы, в том числе регорафениб и ниволумаб или ленватиниб и пембролизумаб [104] (таблица 3). Рациональное основание для применения этих комбинаций остается сомнительным, но может быть подтверждено на основе возможного синергизма между ICI и таргетной терапией. Однако в противном случае синергизм мог бы быть вторичным по отношению к сумме эффективностей каждого препарата [105]. Кроме того, биспецифические антитела, направленные на различные ICI, дали свои первые результаты с AK104 (анти-PD1/CTLA4) в сочетании с химиотерапией в исследовании фазы Ib у 34 пациентов [106]. Наконец, оцениваются другие новые стратегии, специально нацеленные на иммуносупрессивное действие регуляторных Т-клеток [107].
Предварительные результаты иммунотерапии были получены при периоперационном лечении местно-распространенного заболевания. Были протестированы различные комбинации, включая камрелизумаб (антитело к PD1) плюс оксалиплатин и 5-фторурацил–лейковорин (FOLFOX6) [108], торипалимаб (антитело к PD1) плюс FLOT [109] или авелумаб с модифицированной схемой доцетаксел–цисплатин–5-фторурацил [110]. Несмотря на небольшое количество пациентов (n = 16–36), данные в отношении частоты полных резекций и патологических полных ответов обнадеживают. Продолжаются новые рандомизированные исследования, такие как исследование фазы II MONEO с периоперационным авелумабом и FLOT [111] или другими комбинациями, такими как химиотерапия плюс пембролизумаб [112] или дурвалумаб [113], а также пембролизумаб–ленватиниб [114]. В исследовании II фазы VESTIGE115 изучается адъювантный подход с применением ингибиторов анти-PD1 плюс анти-CTLA4 у пациентов с плохим ответом на неоадъювантную химиотерапию (таблица 3). При местнораспространенном заболевании после неоадъювантной химиолучевой терапии исследование CheckMate-577 (таблица 2) было первым испытанием III фазы, показавшим положительные результаты применения ниволумаба в качестве адъювантной терапии у пациентов с РПЖП [116]. В исследование были включены пациенты с раком пищевода (60%; плоскоклеточная карцинома и аденокарцинома) и пациенты с РПЖП (40%). Основная цель — безрецидивная выживаемость — лучше достигалась в группе ниволумаба (22,4 месяца по сравнению с 11,0 месяца в группе плацебо; ОР 0,69, 95% ДИ 0,56–0,86; P < 0,001). При анализе подгрупп преимущество сохранялось у пациентов с гистологией аденокарциномы, что составляло 71% включенных пациентов, но не у пациентов с РПЖП. Наконец, популяция MSI-H также представляет интерес в условиях местнораспространенного заболевания. В испытании II фазы GERCOR NEONIPIGA изучался периоперационный подход у 32 пациентов с раком желудка MSI-H с применением неоадъювантной терапии ипилимумабом плюс ниволумаб и адъювантной терапии ниволумабом [117]. У трех пациентов был полный эндоскопический ответ без необходимости хирургического вмешательства, а из 29 пациентов, перенесших операцию, у 17 (58,6%; 90% ДИ 41,8–74,1%) был патологический полный ответ. Результаты этого исследования определяют возможность и эффективность иммунотерапии в периоперационных условиях рака желудка MSI-H.
Антиангиогенная терапия
Ангиогенез является одним из признаков рака [118]. Опухоли желудка часто экспрессируют фактор роста эндотелия сосудов (VEGF) на высоком уровне и секретируют проангиогенные цитокины. Однако единого мнения о включении антиангиогенной терапии в клиническую практику не было.
Рамуцирумаб — рекомбинантное моноклональное антитело IgG1 человека против VEGF-рецептора 2 (VEGFR2) — продемонстрировал ограниченную эффективность при монотерапии по сравнению с плацебо в условиях второй линии (исследование REGARD) [119], а комбинация рамуцирумаба с паклитакселом незначительно улучшила общую выживаемость по сравнению с химиотерапией (исследование RAINBOW) [120] (таблица 2). Таким образом, комбинация рамуцирумаба и паклитаксела стала новым стандартом лечения. В настоящее время исследование, в котором тестируется комбинация рамуцирумаба и тусамитамаба–равтанзина — иммуноконъюгата, состоящего из молекулы клеточной адгезии, связанной с антиканцерогенным эмбриональным антигеном 5, конъюгированной с цитотоксическим агентом, — позволит дополнительно оценить эту многообещающую эффективность (NCT05071053) (таблица 3).
Апатиниб — низкомолекулярный ингибитор тирозинкиназы (TKI) VEGFR2 — улучшил общую выживаемость по сравнению с плацебо в рефрактерной популяции в китайском исследовании с участием 267 пациентов [121]. К сожалению, эти результаты не воспроизвелись в международном исследовании [122]. Тем не менее, в настоящее время оценивается использование апатиниба в качестве терапии второй линии [123] (таблица 3).
Несмотря на активность во второй линии и за ее пределами, направленное воздействие на ангиогенез в терапии первой линии, по-видимому, не коррелирует с эффективностью. Ни рамуцирумаб (исследование RAINFALL) [53], ни бевацизумаб — моноклональное антитело против VEGFA (исследование AVAGAST) [52], не продемонстрировали достаточной активности при добавлении к химиотерапии первой линии в неотобранной популяции с раком желудка (таблица 2).
В испытании II фазы RAMSES/FLOT7 у 180 рандомизированных пациентов оценивалась стандартная периоперационная химиотерапия FLOT в условиях местно-распространенной терапии с той же схемой химиотерапии плюс рамуцирумаб [124]. Сообщается, что предварительные результаты с добавлением рамуцирумаба показали увеличение R0 резекций и особую эффективность при больших опухолях.
К сожалению, все испытания, проведенные с антиангиогенными препаратами при раке желудка, рассчитаны на всех участников. Исследователи изучили различные биомаркеры для выбора, и высокие исходные уровни VEGFA в плазме и/или низкая исходная экспрессия нейропилина-1 коррелировали с лучшей общей выживаемостью при применении бевацизумаба [125]. Однако ни один из них не прошел перспективную проверку.
Старые (неудачные) таргетные методы лечения
EGFR
Амплификация или гиперэкспрессия EGFR обнаруживаются в 5–10% случаев рака желудка. Крупные исследования фазы III в неотобранной популяции с использованием моноклональных антител [22, 23] или ИТК [24] не увенчались успехом (таблица 2). Однако в ретроспективных анализах биомаркеров или в небольших клинических исследованиях [126] при лечении пациентов с опухолями с амплифицированным EGFR результаты были намного лучше: частота ответа составила 58%, а ВБП — 10 месяцев, что указывает на пользу в отобранной популяции.
Терапия, направленная на МЭП
При раке желудка изучалась терапия на основе направленного воздействия на мезенхимно-эпителиальный переход (MЭП). Рецептор MЭП представляет собой тирозинкиназный рецептор фактора роста гепатоцитов. К обеим молекулам были разработаны моноклональные антитела (онартузумаб и рилотумумаб, соответственно), но результаты двух крупных рандомизированных исследований III фазы, проведенных в режиме первой линии (исследование METGastric и исследование RILOMET-1), не показали улучшения общей выживаемости [25, 26] (таблица 2). У пациентов с умеренным (оценка 2+) или сильным (оценка 3+) ИГХ-окрашиванием > 50% опухолевых клеток наблюдалось улучшение выживаемости в исследовании METGastric, в котором к химиотерапии добавлялся онартузумаб. Тем не менее, в том же исследовании не было различий в ОЧО между химиотерапией с онартузумабом и только химиотерапией. В стратегии направленного воздействия на МЭП остаются трудности, и еще раз необходимо тщательно оценить гетерогенность опухоли, а также первичную и приобретенную резистентность.
Ингибиторы PARP
Дефицит репарации с помощью гомологичной рекомбинации делает опухоли чувствительными к химиотерапии, повреждающей ДНК, и ингибиторам поли(АДФ-рибозы) полимеразы (PARPi). Сигнатура, связанная с дефицитом репарации с помощью гомологичной рекомбинации, была обнаружена в 7–12% случаев рака желудка во всем мире, и у ~ 3% пациентов обнаружились мутации зародышевой линии в генах, связанных с репарацией с помощью гомологичной рекомбинации, таких как BRCA1, PALB2 и RAD51C [127].
Исследование III фазы GOLD, в котором паклитаксел сравнивался с олапарибом PARPi, было запланировано после прогрессирования заболевания на терапии первой линии [128] (таблица 2). Испытание показало незначительный эффект. Продолжается исследование поддерживающей терапии олапарибом [129]. Кроме того, оцениваются другие PARPi и комбинации с антиангиогенными агентами [130–132] и иммунотерапией [133] (таблица 3).
Анти-mTOR-терапия
У пациентов с раком желудка наблюдалось нарушение регуляции мишени рапамицина у млекопитающих (mTOR) [134], а в исследованиях ранней фазы сообщалось о некоторой активности эверолимуса — перорального ингибитора mTOR [135]. Исследование фазы III GRANITE-1 проводилось у 656 пациентов с раком желудка, не отобранных по биомаркерам. Однако эверолимус не улучшал общую выживаемость по сравнению с плацебо у этих пациентов, у которых ранее наблюдалось прогрессирование заболевания на одной или двух линиях системной химиотерапии для борьбы с распространенным заболеванием [136] (таблица 2).
Новые (многообещающие) таргетные методы лечения
FGFR2
Ген FGFR2 амплифицируется у 15% пациентов с раком желудка во всем мире и связан с худшим прогнозом [137]; были опробованы некоторые лекарства, направленные против этого рецептора. Например, бемаритузумаб является первым в своем классе гуманизированным моноклональным антителом IgG1, которое избирательно связывает FGFR2b, ингибирует связывание лиганда и способствует антителозависимой клеточно-опосредованной цитотоксичности [138]. Он был протестирован в ходе рандомизированного испытания II фазы FIGHT, в котором сравнивали стандартную химиотерапию (FOLFOX6) с тем же режимом плюс бемаритузумаб. Комбинация улучшала ВБП и общую выживаемость при раке желудка с гиперэкспрессией FGFR2b (таблица 2). Интересно, что обнаружена значительная положительная корреляция между наличием однородного FGFR2b-положительного окрашивания (показатель ИГХ 2+ или 3+ в ≥ 10% опухолевых клеток) и улучшением выживаемости у пациентов, получавших бемаритузумаб, со средней общей выживаемостью 25,4 месяца в группе бемаритузумаба и 11,1 месяца в группе химиотерапии (ОР 0,41, 95% ДИ 0,23–0,74; P < 0,001) [139]. Эти результаты подчеркивают необходимость наличия биомаркера и, что более важно, надежного. Бемаритузумаб проходит испытания в качестве препарата первой линии в двух клинических исследованиях III фазы: только с химиотерапией [140] и с добавлением иммунотерапии [141]. Деразантиниб представляет собой перорально биодоступный ИТК FGFR1, FGFR2 и FGFR3. В продолжающемся клиническом исследовании [142] деразантиниб тестируется в качестве монотерапии или же в комбинации с паклитакселом, рамуцирумабом или атезолизумабом у пациентов с HER2-отрицательным раком желудка, содержащим генетические аберрации FGFR2 (транслокации гена FGFR2, амплификации гена FGFR2 или мутации в FGFR1, FGFR2 и FGFR3) (таблица 3). Футибатиниб, необратимый и высокоселективный ингибитор FGFR1, FGFR2, FGFR3 и FGFR4, исследуется в солидных опухолях с аберрациями FGF и/или FGFR [143] (таблица 3). AZD454 — пан-FGFR ИТК, который сравнивался с паклитакселом в исследовании II фазы SHINE [144] (таблица 2). Результаты не показали улучшения ВБП у пациентов с амплификациями FGFR2.
Клаудин 18.2
Клаудины (CLDN) представляют собой белки, которые поддерживают межклеточную адгезию в плотных соединениях. CLDN18.2 присутствует в дифференцированных эпителиальных клетках слизистой оболочки желудка [145], а золбетуксимаб представляет собой химерное антитело IgG1, нацеленное на CLDN18.2. В рандомизированном исследовании II фазы FAST, в котором приняли участие 334 пациента с CLDN18.2-положительными опухолями желудка, добавление золбетуксимаба к химиотерапии улучшило ВБП и общую выживаемость по сравнению с химиотерапией первой линии [146] (таблица 2). Кроме того, польза была выше в подгруппе пациентов с более высокой экспрессией CLDN18.2 — в ≥ 70% опухолевых клеток. Таким образом, в настоящее время в двух испытаниях фазы III проверяют добавление золбетуксимаба к химиотерапии первой линии у популяции с высокой экспрессией CLDN18.2 [147, 148] (таблица 3).
Оцениваются и новые препараты, направленные против CLDN18.2. Например, Т-клетка с химерным антигенным рецептором, специфичным для CLDN18.2, под названием CT041, была предложена в качестве эффективной терапии, а промежуточный анализ продолжающейся фазы I клинических испытаний [149] оценивает ее активность у пациентов с раком пищеварительной системы после более ранней терапии; сообщается о положительных результатах [150]. В частности, у 28 пациентов с CLDN18.2-положительным раком желудка частота ответов составила 57,1%. В настоящее время проводятся другие клинические испытания [151–153]. Кроме того, оценивается привлекающий Т-клетки биспецифический активатор, предназначенный для взаимодействия CD3-позитивных иммунных клеток с CLDN18.2-позитивными опухолевыми клетками [154] (таблица 3).
Цели исследования и будущие подходы
Наряду с ранее упомянутым историческим молекулярным подходом к лечению рака желудка, текущие направления связаны с теми же сигнальными путями (то есть с уже признанной HER2-положительной и PDL1-положительной популяцией), а также с другими, которые ранее были представлены с обнадеживающими предварительными данными и в основном фокусируются на FGFR2 и CLDN18.2 (таблица 2).
Усилия по определению более эффективных стратегий лечения рака желудка должны включать новые клинические испытания, которые избегают причин неудач, описанных выше, а именно отсутствия соответствующего выбора биомаркеров, неоптимального дизайна исследований и пространственной и временной гетерогенности рака желудка. Кроме того, учитывая слабость здоровья пациентов с раком желудка и агрессивность этого типа опухоли, правильный подход к ведению этих пациентов включает не только молекулярные соображения, но и надлежащую оценку каждого пациента с целостной индивидуальной точки зрения. Пациенты с раком желудка хрупки и имеют симптомы, связанные с опухолью, и различные сопутствующие заболевания, ассоциированные с возрастом. Таким образом, решения о лечении должны быть динамичными, приниматься быстро и в основном поддерживаться тщательным клиническим и рентгенологическим мониторингом, а также последовательной терапией дополнительными линиями, которые положительно коррелируют с улучшением выживаемости [28, 155].
Хотя в большинстве клинических подходов обычно тестируют индивидуальные молекулярные изменения, сосредоточение внимания на терапии с одной мишенью и технологиях секвенирования может способствовать созданию мультиплексного подхода, определяющего наилучший персонализированный и стратегический алгоритм лечения. Примерами исследований, в которых секвенировали опухоли или циркулирующую ДНК опухоли (цоДНК) с момента начала заболевания, являются испытания VIKTORY [156] и PANGEA [31].
Исследование VIKTORY [156] было зонтичным испытанием, проведенным в Южной Корее. Из 715 пациентов с метастатическим раком желудка с секвенированной опухолью 460 пациентов были включены в одно из десяти молекулярно-ориентированных клинических испытаний II фазы для лечения второй линии в зависимости от восьми различных биомаркеров опухоли (аберрации RAS, мутации TP53, мутации PIK3CA и/или амплификации, амплификации MET и гиперэкспрессии, TSC2-ноль / амплификациии RICTOR или отрицательные по всем маркерам). Первичной конечной точкой была ОЧО; при ОЧО 20% для паклитаксела второй линии в экспериментальных группах воздействие считалось эффективным, если комбинация приводила к ОЧО ≥ 50%. Первичная конечная точка была достигнута только у тех пациентов с аберрациями МЕТ, которые получали саволитиниб (низкомолекулярный ингибитор МЕТ) с доцетакселом или без него. Тем не менее, у всех пациентов, получавших терапию, выбранную с помощью биомаркеров, наблюдалась более длительная ВБП и общая выживаемость по сравнению с теми, кто получал традиционное лечение (ВБП 5,7 месяца по сравнению с 3,8 месяца [P < 0,0001] и медиана общей выживаемости 9,8 месяца по сравнению с 6,9 месяца [P < 0,0001]). Эти результаты демонстрируют потенциальную осуществимость и эффективность стратегии терапевтического выбора на основе биомаркеров. В исследовании PANGEA [31[ был предложен более сложный дизайн с учетом первых трех линий лечения. В этом испытании 80 пациентов получали оптимальную последовательность химиотерапии плюс различные моноклональные антитела в зависимости от молекулярных результатов. Молекулярные пути-мишени включали HER2, MET, FGFR2, EGFR, PD1 и VEGFR2 у пациентов с опухолями, содержащими амплификации HER2, амплификации MET, амплификации FGFR2, амплификации EGFR, биомаркеры для ICI (то есть у пациентов с MSI, EBV-позитивными опухолями) и с КПП ≥ 10 и TMB ≥15 mut/Mb), и изменениями MAPK и/или PIK3CA или у отрицательных по всем маркерам, соответственно. У 35% пациентов наблюдалась геномная дискордантность между первичными и метастатическими опухолями. Таким образом, лечение было выбрано на основе геномного профиля метастатических поражений. Интересно, что опухолевые изменения после первой и второй таргетной линии терапии были выявлены у 50% получавших лечение пациентов. Из 68 пациентов, поддающихся оценке эффективности лечения, 66% были живы в течение одного года (односторонний P = 0,0024, с нулевой гипотезой 50% выживаемости через один год). Достигнув своей основной конечной точки, это исследование еще раз подтвердило пространственную и временную гетерогенность рака желудка и демонстрирует осуществимость и эффективность молекулярных подходов к терапии рака у этой группы пациентов.
Наконец, в рамках общенациональной платформы геномного скрининга рака желудочно-кишечного тракта начальная инициатива GI-SCREEN в Японии [157] продемонстрировала пользу широкомасштабного секвенирования путем сопоставления пациентов с различными клиническими испытаниями на основании индивидуальных опухолевых изменений, на которые можно направленно воздействовать, с участием 126 пациентов (из 5621 прошедших первичный скрининг). За этой стратегией позже последовало исследование GOZILA [158], в ходе которого было выполнено комплексное секвенирование цоДНК для быстрого скрининга пациентов с раком желудка на соответствие критериям включения в исследование (включено 60 пациентов из 1687, прошедших первичный скрининг). Такое массовое генотипирование на основе цоДНК выявило у этих пациентов редкие молекулярные изменения, на которые можно воздействовать, включая опухоли, содержащие слияния нейротрофической RTK1.
Результаты испытаний VIKTORY и PANGEA, наряду с GI-SCREEN и последующей инициативой GOZILA, дают разумное обоснование для использования секвенирования как ткани, так и цоДНК для диагностики рака желудка. Выявление изменений-мишеней в рутинной клинической практике ухода за пациентами поможет создать более точный и персонализированный алгоритм лечения и улучшить выживаемость при этом агрессивном заболевании (рис. 2). Кроме того, можно определять и потенциально лечить редкие изменения.
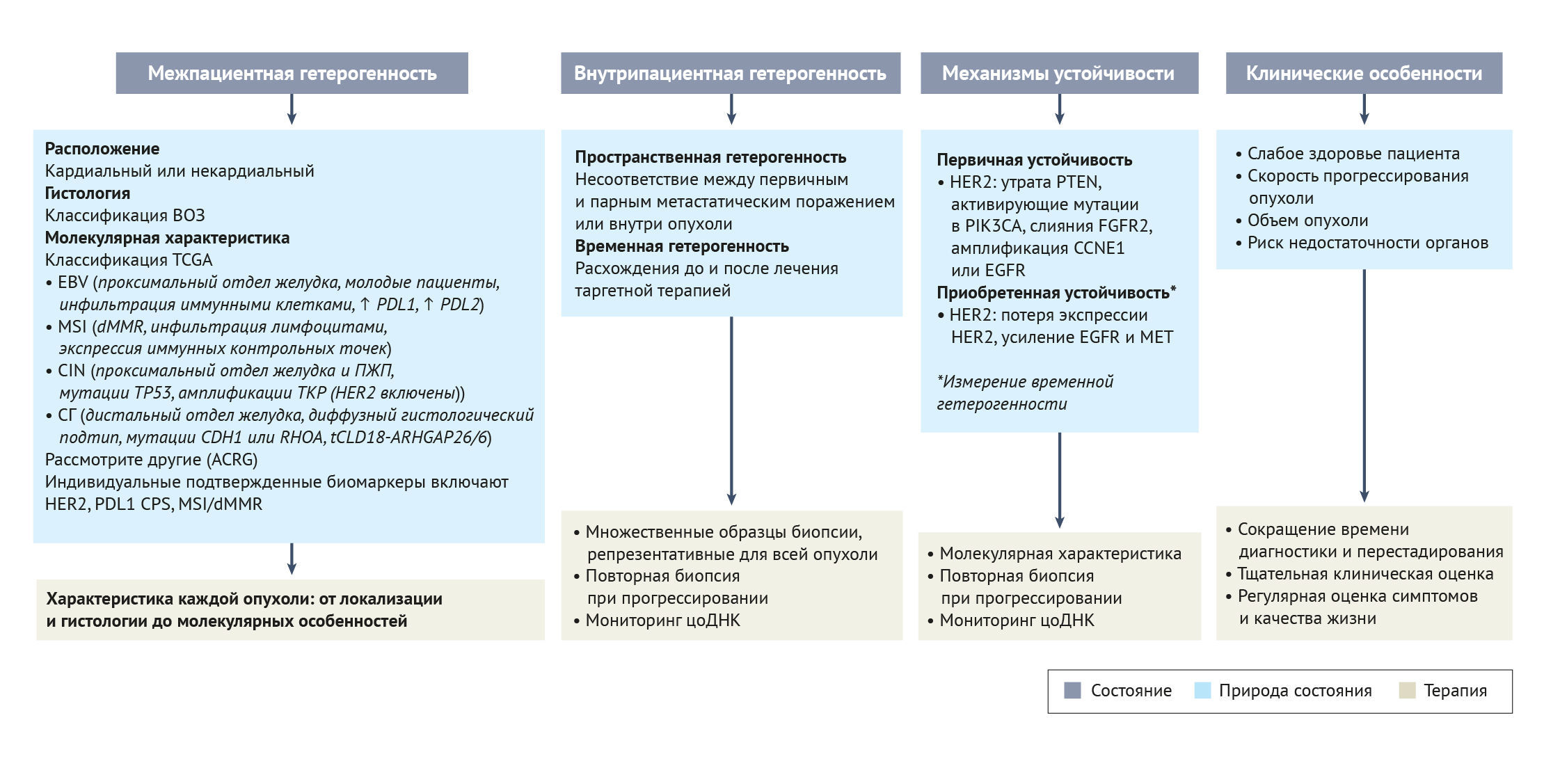
ACRG — Азиатская группа исследования рака; CCNE1 — клеточный фактор коммуникационной сети 1; CDH1 — кадгерин 1; CIN — хромосомная нестабильность; КПП — комбинированный показатель положительности; цоДНК — циркулирующая опухолевая ДНК; dMMR — дефицит репарации неправильно спаренных оснований; EGFR — рецептор эпидермального фактора роста; EBV — вирус Эпштейна–Барр; FGFR2 — рецептор фактора роста фибробластов 2; ПЖП — пищеводно-желудочный переход; СГ — со стабильным геномом; HER2 — рецептор эпидермального фактора роста человека 2; MET — протоонкоген MET; MSI — микросателлитная нестабильность; PTEN — фосфатаза и гомолог тензина; RHOA — член гомологического семейства Ras A; ТКР — тирозинкиназные рецепторы; TCGA — Атлас генома опухолей; tCLD18-ARHGAP26/6 — транслокация CLD18–ARHGAP26/6; TP53 — опухолевый белок p53.
Заключение
Являясь пятым злокачественным новообразованием по частоте диагностики и четвертой по значимости причиной смерти от онкологических заболеваний в мире [1], рак желудка представляет собой серьезную проблему здравоохранения. Несмотря на то, что исторически к нему относились как к единому заболеванию, это сложное состояние содержит очевидные эпидемиологические, гистологические и молекулярные различия, которые должны быть соответствующим образом всесторонне охарактеризованы [3].
HER2- и PDL1-КПП-положительные опухоли рака желудка считаются двумя разными распознаваемыми формами с уже установленными таргетными методами лечения [48–50], и в настоящее время изучаются другие новые комбинированные подходы. Другие предлагаемые стратегии сосредоточены на опухолях, несущих нарушения в различных путях RTK, таких как амплификация FGFR2 или экспрессия CLDN18.2 [159]. Кроме того, возможности персонализированной медицины в онкологии для пациентов с раком желудка расширяют более инклюзивные проекты и крупномасштабные программы секвенирования [31, 157].
Хотя рак желудка следует рассматривать как особое заболевание из-за присущего пациентам слабого здоровья и характерного для этого типа опухоли агрессивного поведения, молекулярную аппроксимацию следует делать на ранних стадиях заболевания и на протяжении всей его эволюции, принимая во внимание как пространственную, так и временную неоднородность опухоли в каждом отдельном индивидуализированном и персонифицированном алгоритме лечения (рис. 3). Объединение индивидуальных клинических и молекулярных данных от каждого пациента с раком желудка, безусловно, поможет создать оптимальные стратегии для персонифицированной терапии, что в конечном итоге улучшит общую выживаемость и качество жизни пациентов.
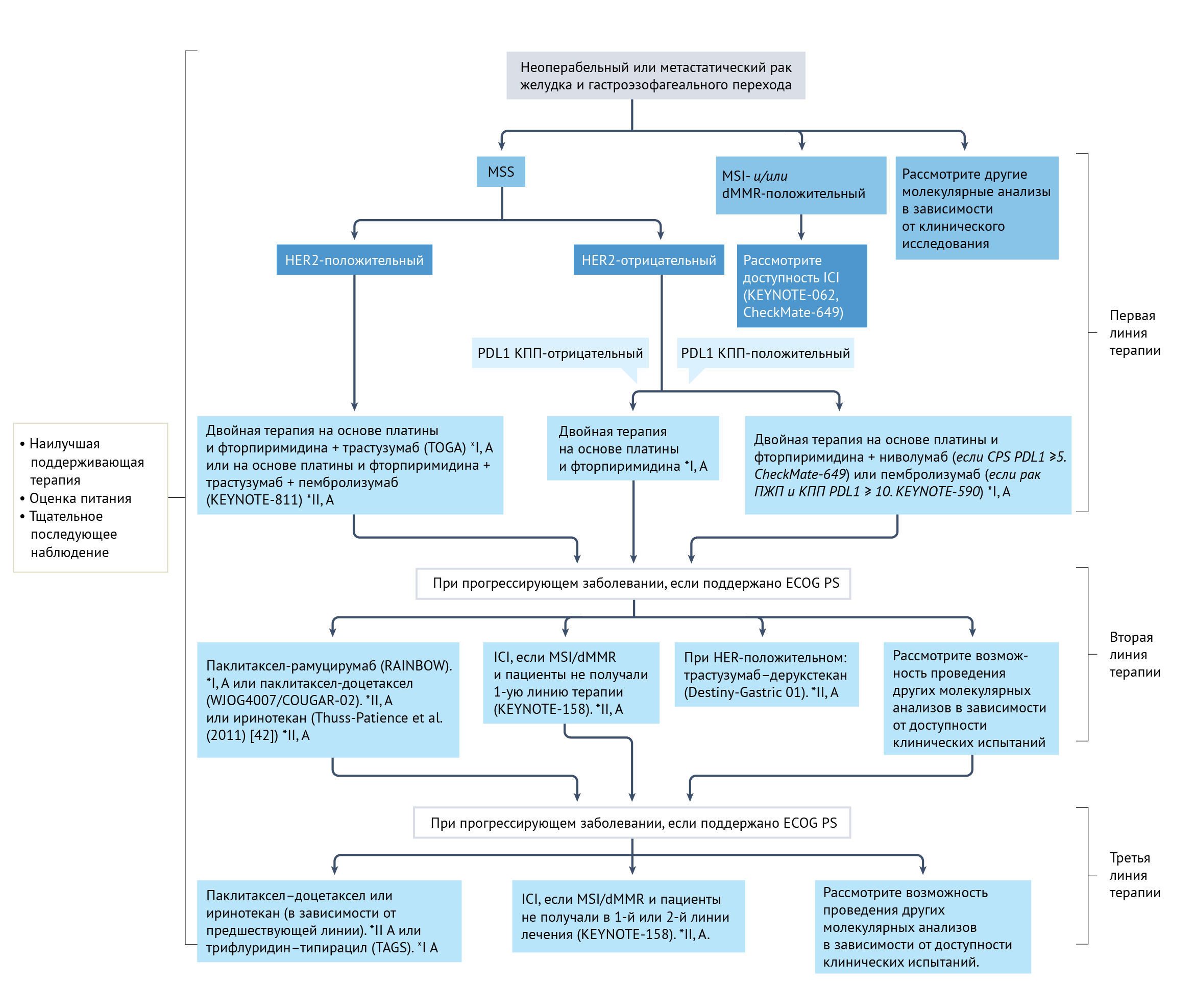
*I, A и *II, A. I, A и *II, A — уровни доказательности и степени рекомендаций, применяемые с использованием системы оценок Американского общества инфекционистов [160].
КПП — комбинированный показатель положительности; dMMR — дефицит репарации неспаренных оснований; ECOG PS — статус работы Восточной кооперативной онкологической группы; ПЖП — пищеводно-желудочный переход; HER2 — рецептор эпидермального фактора роста человека; ICI — ингибитор иммунных контрольных точек; MSI — микросателлитная нестабильность; MSS — микросателлитная стабильность
