Все под контролем. Твоя MAPK
Митоген-активированные протеинкиназы (MAPK, mitogen-activated protein kinase) являются эволюционно консервативными (встречаются у классификационно различных организмов) мультифункциональными сигнальными молекулами, которые играют ключевую роль в преобразовании внеклеточных сигналов во внутриклеточные ответы. У млекопитающих было идентифицировано 14 генов MAP-киназы, которые определяют 7 (известных на сегодняшний день) различных путей MAP-киназы. Многообразие эффектов поражает: они контролируют большое количество фундаментальных клеточных процессов, включая рост, пролиферацию, дифференцировку, движение, стрессовую реакцию, механизмы выживания и апоптоз [1].
Каждый каскад состоит из трех основных киназ (MAP3K, MAPKK и MAPK), а также часто вовлекает дополнительные восходящие (MAP4K) и нисходящие (MAPKAPK) компоненты. Внутри каждого из каскадов сигнал распространяется посредством последовательного фосфорилирования и активации киназ, что в конечном итоге приводит к фосфорилированию целевых регуляторных белков с помощью компонентов MAPK и MAPKAPK.
В настоящее время наиболее изучены четыре различных MAPK-каскада млекопитающих: внеклеточная регулируемая сигналами киназа 1 и 2 (ERK1/2), c-Jun N-терминальная киназа (JNK), p38 и ERK5. Также были идентифицированы другие киназы, которые имеют сходство последовательностей с компонентами перечисленных каскадов MAPK (например, ERK3/4 и ERK7/8).
Каскад ERK1/2 был первым изученным путем MAPK и рассматривается как прототип других киназных каскадов. Он играет центральную роль в передаче сигналов от широкого спектра внеклеточных агентов, которые действуют через различные рецепторы. В большинстве случаев активация таких рецепторов передается несколькими механизмами на небольшую GTPase Ras на плазматических мембранах. В свою очередь, активированный Ras рекрутирует компоненты MAP3K каскада (в основном Raf-1 и B-Raf; Rafs) на плазматическую мембрану, чем вызывает их активацию (рис. 1). После стимуляции ERK1/2, а также компонентов MAPKAPK, фосфорилируются сотни субстратов, ответственных в основном за пролиферацию и дифференцировку, а также морфологию и пластичность нейронов, контроль стрессового ответа и регуляцию апоптоза [2]. При нарушении регуляции этот каскад играет важную роль при различных патологиях: нейродегенеративные заболевания, пороки развития, сахарный диабет и опухолевый рост [3].
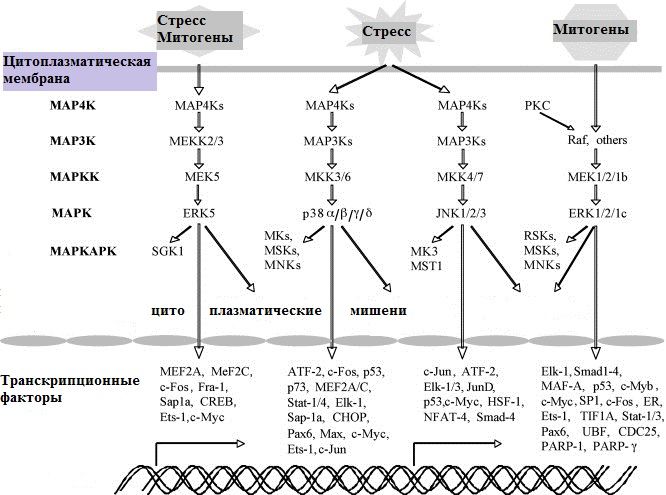
Рисунок 1 | МАРК-сигнальные каскады. Выделены основные стимулирующие факторы, также могут быть множественные дополнительные факторы в различных сочетаниях (суммация).
JNK-каскад был первоначально идентифицирован как регулятор транскрипционного фактора c-Jun и медиатор внутри- или внеклеточного стрессового ответа (стресс-активируемый протеинкиназный (SAPKs) каскад) [4] . Однако, как и остальные MAPK, позже было показано, что он также стимулируется большим количеством стресс-независимых стимулов и рецепторов, включая митогены. Активация происходит путем небольших GTPases (CDC42 и Rac1), которые активируют киназы MAP3K либо напрямую, либо через MAP4K. MAP3K и MAP4K каскады могут быть непосредственно активированы также путем взаимодействия с адапторными белками, такими как TRAF. После активации на уровне MAP3K сигнал идет дальше, фосфорилируя остатки Thr и Ser в петле активации, тем самым активируя киназы уровня MAPKK (MKK4 и MKK7). В свою очередь, эти киназы активируют три компонента на уровне MAPK (JNK1–3; 46 и 54 кДа; JNKs) путем прямого фосфорилирования остатков Tyr и Thr в мотиве Thr-Pro-Tyr их петли активации. Активированные JNKs MAPKAPK фосфорилируют большое количество субстратов (в основном, в ядре, меньшая часть — в цитоплазме). Так происходит контроль апоптоза, иммунного ответа, активности передачи нервного импульса, эффектов инсулина и многое другое. JNKs играют роль в развитии нейродегенеративных заболеваний, включая болезнь Альцгеймера, Паркинсона, боковой амиотрофический склероз и лиссэнцефалию. Также упоминается сахарный диабет, онкопатология [5].
Каскад p38 активируется главным образом на стрессовые сигналы. Эффекторные молекулы аналогичны функционирующим в каскаде JNK. Различия в активации этих двух каскадов опосредованы специфическими каркасными белками, компартментализацией и вариабельными субстратами. Помимо своей роли в реакции на стресс, р38 играют центральную роль в регуляции иммунологических эффектов, апоптоза, клеточного старения, контрольных точек клеточного цикла и регуляции выживания клетки. Это определяет его роль в индукции воспаления, заболеваниях иммунной системы, в том числе аутоиммунных. Кроме того, р38 играет роль в патогенезе сердечно-сосудистых заболеваний: ингибирование его активности оказывает кардиопротекторный эффект. Менее изучен каскад ERK5, который может действовать как фактор транскрипции, что позволяет индуцировать и регулировать пролиферацию, ангиогенез, иммунологические реакции, стрессовый ответ [6].
В ядре клетки МАРК участвуют в регуляции ремоделирования хроматина, что важно для связывания факторов транскрипции с соответствующими промоторами, контролируют ядерную локализацию регуляторных белков, индуцируют ядерно-зависимые точки рестрикции клеточного цикла и модулируют активность ядерных рецепторов.
Источники:
1. Flores K, Yadav SS, Katz AA, Seger R. The Nuclear Translocation of Mitogen-Activated Protein Kinases: Molecular Mechanisms and Use as Novel Therapeutic Target. Neuroendocrinology. 2019;108(2):121-131.
2. Plotnikov A, Flores K, Maik-Rachline G, Zehorai E, Kapri-Pardes E, Berti DA, et al. The nuclear translocation of ERK1/2 as an anticancer target. Nat Commun. 2015 Mar;6(1):6685.
3. Moens U, Kostenko S. Structure and function of MK5/PRAK: the loner among the mitogen-activated protein kinase-activated protein kinases. Biol Chem. 2013 Sep;394(9):1115-32.
4. Morrison DK. MAP kinase pathways. Cold Spring Harb Perspect Biol. ;4(11):a011254.
5. Maik-Rachline G, Zehorai E, Hanoch T, Blenis J, Seger R. The nuclear translocation of the kinases p38 and JNK promotes inflammation-induced cancer. Sci Signal. 2018 Apr 10;11(525).
6. Brenan L, Andreev A, Cohen O, Pantel S, Kamburov A, Cacchiarelli D, et al. Phenotypic Characterization of a Comprehensive Set of MAPK1/ERK2 Missense Mutants. Cell Reports. 2016 Oct;17(4):1171–83.
