Транспортные процессы между ядром и цитоплазмой
Когда речь заходит о различиях между про- и эукариотическими клетками, то первым, что можно услышать в ответ, будет замечание о том, что эукариоты обладают ограниченным мембранами ядром, тогда как прокариоты являются безъядерными. И хотя у про- и эукариотов еще множество иных отличий, тем не менее основным признаком, по которому эти организмы делят на два домена, является именно наличие либо отсутствие ядра, что указывает на фундаментальное значение этого органоида. Ядро представляет собой не просто один из многих компартментов внутри клетки, но берет на себя функции основного регулятора ее жизнедеятельности.
Чтобы понять, как же ядро исполняет возложенные на него обязанности, и почему его наличие настолько преображает внутриклеточные процессы, обратимся к его устройству. Ядерная оболочка состоит из двух концентрических фосфолипидных мембран — наружной и внутренней, — удаленных друг от друга на 30 нм (рис. 1).

Рисунок 1 | Ядерная оболочка, цитоплазматическая сторона (атомно-силовая микроскопия).
Надо сказать, такая двухслойная оболочка представляет собой куда более серьезный барьер, чем одинарная цитоплазматическая мембрана, окружающая клетку. Наружная мембрана ядерной оболочки неразрывно связана с лабиринтами ЭПР, а внутренняя мембрана — с сетью промежуточных филаментов, которая сформирована белком ламином и называется ядерной пластинкой, служащей местом прикрепления хромосом. Как и любой другой мембранный компонент, ядерная оболочка обладает избирательной проницаемостью, что необходимо для контролируемого перемещения различных соединений между ядром и цитоплазмой. Такое свойство ядерной оболочке обеспечивают белковые комплексы нуклеопоринов, представляющих собой ядерные поры (nuclear pore complex, NPC), которые в огромном количестве (от двух до пяти тысяч в клетках позвоночных) испещряют мембраны, окружающие ядро (рис. 2).
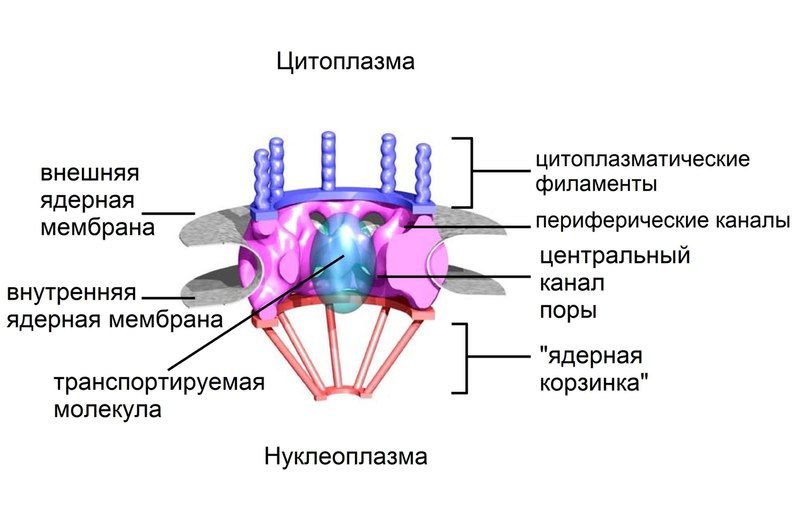
Рисунок 2 | Схематичная структура NPC.
В состав одного комплекса ядерной поры входят различные виды нуклеопоринов (коих около 30-ти), скомпонованных в субкомплексы, каждый из которых представлен несколькими копиями, в результате чего полностью собранный NPC включает в себя от 500 до 1000 отдельных белков. NPC соединяют наружную и внутреннюю мембраны оболочки ядра, формируя при этом водные каналы. Благодаря методам криоэлектронной микроскопии и томографии стало возможным внимательное рассмотрение структуры ядерных пор: центральный канал каждой поры окружен тремя последовательно уходящими вглубь кольцевыми структурами, к которым как со стороны цитоплазмы, так и со стороны ядра прикрепляются белковые нити, что в совокупности по своему виду напоминает корзину (да собственно, так и называется — nuclear basket). Транспорт солей, нуклеотидов, небольших молекул и компонентов, требующихся для синтеза ДНК и РНК, осуществляется через NPC путем пассивной диффузии (рис. 3).
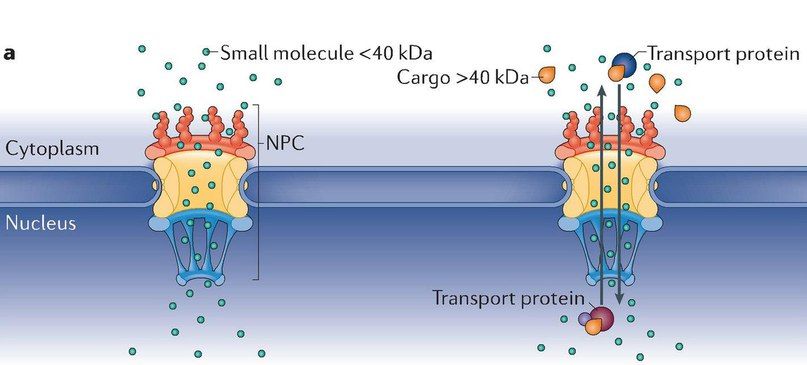
Для импорта в ядро крупных белков, размером крупнее 40–65 кДа, требуется участие транспортных рецепторов, которые чувствительны к сигналам, посылаемым транспортируемыми белками. Одним только созданием диффузионного барьера и контролем ядерно-цитоплазматического транспорта функции NPC не ограничиваются. Данные белковые комплексы задействованы также в таких ядерных процессах, как восстановление ДНК, клеточный цикл, организация хроматина, регуляция транскрипции, созревание РНК (рис. 4).
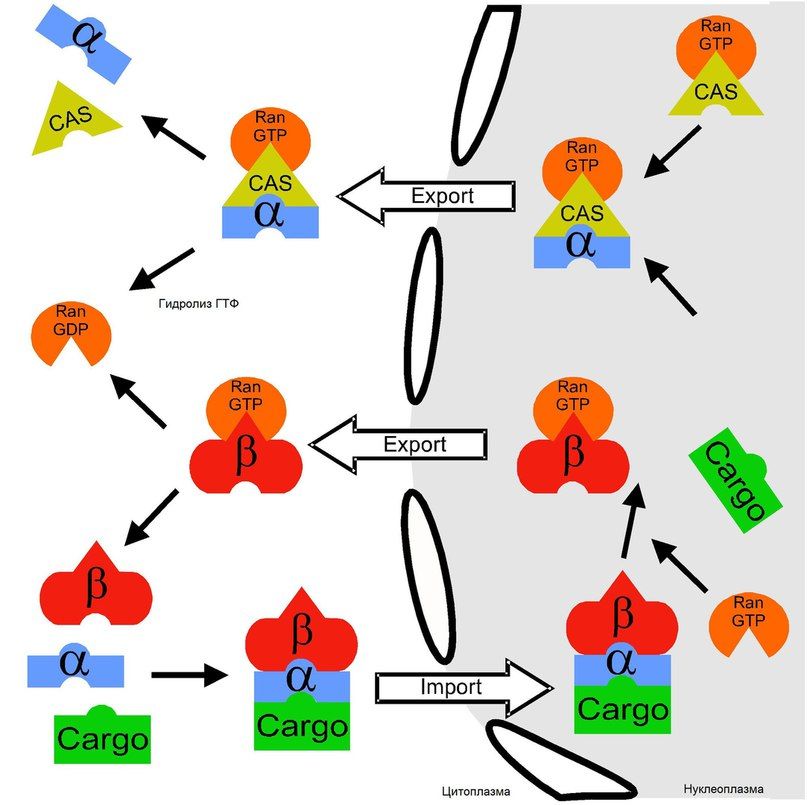
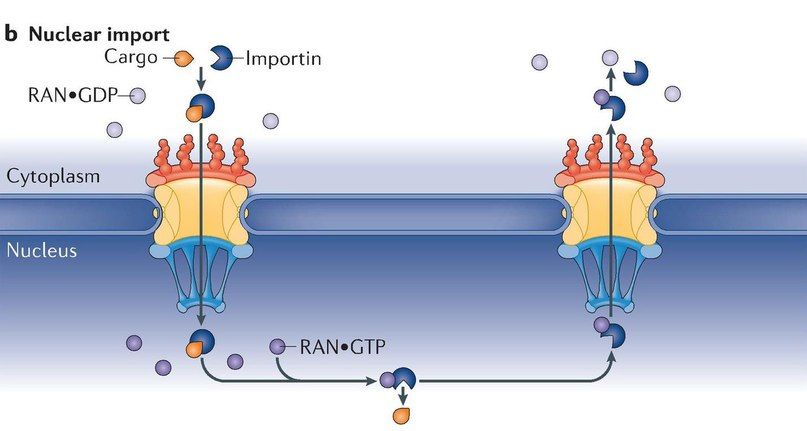
Рисунок 4 | Схематичное представление механизмов ядерно-цитоплазматического импорта и экспорта. Пояснения в тексте.
Обратимся более подробно к упомянутым сигналам, необходимым для переноса крупных белков в ядро или из него. Растворимые транспортные рецепторы семейства кариоферинов распознают в структуре белков специфические аминокислотные последовательности, к которым относятся сигнал ядерной локализации (NLS) и сигнал ядерного экспорта (NES). Распознав нужный участок (типичным признаком NLS является повторение нескольких положительно заряженных аминокислот — лизин, аргинин), транспортные рецепторы либо связываются с ним напрямую, либо с помощью адапторных молекул, в результате чего запускается процесс транслокационных изменений.
Передача сигнала может происходить путем различных механизмов, которые классифицируют по функциональным особенностям NLS.
Например, первыми описанными сигнальными последовательностями были короткие, богатые лизином участки, которые впоследствии стали относить к классическим NLS. Такие NLS связывают домен ARM на С-терминальном конце импортина-α, выполняющего роль адапторного белка, а он, в свою очередь, связывает транспортный рецептор импортин-β, взаимодействуя с доменом αIBB на его N-терминальном конце, то есть, формируется трехкомпонентный комплекс, включающий в себя перемещаемый белок, адаптор и транспортный рецептор. В противоположность данному типу NLS, неклассические NLS связываются с транспортным рецептором без участия адапторных молекул. Например, к белкам, непосредственно распознаваемым импортином-β, относятся рибосомальные белки, транскрипционный фактор CREB, вирусные белки Rev и Tat вируса иммунодефицита человека, SREBP-2, белок Rex Т-лимфотропного вируса человека 1-го типа, циклин В1, Smad3 и т. д.
Теперь, когда с сигнальными последовательностями относительно разобрались, встает вопрос: «А что же с рецепторами?».
У них также имеются важные структурные особенности, обеспечивающие взаимодействие с белками и их перенос. В частности, рецепторы ядерного транспорта, постоянно перемещающиеся между ядром и цитоплазмой, в большинстве своем относятся к семейству β-кариоферина, каждый представитель которого «узнает» специфичную для него группу белков или РНК.
Характерным признаком членов данного семейства рецепторных белков является наличие многоповторных HEAT-мотивов, сформированных двумя антипараллельными амфифильными спиралями, соединенными линкерной областью. Именно эти структуры ответственны за узнавание транспортируемых белков, опосредованное ГТФазой Ran, а также за высвобождение белков после переноса. Таким образом, ГТФаза Ran и белок, который необходимо протащить через ядерную пору, связываются с суперспиралью рецептора изнутри, а нуклеопорины связываются с рецепторами через FG-мотивы снаружи, и таким образом, путем многократных последовательных связываний и разобщений NPC с рецептором белок транспортируется через пору. Кроме того, важно, чтобы комплексы ядерных пор поддерживали гидрофобное микроокружение, поскольку это критично для рецептор-опосредованного транспорта.
По данным кристаллографического анализа комплекса FG-мотива импортина-β, данный рецептор обладает несколькими гидрофобными карманами на выпуклой поверхности, которые предназначены для взаимодействия с гидрофобными остатками FG-Nup (встречаются в составе нуклеопоринов, составляющих комплексы ядерных пор). Отсюда также следует, что помимо размера белка его гидрофобность тесно связана с его способностью проходить через ядерные поры. Однако сильная поверхностная гидрофобность и сильные связи с нуклеопоринами не объясняют в полной мере скорость перемещения белка через NPC, поскольку гидрофобные белки застревают в NPC на некоторое время и не так-то легко высвобождаются в цито-/нуклеоплазму.
При импорте какого-либо белка со стороны ядра к транспортному комплексу присоединяется уже неоднократно упоминаемая ГТФаза Ran, что необходимо для диссоциации импортина-β и высвобождения переносимого субстрата в кариолимфу (рис. 5, 6).
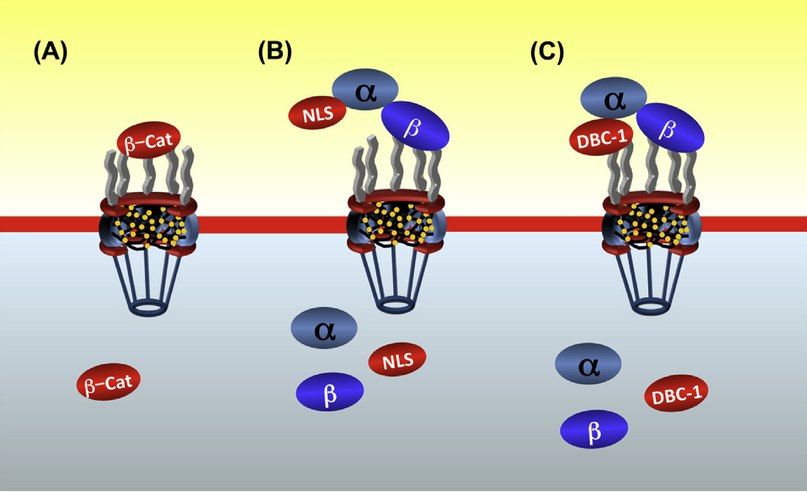
В — классический рецептор-зависимый импорт транспортируемой молекулы с образованием комплекса с α- и β-импортинами.
С — особый способ, характерный для некоторых типов белковых молекул, когда возможно взаимодействие как с нуклеопоринами без посредников, так и с участием импортинов.
Ran представляет собой гуаниннуклеотидсвязывающий белок, который может находиться в форме Ran-ГТФ или Ran-ГДФ, в зависимости от того, в каком компартменте клетки он находится. Внутри ядра белок Ran-GEF (фактор обмена гуаниновых нуклеотидов) заботится о том, чтобы Ran оставался связанным с ГТФ. После диссоциации импортинов (как α, так и β) каждый из них своим путем возвращается назад в цитоплазму, чтобы снова участвовать в импорте белков. Импортин-α экспортируется в цитоплазму по Ran-зависимому механизму с помощью рецепторов CAS (cellular apoptosis susceptibility — клеточной чувствительности к апоптозу). Импортин-β выносится из ядра в комплексе с ГТФазой Ran, что препятствует его повторному связыванию с импортином-α в ядре.
Перешедшая таким образом в цитоплазму ГТФаза Ran в комплексе с импортином-β связывается ГТФаза-активирующим белком (GAP), и буквально в следующее мгновение ГТФ гидролизуется до ГДФ. После гидролиза импортин и Ran-ГДФ диссоциируют на отдельные компоненты, и импортин готов для следующего цикла импорта белков внутрь ядра. А Ran-ГДФ, в свою очередь, доставляется назад транспортным фактором NTF-2 (не относится к семейству импортина-β), который специфичен для Ran. В ядре Ran снова принимает форму ГТФ-связанного белка и готовится выполнять свои функции как в качестве помощника для высвобождения транспортируемого белка при импорте в ядро, так и для формирования транспортного комплекса при экспорте белковых молекул из ядра.
Кроме того, существует путь транспорта между ядром и цитоплазмой, для которого участие транспортных рецепторов, таких как импортин-β, не является ключевым моментом. В этом случае перемещаемый белок связывается напрямую с белками NPC (такой транспорт описан, например, для белка Vpr ВИЧ), катализируя свой перенос самостоятельно, без участия каких-либо растворимых факторов.
Через каждую пору ядерной мембраны возможен как импорт, так и экспорт белков (рис. 7).
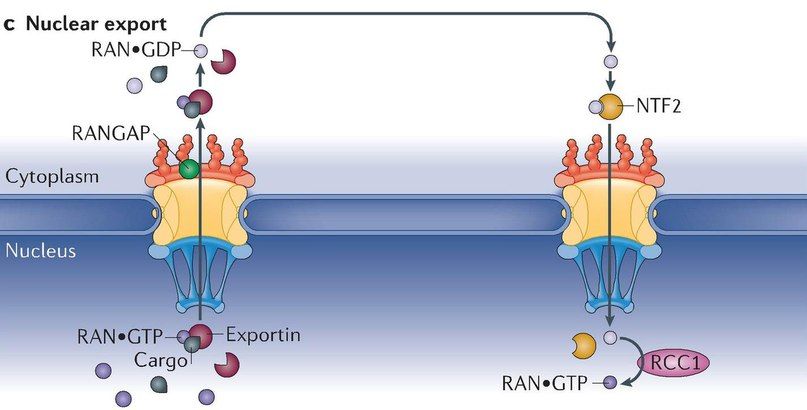
Как уже было сказано выше, размер транспортируемого белка не является единственной детерминантой, предполагающей активный или пассивный транспорт. В том числе это подтверждается тем, что хотя крупные белки и не могут диффундировать через ядерные поры, тем не менее далеко не все небольшие молекулы свободно проникают через ядерную оболочку, напротив, многие из них все равно транспортируются по механизму активного транспорта, т. к. этот процесс подвержен более строгой регуляции.
Например, активный транспорт предполагает вовлечение определенных сигнальных путей, тогда как в отсутствие сигнала нуклеопорины не проявляют аффинных свойств к субстратам. В то же время, мнение ученых о механизмах пассивного транспорта разнятся. Одни придерживаются представления о том, что по краю NPC, вокруг центрального канала поры, располагается восемь маленьких каналов, через которые небольшие молекулы и ионы беспрепятственно диффундируют внутрь ядра (рис. 3).
Другие ученые предполагают, что существует все же только один канал, по которому осуществляется как диффузия, так и активный транспорт. Долгое время считалось, что пассивный транспорт никак не регулируется, кроме как размером пропускного канала, однако позже была выяснена зависимость пропускной способности NPC от концентрации ионов кальция в просвете ядерных пор, что дает возможность для управления и пассивным транспортом молекул.
Источники:
- Dickmanns A., Kehlenbach R. H., Fahrenkrog B. Nuclear pore complexes and nucleocytoplasmic transport: from structure to function to disease //International review of cell and molecular biology. – Academic Press, 2015. – Т. 320. – С. 171-233.
- Milles S. et al. Plasticity of an ultrafast interaction between nucleoporins and nuclear transport receptors //Cell. – 2015. – Т. 163. – №. 3. – С. 734-745.
- Cautain B. et al. Components and regulation of nuclear transport processes //The FEBS journal. – 2015. – Т. 282. – №. 3. – С. 445-462.
- Yoshimura S. H., Kumeta M., Takeyasu K. Structural mechanism of nuclear transport mediated by importin β and flexible amphiphilic proteins //Structure. – 2014. – Т. 22. – №. 12. – С. 1699-1710.
- Raices M., D'angelo M. A. Nuclear pore complex composition: a new regulator of tissue-specific and developmental functions //Nature reviews Molecular cell biology. – 2012. – Т. 13. – №. 11. – С. 687.
- Monecke T. et al. Crystal structure of the nuclear export receptor CRM1 in complex with Snurportin1 and RanGTP //Science. – 2009. – Т. 324. – №. 5930. – С. 1087-1091.
