Роль BCAA в энергетическом гомеостазе

Аминокислоты с разветвленной цепью (BCAA — комплекс из трех незаменимых аминокислот: валина, лейцина и изолейцина) знакомы фанатам спортивного питания и оправданы при высоком уровне расхода энергии и для улучшения роста мышечной ткани. Однако эпидемиологические исследования указывают на опасность повышенных уровней BCAA в крови, что ассоциировано с ожирением, инсулинорезистентностью и развитием сахарного диабета 2 типа [1]. Одним из механизмов этого парадокса стал метаболизм ВСАА в бурой жировой ткани.
Бурая жировая ткань является важным термогенным органом, превращаясь в зону активного метаболизма при потребности организма в генерировании тепла.
У взрослых людей она представлена в небольшом количестве (несколько грамм) в области шеи, ключиц, почек и спинного мозга. Также термогенной активностью обладают «бежевые» адипоциты, расположенные в белой жировой ткани. Исследования с использованием позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) с 18F-фтордезоксиглюкозой (18F-ФДГ) и метками жирных кислот продемонстрировали также участие бурой жировой ткани в метаболизме глюкозы и жирных кислот. В условиях холодовой акклиматизации, при повышении уровня норадреналина стимулируются окисление глюкозы и липолиз, что приводит к значительному увеличению уровня циркулирующих неэтерифицированных (свободных) жирных кислот, тем самым способствуя улучшению системного липидного обмена [2]. Бурые адипоциты содержат большое количество митохондрий с хорошо развитой системой крист. Именно митохондриальные цитохромы обеспечивают темный оттенок клеток. Зрелые бурые адипоциты мельче белых, имеют неправильную форму, в цитоплазме — не одна крупная, а несколько мелких жировых капель [3]. Отличительным свойством их метаболической активности является разобщение окислительного фосфорилирования и дыхания. При окислении протонный градиент, существующий в норме на внутренней мембране митохондрий, отсутствует; работа АТФ-синтазы становится невозможной. Перенос протонов через мембрану осуществляет белок термогенин или разобщающий белок 1 (Uncoupling Protein 1, UCP1). В результате большая часть энергии рассеивается в виде тепла и меньшая запасается в АТФ [4].
В условиях охлаждения клетки бурой жировой ткани активно используют BCAA в митохондриях для термогенеза, выступая в качестве «метаболического фильтра» этих соединений. Соответственно, эффективность метаболизма ВСАА зависит от количества и активности бурых адипоцитов в организме. Подтверждение этому было обнаружено в ходе исследования группы ученых Т. Енесиро из Калифорнийского университета (Сан-Франциско). У группы испытуемых с нормальной и высокой активностью бурого жира (уровень стандартизованного значения поглощения > 4,03) отмечалось значительное снижение уровня валина, лейцина и изолейцина в плазме крови после холодового воздействия. В качестве холодового триггера использовалась двухчасовая экспозиция 19оС, при которой запускается липолиз в жировой ткани без активации дрожания в скелетной мускулатуре. В группе с низкой активностью бурого жира (уровень стандартизованного значения поглощения ≤ 4,03) после аналогичного стимула уровень этих аминокислот снижался крайне незначительно или же вовсе не изменялся (рис.1) [5].
.
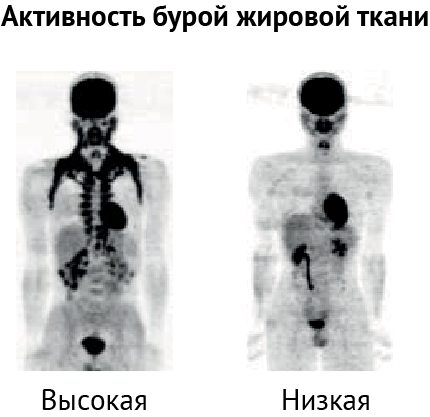
Механистически активный катаболизм BCAA в бурой жировой ткани обеспечивается белком SLC25A44. Он транспортирует BCAA в митохондрии. Снижение экспрессии этого транспортера нарушало клиренс ВСАА и изменяло морфологию бурых адипоцитов (рис. 2) [5].
.
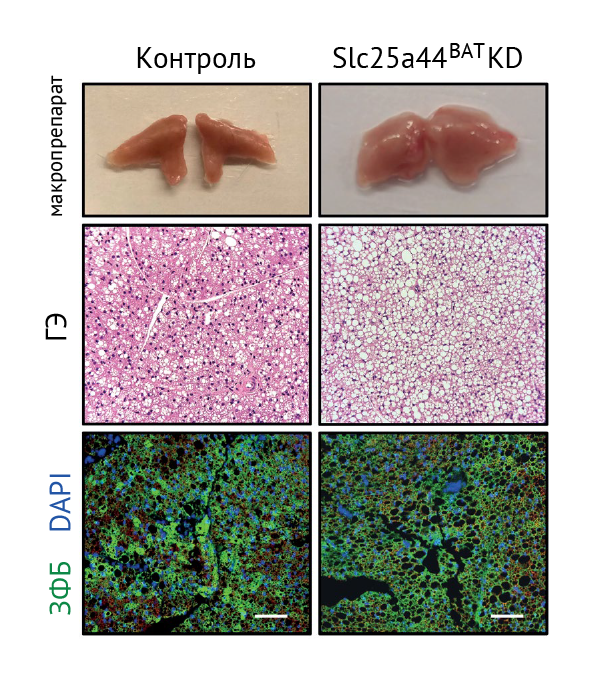
ГЭ – гематоксилин-эозин
ЗФБ – зеленый флуоресцентный белок
DAPI – 4’6’-диамино-2-фенилиндол, синий флуоресцентный краситель для окрашивания нуклеиновых кислот; используется для детекции нежизнеспособных клеток, так как для DAPI цитоплазматическая мембрана практически непроницаема, живые клетки остаются неокрашенными (негативными).
Расширение представлений о системном метаболизме BCAA (рис. 3) [5] при ожирении и сахарном диабете с пониманием роли нарушенной активности бурой жировой ткани и увеличенной циркуляции BCAA в крови могут предложить новые терапевтические мишени при этих патологиях. Рассматривается влияние недоокисленных промежуточных продуктов BCAA, таких как 3-гидроксиизобутират, на развитие инсулинорезистентности. Напротив, снижение уровня циркулирующих в крови BCAA способно увеличить толерантность к глюкозе при необходимости снижения массы тела. Это возможно воздействием на синтез вышеперечисленных аминокислот путем ингибирования киназы BDK или уменьшения избыточной экспрессии Mg2+/Mn2+ — зависимой митохондриальной протеинфосфатазы 1 типа (PPM1K) в печени.
.
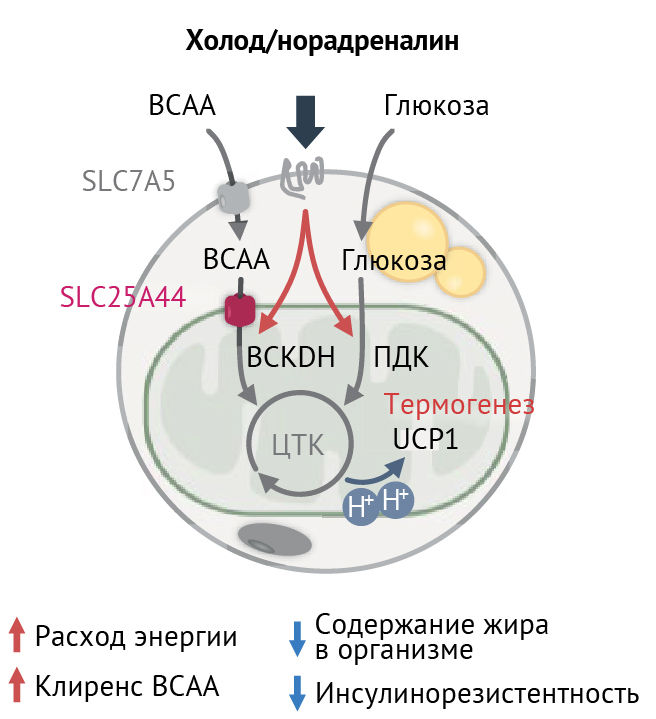
адипоцитов. Этот процесс способствует термогенезу. Для его осуществления необходим белок SLC25A44, митохондриальный транспортер BCAA [5].
SLC7A5-натрий-независимый транспортер аминокислот L-типа
BCKDH – кетокислотная дегидрогеназа с разветвленной цепью
ЦТК – цикл трикарбоновых кислот
ПДК – пируватдегидрогеназный комплекс
UCP1 – разобщающий белок, термогенин; формирует регулируемый канал обратного транспорта Н+ в матрикс
Уменьшение митохондриального окисления BCAA и их последующее внутриклеточное накопление приводит к активации передачи сигналов пути mTOR (мишень рапамицина у млекопитающих). Формируется внутриклеточный мультимолекулярный сигнальный комплекс mTORC1, который обеспечивает фосфорилирование остатков серина в молекуле субстрата инсулинового рецептора 1 (IRS-1) с его последующей протеасомной деградацией и ингибированием эффектов инсулина. Воздействие на ключевые точки этого сигнального каскада может быть использовано для регуляции инсулинорезистентности [6].
Усиление митохондриального катаболизма BCAA с использованием модулирования активности белка SLC25A44 может служить многообещающей стратегией для улучшения
системного клиренса этих аминокислот в терапии метаболического синдрома.
Источники:
- Neinast M. D. et al. Quantitative analysis of the whole-body metabolic fate of branched-chain amino acids. Cell Metab. 2019; 29: 417–429.
- Chondronikola M. et al. Brown adipose tissue activation is linked to distinct systemic effects on lipid metabolism in humans. Cell Metab. 2016;23:1200–1206.
- Shinoda K. et al. Genetic and functional characterization of clonally derived adult human brown adipocytes. Nat. Med.2015;21:389–394.
- Ouellet V. et al. Brown adipose tissue oxidative metabolism contributes to energy expenditure during acute cold exposure in humans. J. Clin. Invest. 2012;122:545–552.
- Yoneshiro T. et al. BCAA catabolism in brown fat controls energy homeostasis through SLC25A44.Nature.2019 [Epub ahead of print].
- Wallace M. et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues. Nat. Chem. Biol. 2-18; 14:1021–1031.
