Фруктоза в диетических добавках растягивает ворсинки кишечника и способствует усиленному усвоению жиров

Было обнаружено, что кормление мышей кукурузным сиропом с высоким содержанием фруктозы, широко используемым подсластителем в рационе человека, приводит к увеличению площади поверхности кишечника, что выражается в улучшении усвоения нутриентов и увеличении массы тела.
Заболеваемость ожирением неуклонно возрастает, за период с 1975 по 2016 год увеличившись в три раза во всем мире, что повышает затраты сферы общественного здравоохранения [1]. Ожирение является предрасполагающим фактором развития различных заболеваний, в том числе и злокачественных новообразований, а ежегодное количество летальных исходов, связанных с ожирением (оценивается в 2,8 миллиона), сходно по масштабам с числом смертельных исходов вследствие COVID-19 (в условиях продолжающейся пандемии) по всему миру [1]. Хотя в большей степени на рост заболеваемости ожирением влияет потребление продуктов, богатых жирами, на рост заболеваемости алиментарным ожирением в значительной степени влияет чрезмерное потребление рафинированного сахара и, в частности, кукурузного сиропа с высоким содержанием фруктозы (КСВСФ). Горячо обсуждается вопрос о том, вызывает ли фруктоза ожирение у людей и если да, то каким образом [2, 3]. В своей работе в «Nature» Тэйлор с соавт. [4] предлагают теорию, согласно которой КСВСФ способствует ожирению, повышая способность кишечника усваивать питательные вещества. Сообщение исследователей заставляет лишний раз дважды подумать, прежде чем употреблять подслащенные сахаром напитки с жирными закусками.
Появились доказательства [5–8] того, что тонкая кишка действует как «сторож» в организме млекопитающих, который следит за вредным влиянием употребления фруктозы, что проявляется в первую очередь в избыточном накоплении жира (т. н. стеатоз) в печени. При употреблении умеренного количества фруктозы, например, из фруктов, этот углевод усваивается и расщепляется клетками кишечника. Избыток фруктозы, возникающий, например, после употребления сладких напитков, подавляют абсорбционную способность кишечника, и фруктоза либо «просачивается» в кровоток, достигая здоровой печени, либо «выливается» из тонкой кишки, достигая толстой и прямой [5].
Разложение фруктозы в клетках начинается с ее превращения во фруктозо-1-фосфат (Ф-1-Ф). В ходе данного преобразования происходит перенос фосфатной группы на фруктозу от макроэргической молекулы АТФ; реакция осуществляется под действием фермента кетогексокиназы (KГK, печеночная фруктокиназа). Избыток фруктозы в печени способствует высокой активности KГK, которая, как полагают, стимулирует экспрессию генов синтеза липидов посредством различных механизмов [9]. Для предотвращения стеатоза печени вследствие избыточного потребления фруктозы достаточным становится снижение содержания фермента КГК в печени мышей [6].
При попадании в толстую кишку фруктоза расщепляется резидуальными бактериями с образованием молекул, необходимых для синтеза липидов в печени [7]. Помимо этого, фруктоза повышает «проницаемость» стенки кишечника (состояние, при котором вследствие ослабленных межклеточных связей между эпителиоцитами кишечника поглощенные человеком питательные вещества и бактериальные токсины в толстой кишке попадают в печень, где они активируют воспалительные сигнальные пути иммунных клеток, усиливающие стеатоз [8]). Следовательно, избыток фруктозы вредит печени как прямо, так и косвенно посредством функциональных и структурных изменений в кишечнике.
Тейлор с соавт. в своем исследовании показывают, что фруктоза оказывает неизвестное ранее влияние на структуру кишечника (рис. 1). В предыдущей работе [10] было показано, что употребление КСВСФ способствует функционированию метаболических путей, опосредующих образование опухолей в толстой кишке. Поэтому авторы задались вопросом, какими будут последствия рациона с избытком КСВСФ для здоровых (немалигнизированных) клеток кишечника. Тейлор с соавт. обнаружили более длинные выросты внутренней стенки кишечника у мышей, которых кормили КСВСФ; данные структуры, называемые кишечными ворсинками, поглощали больше пищевых питательных веществ по сравнению с ворсинками мышей, которых не кормили КСВСФ. Кроме того, диета, в которой сочеталось повышенное содержание жиров и фруктозы, вела к более значительному набору веса тела у мышей, чем если бы мышей держали всего лишь на диете, богатой жирами.
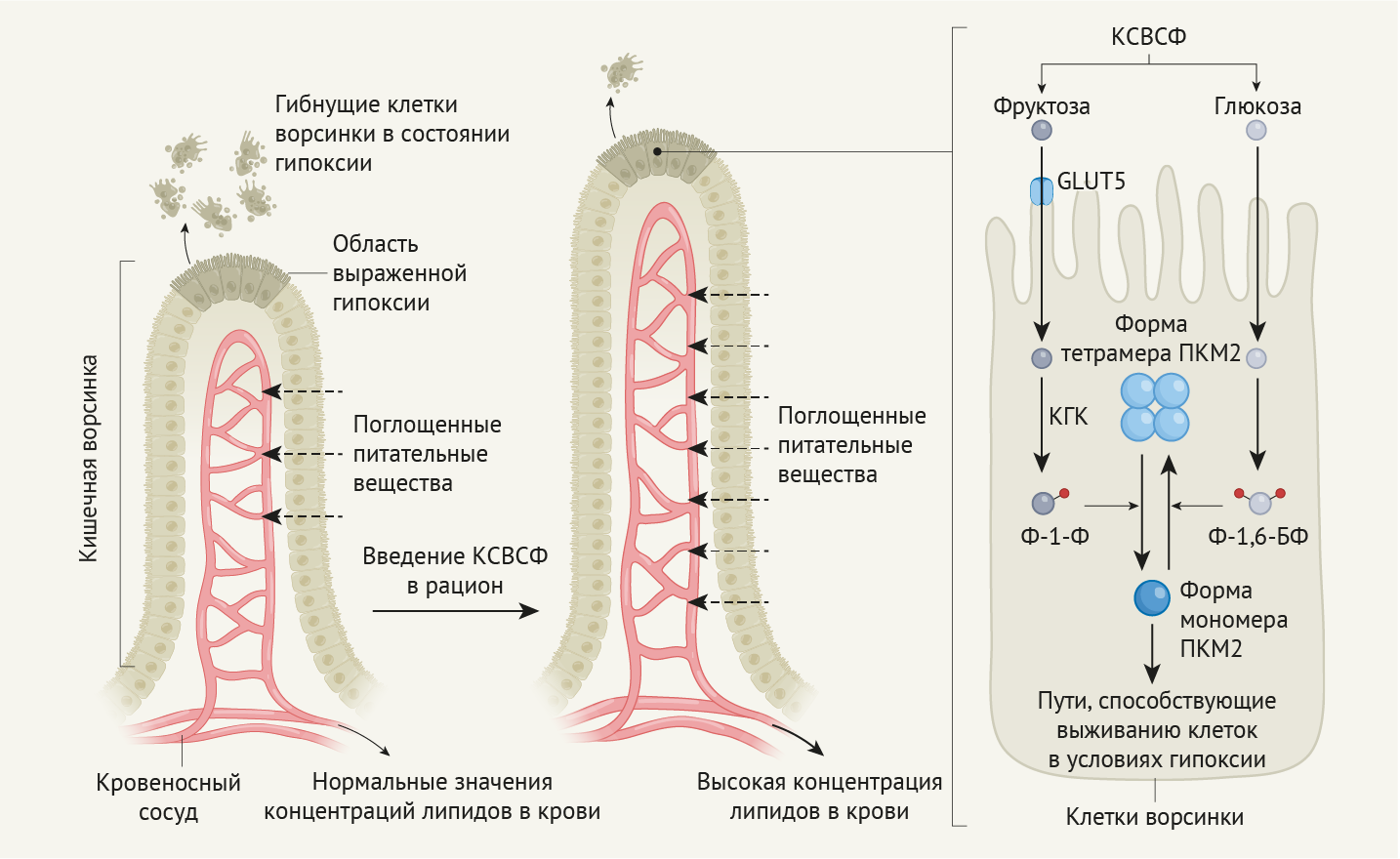
Кишечная ворсинка растет за счет деления кишечных эпителиоцитов, при этом более старые кишечные клетки смещаются к верхушке ворсинки (дальше от кровеносных сосудов) и постепенно подвергаются растущему воздействию гипоксии. Авторы сообщают о свидетельствах гибели клеток на верхушках ворсинок, где выраженность гипоксии была экстремальной. Тейлор с соавт. также выявили, что скорость образования новых клеток в растущих кишечных ворсинах мышей, которых кормили КСВСФ, была идентичной, что и у мышей без КСВСФ в рационе. Согласно этим наблюдениям, гибель клеток, индуцированная гипоксией, сдерживает рост длины ворсинок, а ворсинки мышей, питавшихся КСВСФ, оказались длиннее, потому что клетки в них погибали с меньшей вероятностью по сравнению с клетками, подвергшимися гипоксии, в ворсинах мышей, которые не питались КСВСФ.
Тейлор с соавт. исследовали, как фруктоза может способствовать выживанию клеток, подвергшихся гипоксии. В ходе анализа роста клеток, выращенных in vitro, обнаружилось, что фруктоза вызывает повышение уровня Ф-1-Ф. Более того, добавление фруктозы в среду этих клеток ингибировало метаболический путь расщепления глюкозы (гликолиз) на стадии, катализируемой ферментом ПКМ2 (изоэнзим пируваткиназы М2). Низкая активность ПКM2 способствует перенаправлению промежуточных продуктов гликолиза на антиоксидантные и биосинтетические пути, благодаря которым клетки способны выживать в условиях стресса [11]. В зависимости от состояния метаболизма клетки, различные внутриклеточные молекулы связываются с ПКМ2 и переводят его из высокоактивной формы тетрамера (состоит из четырех белковых субъединиц) в низкоактивную форму мономера (состоит из одной белковой субъединицы) [11]. ПKM2 в форме мономера может перемещаться в ядро, где этот фермент способствует управлению экспрессией генов транскрипционным фактором HIF-1α, что помогает клеткам в условиях гипоксии поддерживать свои энергетические резервы [12].
Авторы обнаружили, что Ф-1-Ф связывается с ПKM2, вероятно, в силу его структурного сходства с фруктозо-1,6-бисфосфатом (Ф-1,6-БФ), метаболитом гликолиза, который может активировать ПKM2. В отличие от Ф-1,6-БФ, Ф-1-P вынуждает PKM2 принимать низкоактивную форму мономера. Это помогает клеткам кишечника, испытывающим гипоксию и использующим фруктозу в качестве энергетического субстрата, снизить оксидативный стресс и повысить активность HIF-1α для сохранения энергетического баланса. Когда Тейлор с соавт. скармливали мышам TEPP-46 (небольшую молекулу, которая блокирует ПKM2 в активной форме тетрамера и позволяет ускользать от ингибирования Ф-1-Ф), это предотвращало удлинение кишечных ворсинок у мышей, питавшихся КСВСФ. Это указывает на то, что Ф1-Ф из фруктозы, контролируя активность ПKM2, помогает выживать клеткам в условиях гипоксии в растущей ворсинке.
Для дальнейшего изучения роли ПKM2 и KГK в росте ворсинок кишечника, авторы удалили часть гена Pkm, которая специфически кодирует ПKM2, либо ген Khk (кодирует КГК). Модификация гена Pkm с целью предотвращения экспрессии ПKM2 привела к экспрессии альтернативной версии этого гена, кодирующего фермент ПKM1, активность которого постоянна [11] (что сходно с ПKM2 при связи с TEPP-46). В результате питания КСВСФ и этих делеций гена удлинение ворсинок предотвращалось, и, что важно, уровень липидов в крови у мышей снижался по сравнению с уровнем липидов у мышей, которых кормили КСВСФ и у которых не удаляли вышеперечисленные гены. Это свидетельствует об удлинении ворсинок вследствие употребления фруктозы, что позволяет лучше усваивать жиры из пищевых продуктов.
Затем Тейлор с соавт. исследовали, как соотносятся результаты их экспериментов с клетками здорового кишечника с опухолями кишечника. Они обнаружили клетки в состоянии гипоксии в опухолях кишечника у мышей, которые оказались генетически предрасположены к развитию данных опухолей. Как было описано ранее [10], кормление таких мышей КСВСФ привело к образованию более крупных опухолей по сравнению с мышами, в рационе которых КСВСФ отсутствовал. Хотя лечение мышей, питавшихся КСВСФ, посредством TEPP-46 не устраняло в полной мере опухолевый рост, однако оно предотвращало онкогенные побочные эффекты питания КСВСФ. Авторы также наблюдали повышенную экспрессию целевых генов HIF-1α и низкую активность ПKM2 в образцах колоректальных опухолей человека по сравнению с близлежащей незлокачественной тканью. Согласно этим наблюдениям, аналогично клеткам в условиях гипоксии в растущих ворсинках, низкая активность ПKM2 может также способствовать опухолевому росту, позволяя раковым клеткам кишечника выживать в состоянии гипоксии.
Согласно результатам работы авторов, ПKM2 и Ф-1-Ф (в виде его лиганда, как недавно было описано) опосредуют ранее не принятые во внимание эффекты фруктозы как в здоровых, так и в опухолевых тканях кишечника. Полученные результаты поднимают некоторые вопросы касательно современного понимания того, как питательные вещества проходят обработку в кишечнике. У здоровых животных кишечный фермент липаза расщепляет липиды из продуктов питания на молекулы, удобные для усвоения кишечными клетками и перестройки для доставки через лимфатическую систему в кровь. Таким образом, по мнению Тейлора с соавт., вопрос о том, как липиды из пищи стимулируют повышение концентрации липидов в крови (как это происходит у мышей, питающихся КСВСФ, даже в условиях ингибирования липаз), требует дальнейшего изучения. Возможно, удлинение ворсинок связано с проницаемостью стенки кишечника [8], и когда жирная пища подавляет ферментативную активность липаз, избыток пищевых липидов проходит мимо кишечных клеток и попадает в кровоток.
Потребление фруктозы увеличивает степень экспрессии транспортера GLUT5, который помогает проникновению фруктозы в клетки [5], тем самым повышая поглощение фруктозы. Неясно, повышает ли абсорбцию фруктозы увеличение длины кишечных ворсинок, что, теоретически, может снижать степень проникновения фруктозы в толстую кишку и печень (в результате постоянного употребления этого моносахарида) [5]. В таком случае, даже если удлинение ворсинок способствует всасыванию жиров, оно также может частично смягчить вредное воздействие самой фруктозы на печень. Будет интересно определить, как сложный баланс между абсорбцией и способностью кишечника метаболизировать фруктозу, липиды и другие нутриенты, а также взаимосвязь этих процессов с активностью микроорганизмов в толстой кишке способствуют возникновению ожирения и связанных с ним патологий.
Принимая во внимание терапевтические возможности этой работы, эксперименты авторов служат убедительным доказательством того, что фермент ПKM2 способствует выживанию кишечных клеток, где он и экспрессируется. Однако экспрессия ПKM2 также наблюдается и во многих других типах клеток, например, в иммунных клетках, опосредующих функции, необходимые для поддержания здоровья как кишечника, так и печени.
Любопытно, что TEPP-46, несмотря на способность предотвращать рост ворсинок кишечника, стимулированный употреблением КСВСФ, не повлиял на стеатоз печени в эксперименте. Данное наблюдение контрастирует с фактом уменьшения степени стеатоза, вызванного фруктозой, что авторы наблюдали в случае делеции гена Pkm (предотвращает экспрессию ПKM2). Это несоответствие между генетическим и фармакологическим методами модуляции ПKM2 повышает вероятность того, что комбинированное действие активаторов ПKM2 на разные типы клеток может в конечном итоге определять их модуляцию специфических функций тканей при патологии. Несмотря на ранее существовавшие ожидания, активаторы ПKM2 еще не появились в арсенале лекарственных средств лечения рака. Работа Тейлор с соавт. подчеркивает тот факт, что глубокое понимание физиологии тканей и особенностей заболевания позволит исследователям выделить новые области терапевтического воздействия, в которых активация PKM2 может оказаться удачной. Тем не менее, полный отказ от употребления сладких напитков может стать хорошим стартом борьбы с ожирением.
