pH-чувствительные антитела к CTLA-4: эффективны и нетоксичны

Долгое время считалось, что противоопухолевое действие антител к CTLA-4 (цитотоксический T-лимфоцит-ассоциированный антиген 4) обусловлено блокированием взаимодействия CTLA-4 с его лигандами. Этот механизм, эффективность и безопасность которого ограничены иммуноопосредованными побочными эффектами, известен как блокада контрольных точек. Согласно данным нового исследования, антитела, разработанные Чжан с коллегами, обладая той же эффективностью, не имеют побочных эффектов. Это дает надежду на создание нового поколения более безопасных и эффективных антител против CTLA-4.
CTLA-4 был открыт в 1987 году, он схож с CD28 (этот мембранный белок экспрессируется на T-лимфоцитах, участвует в активации T-клеток) и является основным ингибитором Т-клеток. Такой вывод был сделан, исходя из наблюдений: у мышей с дефицитом CTLA-4 наблюдается тяжелая иммунная дисрегуляция, связанная с летальной лимфопролиферативной болезнью; у людей с гаплонедостаточными мутациями CTLA4 наблюдается иммунная дисрегуляция, которая может быть нивелирована слиянием CTLA-4-Ig белка. Однако вопрос о механизмах ингибирования остается дискуссионным (обзор по ссылке). Есть несколько популярных мнений: например, конкуренция с CD28 за связывание с их общими лигандами: CD80 и CD86 (известные как B7-1 и B7-2, соответственно) или активная передача ингибирующих сигналов через цитоплазматический домен CTLA-4 и подавление костимулирующих лигандов на поверхности антигенпредставляющих клеток (АПК).
Сложность изучения CTLA-4 заключается в противоречивости данных, которые указывают на внеклеточный домен или цитоплазматический хвост как на критический фактор выполнения ингибирующей функции (ссылка). Еще больше все усложняет тот факт, что помимо иммунореактивных T-клеток, в которых CTLA-4 индуцируется стимуляцией Т-клеточных рецепторов, Т-супрессоры постоянно экспрессируют высокие уровни CTLA-4. Кроме того, CTLA-4 необходим для подавления Т-супрессоров. Механизм этого действия заключается в способности CTLA-4 уменьшать количество CD80/86 на поверхности АПК, особенно дендритных клеток через трансэндоцитоз.
CTLA-4 стал интересен для изучения после открытия того факта, что введение анти-CTLA-4 антител in vivo усиливает противоопухолевый иммунитет. С этого открытия началась разработка анти-CTLA-4 антител для иммунотерапии рака. В 2011 году препарат Ипилимумаб для лечения неоперабельной прогрессирующей меланомы был одобрен FDA. Ипилимумаб продемонстрировал значимый и длительный эффект и в настоящее время проходит клинические испытания в отношении возможности терапии других видов рака. Тем не менее, применение ипилимумаба (и аналогичных антител) в клинической практике иммунотерапии рака ограничено тем, что он эффективен только для некоторых видов рака и имеет, например, воспалительные и аутоиммунные побочные эффекты, вследствие чего иногда требуется прекратить лечение. Таким образом, крайне необходимо изучить клеточную и молекулярную основу побочных эффектов, связанных с терапевтическим применением антител против CTLA-4. Это позволило бы разработать антитела, которые будут эффективны, но не токсичны.
Долгое время считалось, что действие анти-CTLA-4 антител обусловлено их способностью блокировать взаимодействие CTLA-4 с его лигандами — CD80/86, что приводит к взаимодействию этих лигандов с конкурентным костимулирующим рецептором CD28 с последующей активацией иммунореактивных Т-клеток. Этот механизм назвали блокадой контрольных точек; он считался основой иммунотерапевтического эффекта антител против CTLA-4, так как ранее было выяснено, что антитела блокируют связывание растворимого CD80/86 с поверхностно-связанным CTLA-4. Однако эта концепция была оспорена в двух докладах 2018 года, демонстрирующих, что ипилимумаб фактически не блокирует трансэндоцитоз CD80/86 из дендритных клеток. Более того, искусственно разработанные антитела, не блокирующие взаимодействие CTLA-4-CD80/86, полностью сохранили свой иммунотерапевтический эффект, подавляя внутриопухолевые T-супрессоры. Исследования также показали, что желаемый иммунотерапевтический эффект может быть достигнут без побочных явлений. Интересно, что новый сигнальный путь Т-супрессоров, сопряженный с CTLA-4, опосредует контактно-зависимую супрессию и также осуществляет иммунотерапевтическое действие без такого побочного эффекта, как аутоиммунный колит.
В исследовании, недавно опубликованном в Cell Research, Чжан с соавт. изучили молекулярный механизм, являющийся причиной иммуноопосредованных побочных эффектов. Стало ясно, что антитела, такие как ипилимумаб, напрямую связываются с поверхностным CTLA-4 для разрушения в лизосомах, независимо от уровня pH, в то время, как искусственно разработанные антитела без иммуноопосредованных побочных эффектов отделяются от CTLA-4 после эндоцитоза в эндосомальных пузырьках с более низким pH (рис. 1). Затем CTLA-4 отдельно взаимодействует с LRBA (LPS Responsive Beige-Like Anchor Protein — липополисахарид-чувствительный и бежево-подобный якорный белок), шапероном для транспорта везикул, что позволяет ему возвращаться на поверхность клетки. Для дальнейшей проверки нового метода авторы продолжили изменение Тремелимумаба (антитела против CTLA-4, которые имеют иммуноопосредованные побочные эффекты) для повышения чувствительности к pH. Тремелимумаб еще не одобрен FDA. Но данная разработка позволила полученным pH-чувствительным антителам отделиться от CTLA-4 в кислых эндосомальных везикулах, позволяя CTLA-4 возвращаться на поверхность клетки, а не подвергаться деградации.
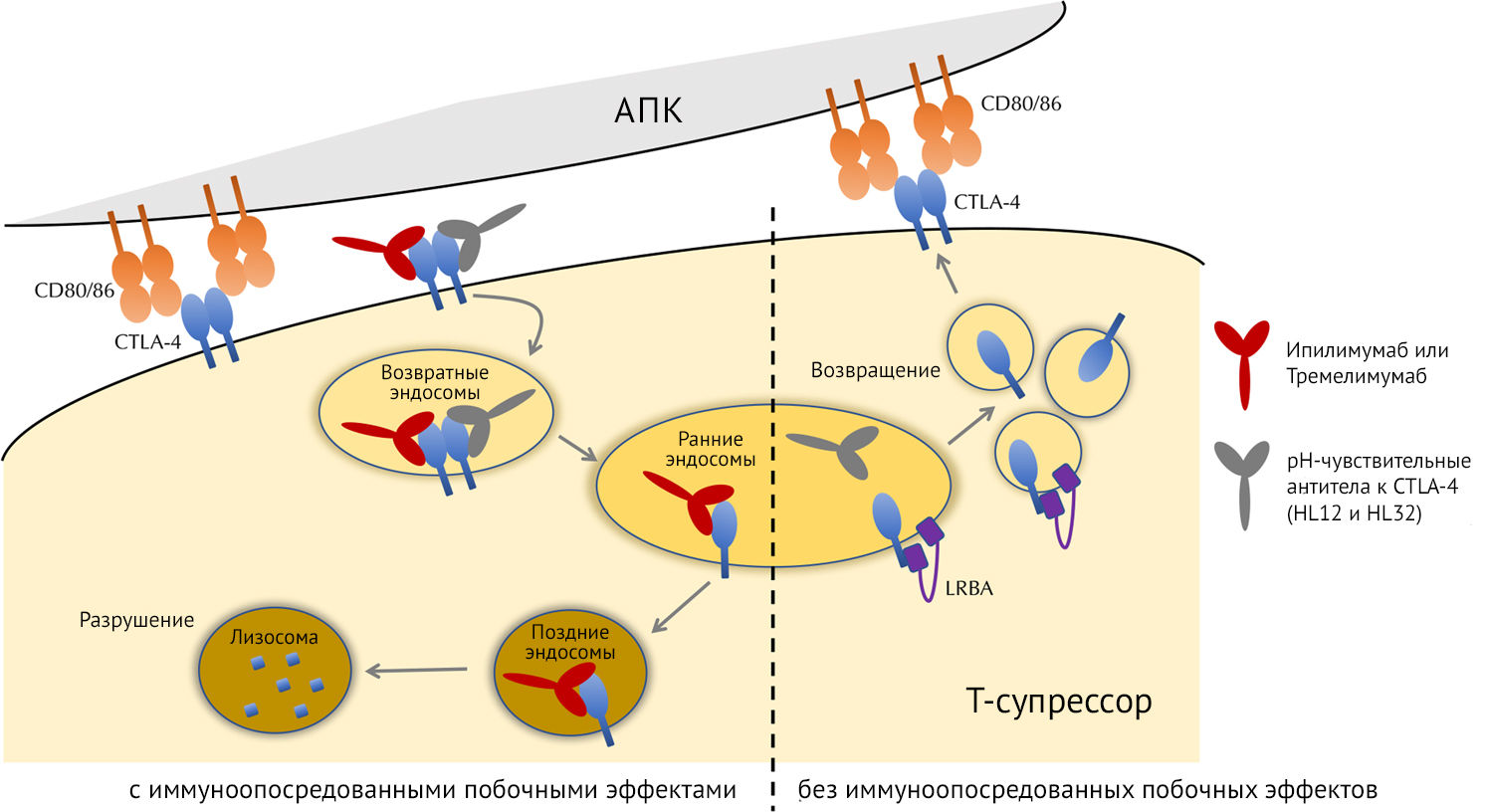
Аналогичным образом, чувствительные к рН антитела, такие как HL12 и HL32, связываются с CTLA-4, экспрессируемым на поверхности T-супрессоров, и комплекс CTLA-4-антитело трансформируется в эндосомы, которые возвращаются на поверхность клетки и созревают в ранние эндосомы с рН 6,0–6,5. Однако, в отличие от Ипилимумаба и Тремелимумаба, HL12 и HL32 при данном уровне pH отделяются от эндоцитозированного CTLA-4, позволяя CTLA-4 связываться с LRBA, что способствует возвращению CTLA-4 на поверхность клетки.
Это приводит к непрерывной экспрессии CTLA-4 на поверхности Т-супрессоров (правая сторона пунктирной линии на рисунке), что необходимо для предотвращения иммуноопосредованных побочных эффектов. Постоянное возвращение CTLA-4 на поверхность клетки и экспрессия CTLA-4 на поверхности Т-супрессоров обеспечивают более стабильную связь антител и подавление T-супрессоров, что приводит к усилению противоопухолевого действия.
