Физиология обратного набора веса после его снижения

Набор массы тела после успешного её снижения благодаря изменению образа жизни представляет собой большую проблему в контексте борьбы с избыточным весом и ожирением. Знание причинных механизмов повторного набора веса может помочь исследователям и врачам найти эффективные стратегии борьбы с этим явлением и уменьшить метаболические и сердечно-сосудистые осложнения, связанные с ожирением. В этом обзоре суммировано современное понимание ряда потенциальных физиологических механизмов, лежащих в основе восстановления веса после его снижения, в том числе роль иммунных клеток жировой ткани, гормональные и нейрональные факторы, влияющие на голод, сытость и систему вознаграждения; расход энергии в состоянии покоя и адаптивный термогенез, а также липидный обмен (липолиз и окисление липидов).
Авторы описывают и обсуждают изменения в этих механизмах, связанные с ожирением, их работу во время потери и восстановления веса, а также их связь с повторным набором массы тела. Также рассматриваются основанные на этих факторах меры по предотвращению или ограничению повторного набора веса, такие как диета, физические упражнения, фармакотерапия и биомедицинские стратегии, а также текущие знания об эффективности этих мер.
Ключевые положения
- Повторный набор веса после его снижения в результате диет представляет собой распространенное явление и, вероятно, связан с физиологическими механизмами.
- Исследования последнего десятилетия предполагают существование памяти об ожирении в виде популяций воспалительных клеток жировой ткани и метаболических изменений, которые могут играть роль в восстановлении веса.
- Роль стойких изменений факторов, связанных с аппетитом, в повторном наборе веса и взаимодействие этих факторов с мозгом требует дальнейшего изучения.
- Следует рассмотреть стратегии снижения повторного набора веса после его потери (состав рациона, физические упражнения, фармакотерапия и другие биомедицинские воздействия).
Введение
Восстановление веса после изначально успешного его снижения является обычным явлением (Вставка 1). Такой повторный набор массы тела, по-видимому, происходит вследствие активации компенсаторных физиологических механизмов, которые запускаются отрицательным энергетическим балансом и сопровождающей его потерей веса в период ограничения калорий (и/или других изменений образа жизни) и активность которых может сохраняться после прекращения низкоэнергетической диеты. Стойкая активация этих механизмов будет способствовать восстановлению веса. Хотя они, вероятно, служат естественной реакцией на потерю веса с целью поддержания достаточной массы тела и запасов энергии, такие механизмы не работают у людей с ожирением, которые хотят похудеть.
В предыдущем обзоре авторы обсудили ряд факторов, связанных с жировой тканью, которые могут влиять на повторный набор веса, включая роль адипокинов, микроРНК, метаболизма жирных кислот и стресса адипоцитов [1]. В настоящем обзоре более подробно рассматриваются другие потенциально причинные биологические факторы: сохранение фенотипов иммунных клеток, связанных с ожирением, в жировой ткани после потери веса, адаптации внеклеточного матрикса (ВКM) адипоцитов, метаболические адаптации, такие как снижение расхода энергии, ослабление окисления и липолиза липидов, изменения в характере секреции гормонов кишечника и изменения нейронов, которые усиливают аппетит и обеспечивают реакцию вознаграждения в ответ на прием пищи. Авторы фокусируются на потере веса, вызванной образом жизни, поскольку вполне вероятно, что она отличается от реакции на потерю веса, вызванную хирургическим вмешательством, особенно в отношении передачи сигналов от желудочно-кишечного тракта в центральную нервную систему, направленную на изменение характера приема пищи [2]. Кроме того, авторы касаются некоторых стратегий предотвращения повторного набора веса, основанных на этих факторах.
Хотя за снижением веса за счет изменения образа жизни часто следует его восстановление, существуют заметные межиндивидуальные различия: некоторые люди способны поддерживать всю или большую часть пониженного веса в течение длительных периодов времени (годы), тогда как другие восстанавливают большую часть или же весь свой потерянный вес в течение нескольких месяцев. Для повышения эффективности долгосрочного лечения ожирения важно понимание триггеров, способствующих повторному набору веса и факторов, объясняющих индивидуальные различия.
Фенотипы иммунных клеток, ассоциированные с ожирением, в жировой ткани
Ожирение сопровождается изменениями врожденной и адаптивной иммунной системы жировой ткани у человека [3, 4] и у мышей [5, 6, 7]. Характерна массивная инвазия макрофагов, которые привлекаются адипоцитами, подвергшимися стрессу в результате гипоксии, гипертрофии или гибели клеток. Когда адипоциты окружены макрофагами, под микроскопом можно наблюдать коронообразные структуры. В то же время тканерезидентные макрофаги дифференцируются в спектр множества популяций макрофагов. Эти популяции включают состояния M2 и M1, которые используют окислительное фосфорилирование и гликолиз, соответственно, а также макрофаги с метаболическими характеристиками как M2, так и M1, которые секретируют провоспалительные цитокины, включая IL-1, IL-6 и фактор некроза опухоли (TNF) [8, 9]. При развитии ожирения в жировой ткани изменяются соотношение и функции не только макрофагов, но и многих других классов иммунных клеток [10].
Исследования, посвященные изменению экспрессии воспалительных генов в жировой ткани при потере веса, дали противоречивые результаты. Они могут указывать на то, что снижение массы тела за счет ограничения калорий уменьшает экспрессию этих генов по сравнению с состоянием до потери веса [11]. С другой стороны, результаты могут говорить о том, что экспрессия воспалительных генов усиливается при ограничении калорий и снижается при сохранении пониженного веса, даже до уровней ниже, чем до потери веса [12, 13]. В 2022 году было продемонстрировано, что индуцированная липополисахаридами выработка цитокинов макрофагами жировой ткани усиливается при развитии ожирения и впоследствии не снижается при потере веса [14]. Эти наблюдения подтверждают концепцию о том, что ожирение, за которым следует потеря веса, создает «обезогенную память», также называемую «памятью об ожирении» [15]; то есть сочетание факторов, возникающих при ожирении и последующем снижении массы тела, которое создает риск возврата к состоянию ожирения. Пример ключевых факторов, связанных с памятью об ожирении, — персистирующие воспалительные клетки в жировой ткани. В основе устойчивости популяций иммунных клеток могут лежать эпигенетические изменения экспрессии генов в ответ на сигналы окружающей среды [9, 16]. В статье 2023 года [17] выдвинута гипотеза о том, что долгосрочный импринтинг ожирения и потери веса в иммунных клетках жировой ткани, называемый «тренированным иммунитетом» врожденной иммунной системы [18, 19], лежит в основе хронического воспаления, а также врожденной иммунной памяти. Идея состоит в том, что такая «тренировка» (то есть иммунометаболическое и эпигенетическое перепрограммирование миелоидных клеток) делает иммунные клетки более восприимчивыми к будущим стимулам. Интересно, что тренированный иммунитет также, как предполагается, вызывает изменения в клетках-предшественниках костного мозга; это может объяснить поддерживаемое или постоянное присутствие определенных популяций иммунных клеток в жировой ткани во время циклов увеличения и снижения веса [18].
На мышах, проходящих через цикл увеличения веса, его потери и восстановления, с помощью новых методов удалось более подробно изучить различные популяции иммунных клеток в жировой ткани, связанных с ожирением. Среди этих методов — флуоресцентный сортинг клеток в сочетании с секвенированием отдельных клеток и клеточным индекированием транскриптомов и эпитопов путем секвенирования поверхностных белков. Исследование 2022 года [10] показало, что количество тканерезидентных макрофагов уменьшается при ожирении, потере и восстановлении веса, тогда как количество липид-ассоциированных макрофагов увеличивается при ожирении и сохраняется во время потери и восстановления веса. Уровень регуляторных Т-клеток жировой ткани снижается пропорционально количеству αβ-Т-клеток жировой ткани во время развития ожирения и остается более низким во время потери и восстановления веса по сравнению с состоянием до ожирения. Во время ожирения, потери веса и его повторного набора в жировой ткани возрастает количество Т-клеток истощенного фенотипа. Этот фенотип характеризуется постепенной потерей функции и специфическими изменениями экспрессии генов [20, 21]. Пропорции антигенпредставляющих дендритных клеток в жировой ткани в значительной степени не изменяются, но при ожирении активированные субпопуляции дендритных клеток обогащаются, и эти субпопуляции сохраняются во время потери и повторного набора веса [10]. Эти данные о сохранении клеточных популяций указывают на то, что у мышей увеличение веса с последующей его потерей заставляет макрофаги и другие иммунные клетки в жировой ткани выступать в качестве врожденной иммунной памяти о воспалении. До сих пор такие изменения популяций жировых иммунных клеток изучались в основном на самцах мышей. Сообщалось о половых различиях воспалительных реакций на липолиз жировой ткани у мышей с ожирением, вызванным диетой [22]. Поэтому не следует проводить экстраполяцию наблюдений на самок мышей и на человека без проведения дополнительных экспериментов. Благодаря упомянутым выше новым методам, таким как секвенирование отдельных клеток и протеомика, необходимая информация вскоре может стать доступной.
Память об ожирении и повторный набор веса
На мышах показано, что память об ожирении, сформированная в иммунных клетках во время ожирения и потери массы тела, играет роль в повышении риска повторного набора веса. Исследование 2017 года [23] показало, что после цикла набора и снижения веса мыши, находящиеся на диете с высоким содержанием жиров (ДВЖ), набирали массу тела быстрее, чем мыши с аналогичной массой тела, которые предварительно не прошли такой цикл. Это явление наблюдалось даже спустя два месяца после похудения. Было обнаружено, что для набора веса после его снижения необходимы CD4+ Т-клетки, поскольку системное истощение CD4+ Т-клеток приводит к исчезновению памяти об ожирении. Более того, оказалось, что наивные иммунодефицитные мыши Rag1–/–, ранее не страдавшие ожирением, при переносе CD4+ Т-клеток приобретали память об ожирении, что имеет важное значение для усиленного набора веса после его потери, поскольку системное истощение CD4+ Т-клеток приводило к исчезновению памяти об ожирении. Более того, наивные иммунодефицитные мыши Rag1–/–, не имевшие в анамнезе ожирения, приобрели память об ожирении в результате переноса CD4+ Т-клеток от мышей, ранее страдавших ожирением.
У людей наличие связи между иммунным статусом жировой ткани и восстановлением веса после его снижения предположили в исследовании YoYo, посвященном диетическим вмешательствам. В нем люди с избыточным весом или ожирением потеряли 8% массы тела на низкокалорийной диете (1250 ккал в день) или очень низкокалорийной диете (ОНКД) (500 ккал в день) (фаза снижения веса), затем в течение четырех недель оставались на сбалансированной диете для поддержания потери веса (фаза стабильного веса). Затем за ними наблюдали девять месяцев, в течение которых отмечался повторный набор веса [24]. В подкожной жировой ткани исследовали экспрессию 277 генов ВКМ. У людей, которые похудели с помощью ОНКД, изменение экспрессии кластера генов интегринов во время фазы стабилизации веса положительно коррелировало с процентом восстановления веса [25]. Гены интегринов оказались специфичными для лейкоцитов. Результаты показали, что люди с наименьшим снижением экспрессии специфичных для лейкоцитов генов в течение нескольких недель после потери веса (фаза стабильного веса) были более склонны к его повторному набору. Эти данные согласуются с представлением о роли памяти об ожирении, в основе которой у людей лежат персистирующие клетки миелоидного ряда, но в то же время они демонстрируют индивидуальные различия в отношении этого явления.
Сохранение определенных популяций иммунных клеток после потери веса, исследование CD4+ Т-клеток на мышах и связь между экспрессией специфических для лейкоцитов генов и восстановлением веса говорят о роли воспалительной памяти об ожирении, основанной на иммунных клетках, в риске повторного набора веса у людей. Хотя четких данных о механизме пока нет, можно предположить, что ферменты, модифицирующие ВКМ и секретируемые макрофагами, не только играют роль в инфильтрации иммунных клеток, но также могут быть частью памяти об ожирении. Когда адипоциты разрастаются, их ВКМ может потерять свой динамический характер, поскольку гипоксия препятствует правильному функционированию модифицирующих коллаген кислородзависимых ферментов,таких как лизилоксидаза и пролил-4-гидроксилаза [26]. В конечном счете утрата динамичности ВКМ будет противодействовать дальнейшему росту [27], и сигналинг адипоцитов будет скорректирован для уменьшения потребления и запасания энергии внутри этих клеток (рис. 1А). Во время развития ожирения ферменты, модифицирующие ВКМ и секретируемые макрофагами, могут ослабить ВКМ и уменьшить препятствия для роста и, следовательно, потребления энергии (рис. 1А). После потери веса часть иммунных клеток остается в жировой ткани (рис. 1Б). При новом воздействии, связанном с положительным энергетическим балансом (например, при возвращении к режиму питания до потери веса), модифицирующие ВКМ ферменты этих стойких иммунных клеток становятся легко доступными. Как и раньше, эти ферменты реконструируют внеклеточный матрикс, чтобы обеспечить рост адипоцитов и предотвратить подавление потребления энергии, тем самым способствуя повторному набору веса (рис. 1B). Участие иммунных клеток в этом механизме также подтверждает возможность того, что на риск повторного набора веса влияют провоспалительные и противовоспалительные цитокины [28, 29]. Однако эта возможность еще не изучена достаточно подробно. Исследование 2022 года показало, что в течение периода наблюдения YoYo изменение уровня IL-6 было положительно связано с восстановлением массы тела [30].
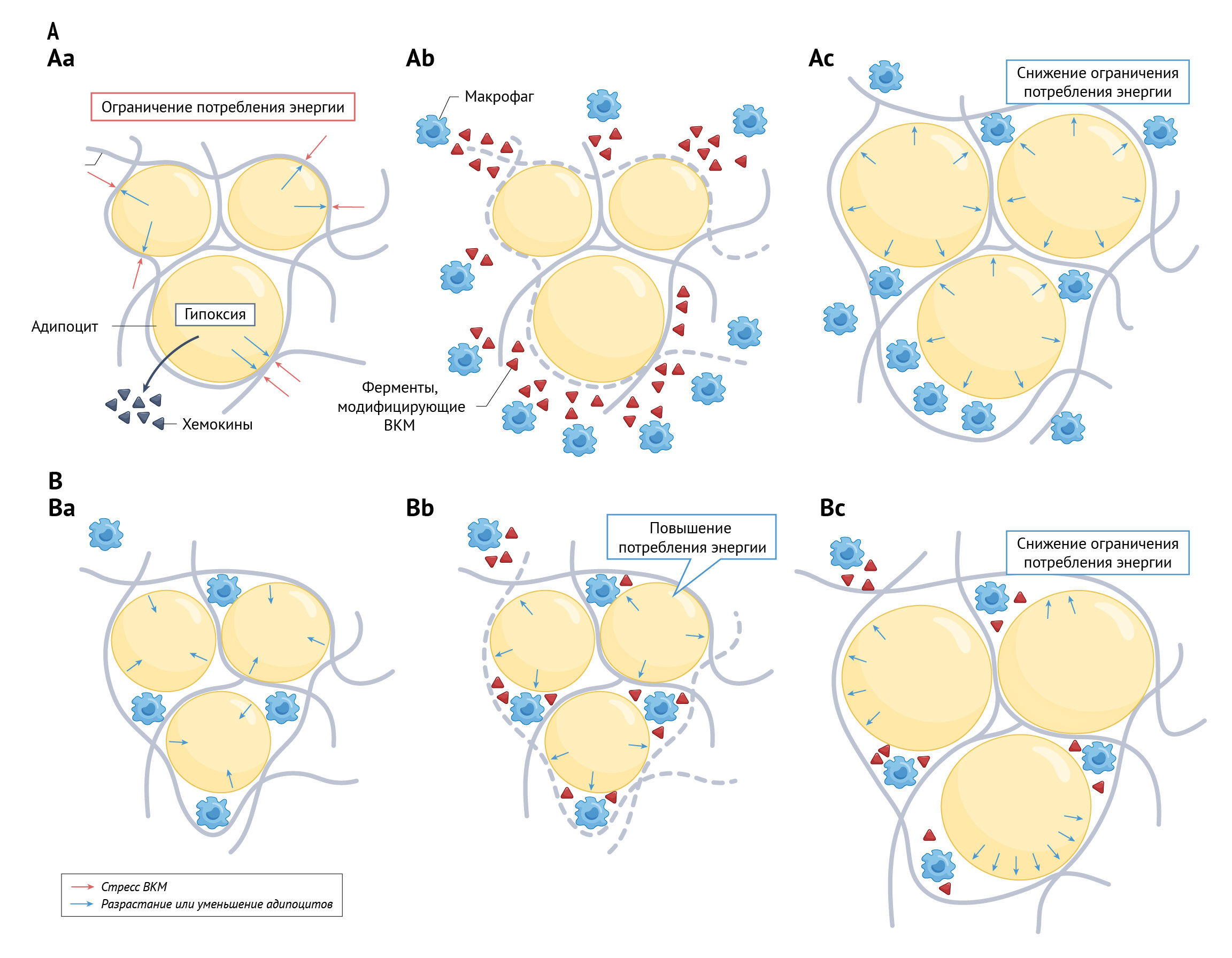
Аа. Положительный энергетический баланс приводит к разрастанию адипоцитов, вызывая стресс внеклеточного матрикса (ВКМ). Как следствие, сигналы от находящейся в стрессе жировой ткани приводят к уменьшению потребления и запасания энергии. Хемокины, также секретируемые адипоцитами, подвергшимися стрессу, привлекают макрофаги.
Aб. Макрофаги секретируют ферменты, модифицирующие ВКМ, ослабляющие его и снижающие стресс.
Ав. Снижение стресса ВКМ позволяет увеличить потребление энергии и способствовать дальнейшему росту адипоцитов.
Б. Персистенция макрофагов в жировой ткани способствует повторному набору веса после его снижения.
Бa. После снижения веса размер адипоцитов уменьшается, а ВКМ перестраивается и уплотняется вокруг сжавшихся адипоцитов. Однако макрофаги в тканях сохраняются.
Бб. Если переедание происходит снова, это приводит к быстрой секреции модифицирующих ВКМ ферментов уже присутствующими стойкими макрофагами и ослаблению ВКМ.
Бв. Ослабление ВКМ способствует быстрому росту адипоцитов и восстановлению веса.
Примечательно, что в предложенном механизме ферменты, модифицирующие ВКМ, играют решающую роль. Катепсин S представляет собой часть кластера экспрессии специфических для лейкоцитов интегринов, которые коррелируют с восстановлением веса в исследовании YoYo, как описано выше [25]. Катепсин S принадлежит к семейству катепсиновых протеаз, которые выполняют как внутриклеточные, так и внеклеточные функции и участвуют в поддержании здоровья и развитии заболеваний [31, 32]. Катепсин S экспрессируется и секретируется макрофагами и может участвовать в инфильтрации иммунных клеток в жировую ткань. В исследовании YoYo люди с наименьшим снижением уровня РНК катепсина S в жировой ткани во время фазы стабилизации массы тела после ее потери имели самый высокий риск повторного набора массы веса [25]. Таким образом, персистенция катепсина S может быть частью памяти об ожирении, усиливающей риск восстановления веса из-за инфильтрации иммунных клеток и воспаления. Два других члена семейства генов катепсина, катепсин B и катепсин D, являются частью другого кластера коэкспрессии, выявленного в исследовании YoYo, и изменения в экспрессии этих катепсинов в жировой ткани в течение периода стабилизации веса были связаны с повторным набором массы тела [25]. Функция этого кластера генов была определена как «модификация ВКМ» [25]. Как и катепсин S, катепсины B и D экспрессируются в макрофагах, тогда как катепсин B также экспрессируется адипоцитами. Катепсин B является одним из ферментов, осуществляющих процессинг, который необходим для образования катепсина D [33].
Таким образом, ожирение сопровождается инфильтрацией макрофагов и других иммунных клеток. После снижения веса часть иммунного профиля сохраняется (рис. 1). Ограниченные данные на мышах и людях указывают на то, что такая «обезогенная память» участвует в риске повторного набора веса. Возможный механизм включает секретируемые макрофагами ферменты, модифицирующие ВКМ, некоторые из которых могут быть частью семейства катепсиновых протеаз. Чтобы понять, как происходит сохранение профиля иммунных клеток, а также его роль в восстановлении веса (особенно у людей), необходимы дополнительные экспериментальные данные.
Расход энергии и метаболическая адаптация
Принято считать, что основным фактором увеличения веса является высокое потребление энергии, а не ее низкие затраты. Однако также возможно, что низкий расход энергии без соответствующего низкого ее потребления способствуют увеличению веса. Более того, метаболическая адаптация к снижению веса (то есть уменьшение затрат энергии, превышающее ожидаемое с учетом конституции тела) потенциально может играть роль в повторном наборе веса.
Расход энергии
В основополагающей статье 1986 года сообщалось, что в популяции индейцев пима родственные связи объясняют часть различий в расходе энергии в состоянии покоя (РЭП) (с поправкой на количество метаболически активной ткани, то есть безжировой массы [БЖМ]) [34], что указывает на генетическую составляющую вариаций РЭП. Однако у лиц из семей с более низким уровнем РЭП уровень ожирения был не выше, чем у лиц из семей с более высоким РЭП, что, по мнению авторов, вероятно, частично объясняется тесной корреляцией между БЖМ и процентом массы жировой ткани тела. Это указывает на то, что РЭП, скорректированный на БЖМ, уже был частично скорректирован на ожирение. Последующее исследование 1988 года показало, что скорректированный РЭП участников при первом визите предсказывал прибавку массы тела в течение четырехлетнего периода наблюдения. Более того, суточные затраты энергии, измеренные в дыхательной камере, коррелировали со скоростью изменения массы тела в течение двухлетнего периода наблюдения у другой группы индейцев пима [35]. С другой стороны, анализ 2022 года с использованием международной базы данных о воде с двойной маркировкой для измерения 24-часовых затрат энергии не обнаружил связи между 24-часовыми расходами энергии и увеличением веса тела или массы жировой ткани [36]. Однако незначимая ассоциация (P = 0,094) была обнаружена у тех лиц, за которыми наблюдали больше четырех недель. Таким образом, отсутствие четкой связи могло быть связано с коротким периодом наблюдения.
Хотя, как упоминалось выше, есть некоторые данные, что низкий базовый уровень РЭП (с поправкой на БЖМ) связан с увеличением веса, авторам настоящего обзора известно только одно исследование, которое показало, что более низкий исходный уровень РЭП (с поправкой на БЖМ) связан с большим набором веса после его потери, вызванной диетой [37]. Остается неясным, отражал ли более низкий исходный уровень РЭП в этом исследовании семейную особенность, или же он был следствием предыдущих попыток снижения веса или отрицательного энергетического баланса.
Метаболическая адаптация
Метаболическая адаптация, также известная как адаптивный термогенез, не имеет однозначного определения [38]. Определения метаболической адаптации различаются и могут иметь разные значения в разных контекстах. В контексте снижения веса адаптивный термогенез означает уменьшение РЭП и расхода энергии вне состояния покоя, связанное с ограничением калорий, которое не зависит от изменений массы и состава тканей тела [38]. Многие исследования были сосредоточены только на РЭП или расходе энергии во время упражнений и поэтому не могут дать полную картину. Сопутствующее состояние энергетического баланса на момент измерения энергетических затрат после снижения веса может оказывать глубокое влияние на выявление метаболической адаптации и не всегда четко описано в публикациях. У лиц, которые похудели, но все еще находились в отрицательном энергетическом балансе при измерении уровня метаболической адаптации, она будет более выраженной, чем у лиц, находящихся в нулевом энергетическом балансе на момент измерения [39]. Затраты энергии, вызванные диетой, также ниже в условиях ограничения энергии, что может привести к снижению показателей РЭП даже после ночного голодания продолжительностью 12–14 часов [40]. Более того, часто отсутствуют точные измерения состава тела с учетом изменений анатомического и молекулярного состава БЖМ, вызванных потерей веса, — и этот недостаток может привести к переоценке метаболической адаптации [41]. Кроме того, различаются методы расчета изменений метаболической адаптации [42], поэтому результаты исследований метаболической адаптации при снижении веса и их роль в восстановлении веса иногда трудно интерпретировать и сравнивать. Тем не менее, большинство исследований показали, что метаболическая адаптация к потере веса, вызванной ограничением калорий, существует для РЭП и затрат энергии при осуществлении активности [43, 44, 45]. Обзор потенциальных механизмов метаболической адаптации к ограничению энергии [46], вышедший в 2020 году, показал, что адаптация включает изменения в составе БЖM, снижение активности симпатической нервной системы, снижение уровня циркулирующего лептина, инсулина и гормонов щитовидной железы, а также повышение эффективности митохондрий. Уровень метаболической адаптации, по-видимому, влияет на степень потери веса при диете с ограничением калорий: люди с сильной метаболической адаптацией теряют меньше веса [47, 48], массы жировой ткани [49] или того и другого [50], чем люди с меньшей метаболической адаптацией.
Ведутся серьезные споры о том, сохраняется ли такая метаболическая адаптация после восстановления энергетического баланса и стабилизации массы тела [39, 51, 52, 53] и вызывает ли она повторный набор веса. Некоторые исследования дают основание предполагать, что метаболическая адаптация сохраняется в течение более длительных периодов времени после первоначальной потери веса, вызванной диетой (≥ 1 года) [54, 55, 56, 57, 58], а другие — что метаболическая адаптация быстро (в течение нескольких недель) исчезает после восстановления энергетического баланса [39, 45, 49]. Таким образом, в отношении сохранения метаболической адаптации, вызванной потерей веса, исследования противоречивы. Расхождения могут быть связаны с отсутствием стандартизации условий, при которых проводились измерения метаболической адаптации в различных исследованиях, того, какие компоненты 24-часового расхода энергии измерялись, а также степени потери и набора веса у участников исследования. В нескольких исследованиях поднимался вопрос о влиянии степени метаболической адаптации, связанной со снижением веса, на его повторный набор, но до сих пор ни в одном из них доказательств этого обнаружено не было [39, 49, 56, 59, 60, 61]. У участников «Соревнования наибольшего неудачника», измерения которым повторно проводили через шесть лет после окончания соревнований, на тот момент лучшее поддержание веса было связано с большей метаболической адаптацией; это позволяет предположить, что она обусловлена постоянными усилиями по снижению веса и может действовать им в противовес [56].
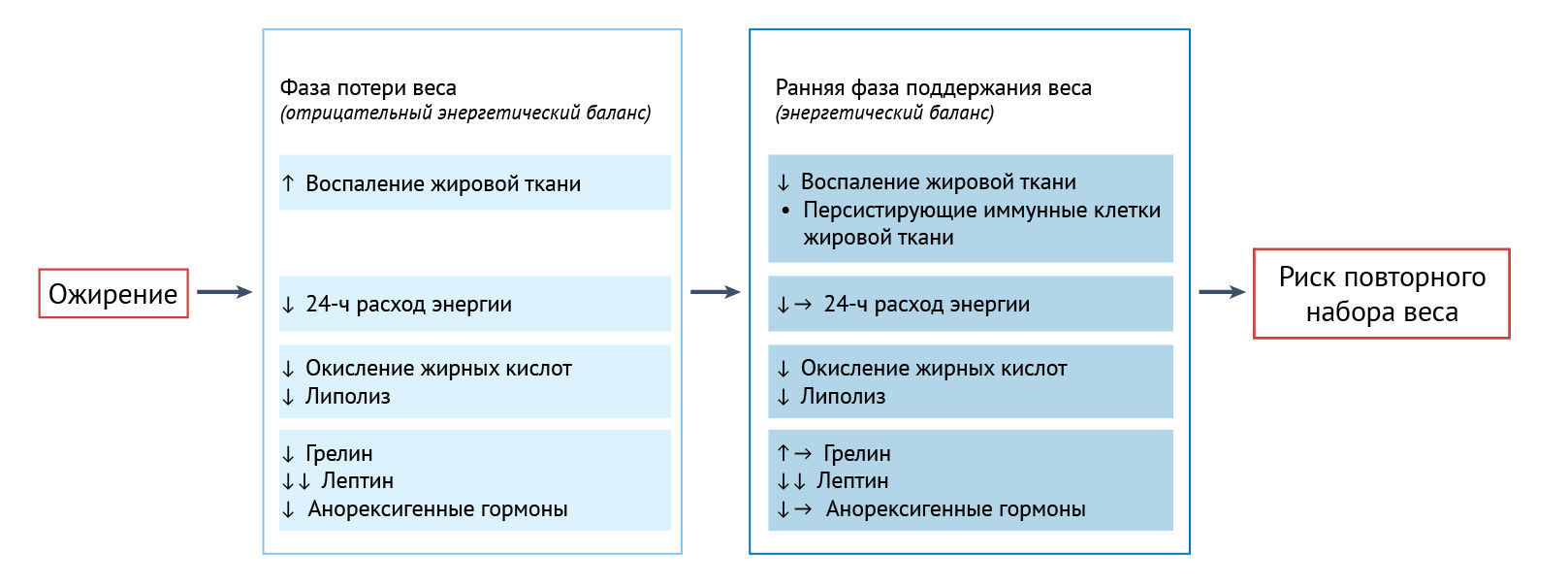
Таким образом, хотя индивидуально определяемый низкий расход энергии (РЭП) может быть связан с риском увеличения веса, вряд ли есть какие-либо доказательства того, что низкий уровень РЭП у лиц с ожирением будет предиктором повторного набора массы тела после ее снижения. Кроме того, до сих пор неясно, сохраняется ли метаболическая адаптация, возникающая при потере веса, на диете с ограничением энергии в отсутствие отрицательного энергетического баланса (рис. 2). До сих пор нет данных о том, что степень метаболической адаптации после потери веса предсказывает, насколько сильным будет его повторный набор.
Окисление липидов и липолиз
Для состояния стабильности веса необходим баланс между поступлением и расходом энергии. Такого баланса можно достичь только в том случае, если будут также сбалансированы уровни потребления и расходования макронутриентов. Запасы углеводов и белков строго регулируются путем корректировки уровня окисления в соответствии с уровнем потребления, и, таким образом, любое нарушение энергетического баланса в течение дня в основном устраняется за счет изменений в запасании и использовании липидов [62]. В долгосрочной перспективе изменения уровня свободных жирных кислот (СЖК) и чувствительности к инсулину, вызванные увеличением или уменьшением жировой ткани, влияют на среднюю скорость окисления липидов [63]. Впоследствии состав тела будет приближаться к той степени накопления жира, при которой окисление липидов будет соответствовать потреблению жиров с пищей [63]. Окисление липидов сдерживается высоким уровнем гликогена [64], поэтому людям, которые поддерживают относительно высокие запасы гликогена, необходимо большее увеличение массы жировой ткани.
Окисление липидов
Одной из первых работ, показавших потенциальную связь между окислением липидов и ожирением, было исследование на индейцах пима, которое показало, что более высокий 24-часовой дыхательный коэффициент (показатель, полученный в окисленной смеси субстратов), а значит, и более низкий уровень окисления липидов, связан с увеличением веса — независимо от того, был ли уровень РЭП высоким или низким [65]. С другой стороны, исследование 2020 года [66] не обнаружило связи между исходным дыхательным коэффициентом покоя и повторным набором веса через один и два года после программы снижения веса у женщин с избыточным весом в пременопаузе. Эти различия могут обусловливаться разницей между коэффициентом дыхания в состоянии покоя и 24-часовым коэффициентом дыхания, между первоначальным и повторным набором веса и/или различиями в исследуемых популяциях. Было обнаружено, что потеря веса снижает окисление липидов в покое и во время физических упражнений [67, 68], а 24-часовой дыхательный коэффициент был выше у взрослых, которые потеряли большое количество веса и поддерживали сниженный вес в течение как минимум двух месяцев, по сравнению с соответствующей по весу контрольной группой, которые похудели предварительно [69]. Сходным образом, у крыс с ожирением со сниженным весом выявлено более низкое 24-часовое окисление липидов, когда их неограниченно кормили диетой с низким содержанием жиров (НСЖ) после ограничения энергии, по сравнению с крысами с ожирением, неограниченно находящимися на той же диете, которые также соответствовали крысам первой группы по потреблению энергии. Эти результаты предполагают, что адаптация, вызванная потерей веса при окислении липидов, не зависит от энергетического дисбаланса [70]. Напротив, исследование 2019 года показало снижение дыхательного коэффициента при потере веса, сопровождающееся повышением уровня СЖК натощак у взрослых с ожирением [71]. Причина такого расхождения не совсем ясна, но, возможно, она связана с разными условиями измерения в двух исследованиях. Тем не менее, у участников с менее выраженным снижением дыхательного коэффициента, вызванным потерей веса, и более низким уровнем СЖК после нее наблюдался более выраженный повторный набор массы тела [71]. Следовательно, изменения в метаболизме СЖК, вызванные потерей веса, могут влиять на его восстановление. Этот результат был подтвержден тем фактом, что экспрессия генов, специфичных для жировой ткани, указывает на основную роль адаптации метаболизма жирных кислот, вызванной потерей веса, в его повторном наборе [71].
Липолиз
Окисление липидов натощак в основном происходит за счет липолиза жировой ткани и обусловлено высокими уровнями циркулирующих СЖК [72]. Поэтому возникает интересный вопрос: сопровождается ли снижение уровня окисления липидов, которое часто наблюдается у людей с ожирением и которое может дополнительно уменьшаться после потери веса, ослаблением липолиза?
Базальный и стимулированный липолиз при ожирении
На протяжении десятилетий исследователи наблюдали связь ожирения с нарушением липолиза жировой ткани [73, 74]. На основе исследований микродиализа подкожной жировой ткани [76, 77] можно утверждать, что базальный липолиз в жировой ткани, который опосредуется главным образом триглицеридлипазой жировой ткани (ТГЛЖК) [75], по-видимому, не зависит от ожирения. Однако, хотя в исследовании 2008 года с применением меченого глицерина [76] общая частота появления глицерина на базальном уровне была одинаковой у мужчин как с ожирением, так и без него, но значительно ниже у мужчин с ожирением с поправкой на массу жировой ткани тела. Объяснением более низкого базального липолиза при ожирении может быть связанная с ожирением резистентность к инсулину. Было обнаружено, что резистентность к инсулину ассоциирована со снижением экспрессии мРНК и белка ТГЛЖК [78].
Стимуляция липолиза жировой ткани β-адренергической системой происходит главным образом за счет активности гормон-чувствительной липазы (ГЧЛ) [75]. У взрослых и детей с ожирением стимуляция липолиза через β-адренергическую систему ослабевает. Такая устойчивость к липолизу, индуцированному катехоламинами, объясняется снижением экспрессии липолитических β2-адренорецепторов, усилением антилиполитических свойств α2-адренорецепторов и снижением экспрессии ГЧЛ [75]. Более того, со снижением липолиза, стимулируемого катехоламинами [79], и с ожирением [80] связаны однонуклеотидные полиморфизмы в гене β2-адренергического рецептора. Исследование с помощью микродиализа показало, что β2-адренергическая стимуляция липолиза также притупляется в скелетных мышцах людей с ожирением [81]. Кроме того, как на базальный, так и на стимулированный липолиз могут влиять маркеры воспаления, такие как TNF [82].
Влияние потери веса на базальный и стимулированный липолиз
Исследование 2007 года [78] показало, что экспрессия мРНК и белка ТГЛЖК в подкожной жировой ткани снижается при потере веса, вызванной диетой (при отрицательном энергетическом балансе). В соответствии с этими данными, судя по интерстициальным концентрациям глицерина, измеренным с помощью микродиализа, базальный липолиз подкожной жировой ткани снижался после вызванной диетой потери веса у женщин с ожирением (при отрицательном энергетическом балансе) и сохранялся во время повторного набора массы тела [83].
Относительно стимулированного липолиза исследование 1997 года [67] показало, что по сравнению с показателями до снижения веса стимулированный адреналином липолиз in vitro в изолированных подкожных абдоминальных и ягодичных адипоцитах был понижен в клетках, выделенных от участников, которые подверглись снижению веса в связи с диетой. С этим выводом согласуется наблюдение, что у людей с избыточным весом или ожирением экспрессия мРНК и белка ГЧЛ в подкожной жировой ткани снижается при потере веса (при отрицательном энергетическом балансе) [79]. В исследовании 2012 года [83] у женщин в пременопаузе с ожирением антилиполитическая активность α2-адренорецепторов снижалась во время потери веса, что приводило к увеличению индуцированной адреналином липолитической активности в жировой ткани. Однако этот эффект исчез на последующем этапе поддержания веса и, таким образом, по-видимому, он связан с отрицательным энергетическим балансом, а не с самой потерей веса.
Липолиз и повторный набор веса
В исследовании 2019 года [84] путем измерения выработки СЖК в жировой ткани ex vivo сравнивали липолиз у мышей, в течение восьми недель получавших ДВСЖ, а затем четыре недели — ДНСЖ, с липолизом у мышей, которых держали на ДНСЖ в течение 12 недель. Через 12 недель активность стимулированного норадреналином липолиза в этих двух группах не отличалась. Тем не менее, когда обе группы мышей впоследствии получали ДВСЖ, стимулированный липолиз в опытной группе был значительно ниже, чем в контрольной. Кроме того, у мышей опытной группы фосфорилирование ГЧЛ и экспрессия генов β1-адренергических, β2-адренергических и β3-адренергических рецепторов были ниже, хотя также уменьшалась экспрессия антилиполитического α2-адренергического рецептора. Различия в этих параметрах между группами очень напоминали ситуацию после первых восьми недель применения ДВСЖ или ДНСЖ. Поэтому было высказано предположение, что память при ожирении имеет не только воспалительный, но и метаболический компонент, — в частности, в отношении липолиза.
Нарушения липолиза после потери веса, наблюдаемые у людей с избыточной массой тела или ожирением, также позволяют предположить, что снижение липолиза может участвовать в повторном наборе веса. Появилась гипотеза, что снижение липолитической активности адипоцитов после потери веса может сдвинуть чистый баланс в сторону поглощения и запасания СЖК жировой тканью (в противовес секреции и утилизации СЖК), в частности, потому что уровень окисления СЖК также снижается. Однако на данный момент прямые доказательства этой гипотезы, которые были бы получены в ходе исследований с участием людей, ограничены. Исследование 2013 года показало, что изменение экспрессии белка ТГЛЖК в жировой ткани во время потери веса предсказывает его повторный набор: чем больше снижение ТГЛЖК, тем сильнее будет увеличиваться вес [85]. В исследовании YoYo более сильное снижение уровня СЖК в плазме, вызванное потерей веса, — которое, вероятно, отражает снижение липолиза, — предсказывало более выраженный повторный набор массы тела [86].
Таким образом, люди с ожирением в среднем характеризуются низким уровнем липолиза и окисления липидов. Как липолиз, так и окисление липидов еще сильнее нарушаются при потере веса, и есть некоторые данные о том, что такое нарушение сохраняется после прекращения снижения веса и что большая степень нарушения липолиза после потери массы тела связана с большей степенью повторного набора веса (рис. 2).
Факторы, связанные с аппетитом
Вполне вероятно, что уровень гомеостатической регуляции массы тела определяется влиянием окружающей среды и поведения, а также их взаимодействием с генетикой [87]. Аппетит имеет как поведенческий, так и биологический аспекты: сигналы, поступающие в тело извне (поведенческие, когнитивные и экологические) и изнутри него (гормональные, нейронные и метаболические), интегрируются для определения потребления энергии. Измерение аппетита во всех его формах является сложной задачей и должно включать оценку силы мотивации к еде, того, как выбор продуктов питания влияет на пищевое поведение, а также гедонистических процессов, которые модулируют гомеостатическую систему в контексте окружающей среды и ежедневных затрат энергии [88]. Кроме того, до конца не ясна роль уровня связанных с аппетитом гормонов в кровотоке, таких как лептин, грелин, холецистокинин, глюкагоноподобный пептид 1 (GLP1), пептид YY, амилин, полипептид поджелудочной железы и желудочно-кишечный пептид (GIP), а также активности афферентных нейронов как до, так и после после еды в качестве биомаркеров. Ожирение может возникнуть из-за сильной тяги к еде, неправильного выбора пищи и/или слабого насыщения после еды, но по каждому из этих факторов существуют большие индивидуальные различия, и в любой популяции, вероятно, будут присутствовать разные фенотипы контроля аппетита [88].
Например, люди, которые не могут набрать вес, даже если хотят (конституционально устойчивые к ожирению), по-видимому, ощущают положительный энергетический баланс после кратковременного переедания, о чем говорят изменения степени голода и насыщения, а также снижение последующего потребления энергии [89]. С другой стороны, лица с высоким риском увеличения веса (люди с ожирением, которые похудели), по-видимому, не ощущают должным образом избыток калорий, связанных с перееданием. Эти результаты сопровождались явными различиями в паттернах активации мозга в ответ на изображения продуктов с высокой или низкой гедонистической ценностью между группами, которые оценивали с помощью функциональной МРТ [89].
В другом исследовании у худых участников внутрижелудочные инфузии глюкозы и липидов вызывали оросенсорно-независимую и независимую от предпочтений, специфичную по отношению к питательным веществам активность нейронов головного мозга и выделение дофамина в полосатом теле. Напротив, у участников с ожирением были серьезно нарушены реакции мозга на постпищевые питательные вещества, что могло вызывать переедание [90]. В систематическом обзоре и метаанализе 2022 года [91] были рассмотрены результаты исследований, посвященных различиям в уровне желудочно-кишечных гормонов, которые участвуют в регуляции аппетита у людей с ожирением или без него. Метаанализ показал, что базальная и постпрандиальная концентрации общего грелина, а также постпрандиальные концентрации пептида YY были ниже у лиц с ожирением, чем у лиц без него, тогда как различий в концентрациях GLP1 и холецистокинина натощак и постпрандиально обнаружено не было. Однако среди проанализированных исследований наблюдалась большая гетерогенность [91]. Связанные с аппетитом сигналы из кишечника прямо или косвенно (через активацию афферентного блуждающего нерва) влияют на центры мозга, участвующие в гомеостатическом приеме пищи, а также в приеме пищи, обусловленном вознаграждением. Желудочно-кишечные гормоны и нервные сигналы, выделяемые во время еды, по-видимому, действуют через ствол мозга, тогда как гомеостатические сигналы — непосредственно через гипоталамус [2]. Развитие ожирения, по-видимому, связано с резистентностью как к лептину, так и к грелину [92].
При потере веса происходят адаптации в системе аппетита, такие как усиление аппетита и пищевого вознаграждения, тяга к еде и оросенсорные ощущения [93], которые имеют тенденцию противодействовать потере веса, сравнимую с адаптацией метаболизма. Кроме того, нарушения нейронных реакций на внутрижелудочное введение питательных веществ у людей с ожирением не восстанавливались после потери веса, вызванной диетой [90]. Параллельно систематический обзор показал, что в большинстве исследований после ограничения энергии наряду с повышением аппетита повышается уровень орексигенного кишечного гормона грелина, а уровень анорексигенного кишечного гормона GLP1, пептида YY, холецистокинина, полипептида поджелудочной железы и амилина снижается [94]. Другой обзор демонстрирует, что, хотя при потере веса в связи с диетой уровень циркулирующего грелина увеличивается, этого не происходит при потере веса, вызванной VLCD и кетогенными диетами. После потери веса концентрации пептидов YY и GLP1 в кровотоке либо снижаются, либо остаются неизменными, в то время как уровень амилина и холецистокинина снижается, а уровень GIP повышается [95]. Однако эффекты потери веса по отношению к уровню гормонов сытости в различных исследованиях сильно не согласуются, что может быть связано с различиями в диете, величиной потери веса, условиями, при которых измерялись концентрации этих гормонов (в состоянии энергетического баланса или вне его) и способах измерения (например, оценивались ли концентрации натощак, после приема пищи, активные или общие концентрации). Концентрация циркулирующего лептина снижается при потере веса, вызванной диетой [96]. Снижение обусловлено сочетанием уменьшения массы жировой ткани и наличием отрицательного энергетического баланса [96]. Оба фактора подавляют секрецию лептина жировой тканью.
Сохранение изменений аппетита, вызванных потерей веса
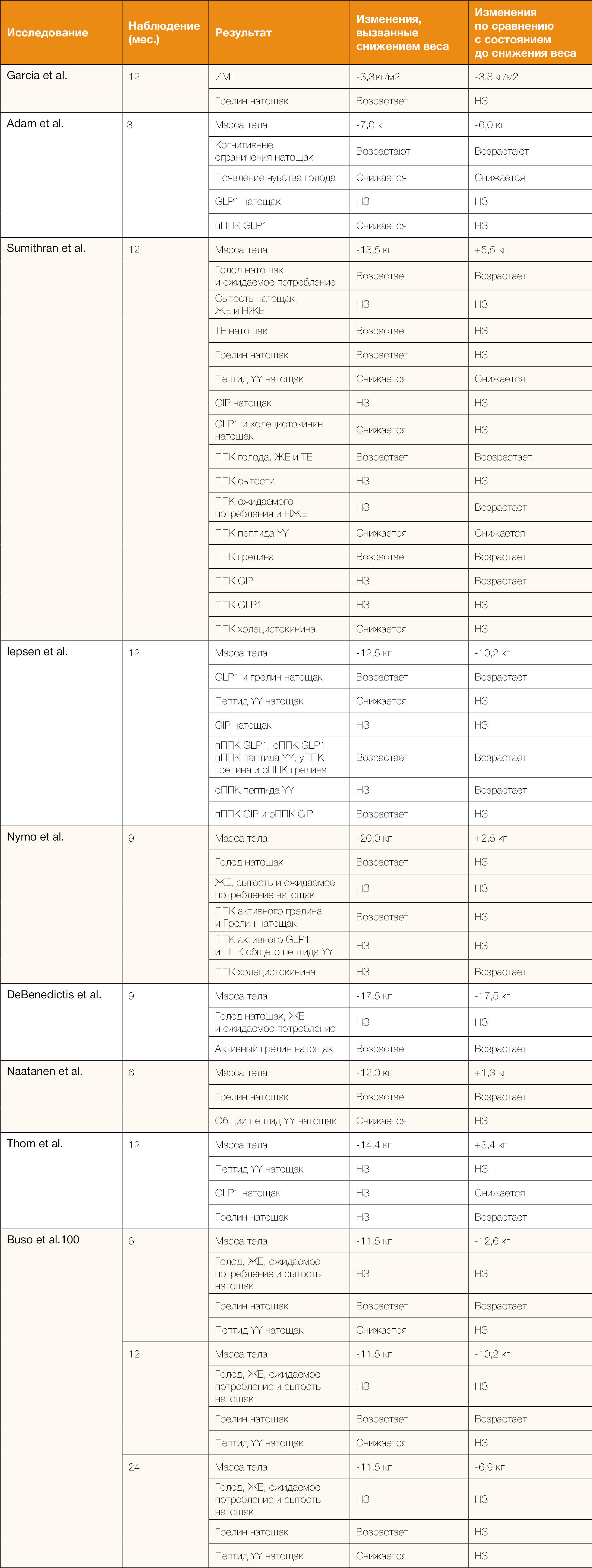
В нескольких исследованиях изучалось сохранение изменений факторов, связанных с аппетитом, после потери веса. В наиболее цитируемом исследовании в этой области, проведенном Sumithran и его коллегами [97], через год после первоначального снижения веса, когда было восстановлено примерно 40% потерянной массы тела, снижение концентрации лептина в плазме натощак (с поправкой на изменения массы жировой ткани) частично сохранялось. Концентрации грелина и полипептида поджелудочной железы в плазме натощак и после еды увеличивались после потери веса и частично сохранялись в течение одного года. Концентрации анорексигенных гормонов пептида YY, холецистокинина и амилина натощак и после приема пищи снижались при потере веса, и эти изменения все еще частично присутствовали через год. По оценке самих участников исследования, голодание и постпрандиальный голод усиливались после потери веса, и это состояние сохранялось в течение одного года. Тем не менее, в литературе имеются значительные противоречия относительно устойчивости вызванных потерей веса изменений факторов, связанных с аппетитом (таблица 1). В некоторых исследованиях обнаружилось, что после первоначальных изменений, вызванных снижением массы тела, происходит возвращение к прежним значениям ряда связанных с аппетитом факторов, несмотря на сохранение (некоторой части) потерянного веса, тогда как другие исследования показали, в соответствии с данными Sumithran и его коллег [97], сохранение некоторых изменений таких факторов после потери веса (таблица 1). Вероятно, существует множество объяснений таких расхождений. Они в том числе могут быть связаны с тем, какие ассоциированные с аппетитом факторы измерялись и при каких условиях (например, энергетический баланс, голодание или постпрандиальный период, уровень ожирения или потеря или восстановление веса, диета, физическая активность и размер выборки). Аналогичные противоречивые результаты были получены в отношении сохранения ощущений аппетита, вызванных потерей веса (таблица 1).
Таблица 1 | Обзор влияния снижения веса, вызванного диетой, и последующее наблюдение за массой тела, субъективными оценками аппетита и гормонами желудочно-кишечного тракта.
Связь с повторным набором веса
На основе систематического обзора литературы по клиническим исследованиям по снижению веса, в которых оценивались изменения уровня лептина и грелина до и после снижения веса, в статье 2014 года [98] был сделан вывод о том, что уменьшение концентрации лептина в крови, повышение концентрации грелина или исходные концентрации этих гормонов и концентрации после воздействия последовательно предсказывали последующий повторный набор веса. В нескольких исследованиях также изучалась прогностическая ценность факторов, связанных с аппетитом, но результаты оказались противоречивыми. Некоторые исследования показали, что будущий набор веса можно предсказать на основе исходного уровня значений после снижения веса или изменения от исходного уровня к значениям после снижения веса [60, 61, 99], хотя в одном из этих исследований [60] связь исчезла после корректировки по возрасту, полу и весу и количеству потерянной массы тела, некоторые ассоциации противоречили здравому смыслу [60, 61], а в других работах другие таких ассоциаций не обнаружили вовсе [100, 101]. В перекрестном исследовании, сравнивающем тех, кто поддерживает пониженный вес, и тех, кто повторно набирает вес, вызванное насыщением ослабление активации мозга (по оценке функциональной МРТ) во время получения вознаграждения в связи с употреблением пищи было обнаружено только у людей, которые поддерживали сниженный вес. Это ослабление было связано с более низким уровнем грелина у участников, которые сохраняли сниженный вес [102].
Таким образом, у людей с ожирением уменьшена базальная и постпрандиальная концентрация циркулирующего грелина, а также снижены концентрации некоторых анорексигенных гормонов по сравнению с таковыми у людей без ожирения. При потере веса на диете с умеренным ограничением энергии, в отличие от ОНКД или кетогенной диеты, концентрация грелина в плазме увеличивается. Влияние потери веса на концентрации анорексигенных гормонов в кровотоке весьма вариабельно: отмечаются повышенные, неизмененные или пониженные значения. Результаты по долговременному сохранению этих изменений при отсутствии отрицательного энергетического баланса также неоднозначны (рис. 2), как и в случае связи с повторным набором веса.
Роль диеты, физических упражнений, фармакотерапии и биомедицинских стратегий в предотвращении повторного набора веса
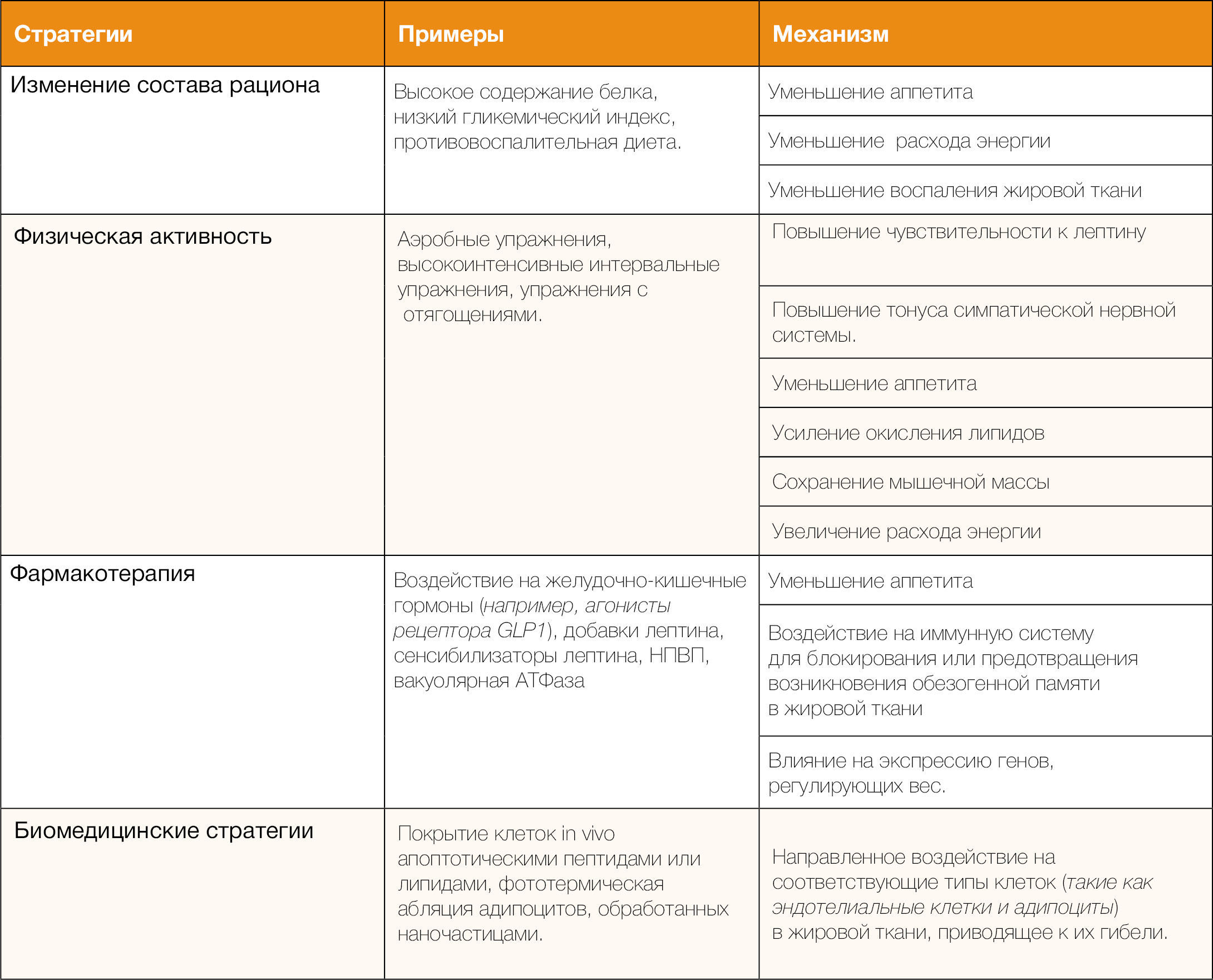
Очевидно, что для достижения лучшего долгосрочного снижения веса и улучшения здоровья людей с избыточным весом и ожирением необходимо более глубокое понимание стратегий предотвращения или ограничения повторного набора веса после похудения (таблица 2). Здесь авторы описывают несколько стратегий снижения или предотвращения повторного набора веса, основанных на физиологических механизмах, обсуждаемых в настоящем обзоре.
Диета
Состав рациона и режимы питания могут влиять на ряд механизмов, связанных с повторным набором веса, таких как аппетит, расход энергии и состав тканей тела. диетические стратегии для предотвращения повторного набора веса авторы рассматривали ранее [1, 103, 104]. В более свежем обзоре 2022 года конкретно рассматривалась роль питания в воспалении [105], хотя и не в прямой связи с предотвращением повторного увеличения массы тела.
Есть некоторые свидетельства того, что более высокое содержание белка в пище в сочетании с более низким гликемическим индексом и/или гликемической нагрузкой связано с уменьшением повторного набора веса [104], но необходимы дополнительные данные о задействованных в этом механизмах. Никакой разницы в наборе веса после его снижения не было обнаружено между диетами, которые содержат изокалорийные количества более насыщающих продуктов, и диетами, которые содержат менее насыщающие продукты [106]. Противовоспалительные диеты (богатые оливковым маслом, помидорами, зелеными листовыми овощами, орехами, жирной рыбой и фруктами, с низким содержанием рафинированных углеводов, жареной пищи, подслащенных сахаром напитков, красного мяса и маргарина — например, средиземноморская диета) могут снизить вероятность повторного набора веса [107], но эту возможность необходимо изучить в рандомизированных контролируемых исследованиях, специально разработанных для проверки этой гипотезы. Кроме того, необходимы дополнительные данные о роли в восстановлении веса после его снижения диетических режимов, таких как ограниченное по времени питание и интервальное голодание через день.
Упражнения
Регулярные физические упражнения (или высокий уровень физической активности) оказывают значительное благотворное воздействие на здоровье, а некоторые механизмы восстановления веса, обсуждавшиеся ранее, ими ослабляются. Физические упражнения могут помочь поддержать потерю веса за счет таких механизмов, как улучшение чувствительности к лептину, повышение тонуса симпатической нервной системы, уменьшение голода, усиление чувства сытости, усиление окисления пищевых жиров и сохранение мышечной массы [108]. Физические упражнения также могут подавлять хроническое воспаление низкой степени тяжести, и этот положительный эффект также наблюдается у людей с ожирением [109].
Данные о потенциальном положительном влиянии физических упражнений на повторный набор веса, опосредованный повышенной чувствительностью к лептину, очень ограничены и получены в исследованиях на животных [110]. Согласно исследованию 2023 года [111], связанная с ожирением резистентность к лептину не устраняется за счет вызванной диетой потери веса самой по себе, поскольку при ней сохраняется воспаление жировой ткани и связанное с ним гипоталамическое воспаление, а также резистентность к лептину. Было показано, что физические упражнения уменьшают гипоталамическое воспаление у животных с ожирением и, согласно суррогатным периферическим маркерам, оказывают аналогичное воздействие на людей с ожирением [112]. Было бы интересно посмотреть, способны ли физические упражнения также уменьшить такое устойчивое воспаление гипоталамуса после потери веса и, таким образом, повысить чувствительность к лептину и тем самым потенциально уменьшить повторный набор веса.
В серии рандомизированных контролируемых исследований изучали роль физических упражнений в различных количествах в сочетании с диетическим вмешательством в долгосрочном (≥1 года) снижении веса у людей. Во многих из этих исследований между группами не было обнаружено различий в долгосрочной потере веса [108, 113, 114], но некоторые исследования показали лучшее долгосрочное снижение веса в группе, занимавшейся физическими упражнениями [115], и что большее количество упражнений связано с большим снижением веса ]116]. Однако рандомизированных контролируемых исследований, в которых участники были рандомизированы для участия в программе поддержания физической активности или ее отсутствия, немного [117–120]. В трех из этих исследований не было обнаружено существенных различий в поддержании веса между группами, выполнявшими упражнения, и контрольной группой [117–119], но одно исследование показало, что восстановление веса в течение одного года было меньше в группе, занимавшейся упражнениями, чем в контрольной группе [120]. В исследовании, в котором участники были рандомизированы после вмешательства по снижению веса на три разных уровня физической активности, между группами не было обнаружено различий в восстановлении веса после его снижения [121].
Апостериорный анализ отрицательных результатов исследований часто показывал, что люди, которые больше занимались спортом, более эффективно теряли вес в долгосрочной перспективе [118, 122–126]. Исследование 1997 года продемонстрировало, что после процедур по снижению веса более высокие затраты энергии в связи с физической активностью, измеренные с помощью дважды меченой воды, предсказывают в дальнейшем меньший набор веса у женщин, вес которых был стабильным в течение одного месяца после процедуры, но которые начали набирать вес впоследствии [127]. Кроме того, было обнаружено, что более высокий уровень физической активности (по сообщениям самих участников) в период наблюдения после процедур по снижению веса связан с меньшим повторным его набором [24, 128, 129]. Лица, которые успешно поддерживали пониженный вес, сообщали о высоком уровне физической активности [130], а также по сравнению с соответствующей по весу контрольной группой затрачивали больше энергии в связи с такой активностью; у них также был выше общий ежедневный расход энергии, измеренный с помощью дважды меченой воды [131]. Последующее снижение физической активности с течением времени у этих людей было связано с повторный набором веса [132].
Хотя данные о причинно-следственной связи ограничены, они позволяют предположить, что физические упражнения и физическая активность могут способствовать лучшему поддержанию веса после его снижения. Тем не менее, в рандомизированных исследованиях существует проблема долгосрочной приверженности процедурам, поскольку некоторые участники контрольных групп могут добровольно увеличить свою физическую активность, в то время как некоторые участники в группе вмешательства, занимающиеся физическими упражнениями, могут быть не в состоянии соблюдать предписанные упражнения, что уменьшает различия между группами. Существуют ли различия в эффективности между различными типами упражнений (например, аэробными упражнениями, высокоинтенсивными интервальными упражнениями, упражнениями с отягощениями или их комбинациями), изучено не было.
Фармакотерапия
Доступная в настоящее время фармакотерапия для лечения ожирения в основном нацелена на систему аппетита. Соответствующие препараты, особенно нового поколения, оказались очень эффективными для долгосрочного снижения веса [133–135]. Ряд исследований затрагивал конкретно влияние терапии агонистами рецепторов GLP1 [120, 136, 137] или последующей отмены препарата [138] на повторный набор веса после его снижения. В исследовании 2013 года участники были рандомизированы на терапию агонистом рецептора GLP1 лираглутидом или плацебо в течение 56 недель после 12-недельного периода снижения веса, в течение которого участники обеих групп потеряли в среднем 6% массы тела на диете с ограничением энергии. По прошествии 56 недель участники группы лираглутида имели значительно меньшую массу тела, чем участники группы плацебо. Тем не менее, этот факт был главным образом обусловлен продолжающейся потерей веса в группе лираглутида, а масса тела в группе плацебо существенно не изменилась [136]. Таким образом, из этого исследования нельзя сделать никаких выводов о влиянии лираглутида самого по себе на восстановление веса. Исследование 2015 года имело аналогичный дизайн, но степень первоначальной потери веса была большей (12%) [137]. По истечении 56-недельного периода поддержания веса масса тела была значительно ниже в группе, принимавшей лираглутид, чем в группе плацебо, но это снова происходило главным образом потому, что потеря веса продолжалась на ранней фазе периода поддержания веса у группы пациентов, получавших лираглутид. После достижения минимальной точки потери веса скорость восстановления веса в группе лираглутида, по-видимому, была не меньше, чем в группе плацебо [137].
Напротив, в исследовании 2021 года [120] в группе лираглутида также наблюдалась некоторая дальнейшая потеря веса на этапе его поддержания, но в этом исследовании восстановление веса после надира снижения оказалось меньшим в группе лираглутида, чем в группе плацебо. Добавление программы упражнений на этапе поддержания веса улучшило его как в группе лираглутида, так и в группе плацебо [120]. Исследование 2021 года показало, что перевод некоторых участников на плацебо после 20-недельного вводного курса лечения семаглутидом, приводивший к потере веса на 10%, вызвал восстановление веса в группе плацебо в течение 48-недельного периода наблюдения, тогда как группа семаглутида потеряла дополнительно 8% массы тела [138].
Rosenbaum и его коллеги обнаружили, что у людей с ожирением замена обычных концентраций лептина низкими дозами может устранить адаптацию, возникшую в результате потери веса на 10% (снижение расхода энергии, насыщения и восприятия количества съеденной пищи). В некоторых исследованиях замена концентраций лептина до уровня, присутствовавшего до снижения веса, приводила к дополнительной потере массы тела [54, 139], но в других исследованиях такое изменение не было статистически значимым [140–142]. Подавляет ли введение лептина повторный набор веса после похудения, непосредственно на людях не проверялось. Однако введение лептина после потери веса крысам с ожирением, вызванным диетой, не предотвратило последующее восстановление веса [143].
Новые препараты против ожирения, которые в настоящее время исследуются для применения у людей, в основном нацелены на систему аппетита и включают двойные и тройные агонисты GLP1, сенсибилизаторы лептина, агонисты Y2-рецепторов, аналоги амилина, фактор роста и дифференцировки 15 и агенты, которые воздействуют на грелиновый путь [38]. Фармакологические варианты для направленного сохранения БЖМ во время снижения веса и для целевого воздействия на вызванную потерей веса метаболическую адаптацию (снижение затрат энергии, окисление СЖК и липолиз) включают способствование утечке протонов из митохондрий и использование разобщителей, воздействия на митохондриальную динамику и биогенез, циклы кальция и субстратов, активность симпатической нервной системы, лептин, потемнение белой жировой ткани, рецептор 75, связанный с G-белком, гормон роста, ингибирование рецептора активина типа II и урокортин 2 и 3 [38, 144, 145].
Исследования на животных выявили несколько способов влияния на регуляцию массы тела, которые можно изучать для поиска новых мишеней с целью предотвращения повторного набора веса. Исследование 2022 года [146] выявило в адипоцитах мышей индуцируемые ожирением гены, экспрессия которых не менялась при потере веса. Для 19 из них нокаут гомологичного гена у червя Caenorhabditis elegans привел к снижению потребления пищи. У мышей, получавших ДВСЖ, нокаут одного из этих генов, ATP6V0A1, кодирующего компонент вакуолярно-АТФазного комплекса, который служит для перекачки протонов через мембраны в нескольких клеточных органеллах за счет гидролиза АТФ, снизило как потребление пищи, так и массу тела. Экспрессия мРНК и белка ATP6v0a1 также увеличивается в адипоцитах людей с ожирением по сравнению с таковыми у худых людей из контрольной группы и сохраняется после потери веса в жировой ткани человека, страдающего ожирением. У мышей, получавших ДВСЖ, которые прошли цикл набора и потери веса, фармакологическое ингибирование вакуолярной АТФазы бафиломицином снижало потребление пищи, уменьшало жировую массу и замедляло восстановление веса.
В качестве препаратов, воздействующих на иммунную систему и снижающих воспаление жировой ткани, которое часто сопровождает ожирение и потерю веса, можно использовать НПВП и глюкокортикоиды. Однако в настоящее время считается, что системное применение таких препаратов сопровождается нежелательными побочными эффектами, такими как нарушение толерантности к глюкозе, накопление липидов в печени и атрофия мышц [147, 148]. В исследовании 2021 года [149] направленно воздействовали на макрофаги мышей дексаметазоном путем конъюгации его с декстраном, который связывается с рецептором маннозы и фагоцитарными рецепторами на поверхности макрофагов. Это привело к созданию препарата, который оказался в 20 раз более эффективным, чем свободное лекарство, о чем свидетельствует подавление воспалительных генов в жировой ткани гонад. У мышей, получивших внутрибрюшинную инъекцию дексаметазона, связанного с декстраном, показали статистически значимую потерю веса через четыре недели, что сопровождалось увеличением уровня циркулирующих СЖК из-за индукции липолиза дексаметазоном [150]. Эти результаты показывают, что воздействие на макрофаги противовоспалительными препаратами может помочь в контроле веса и потенциально уменьшить его повторное увеличение.
Специфические макрофаги в жировой ткани расположены близко к нейронам; они импортируют и расщепляют норадреналин [152, 153]. Ожирение у мышей приводит к повышению уровня этих макрофагов, которые при стимуляции симпатической нервной системы приобретают провоспалительный фенотип. Блокирование поглощения норадреналина макрофагами у мышей вызывает переход белой жировой ткани в бурую, усиление термогенеза и устойчивую потерю веса. Деградация норадреналина макрофагами жировой ткани у мышей усиливается во время старения и может быть ответственна за возрастное увеличение веса [147]. Этот конкретный класс макрофагов также был выявлен у людей [146] и может стать интересной мишенью для контроля веса и предотвращения его повторного набора.
Биомедицинские стратегии
Вместо того, чтобы прицельно воздействовать на макрофаги, можно попытаться контролировать вес, целенаправленно уменьшая массу жировой ткани. В исследовании 2004 года [154], в котором проапоптозным пептидом таргетно воздействовали на эндотелиальные клетки сосудистой сети жировой ткани, общая масса тела экспериментальных мышей за четыре недели снизилась на 30%, тогда как масса их эпидидимальной жировой ткани снизилась более чем на 70%. В исследовании 2022 года [155] адипоциты покрывали частицами золота, модифицированными хоминг-пептидом жировой ткани и фосфатидилсерином. Такое фосфатидилсериновое покрытие (фосфатидилсерин обычно экспонируется во внеклеточную среду только во время апоптоза) приводило к распознаванию адипоцитов как апоптотических клеток, и они подвергались атаке и уничтожению макрофагами. Лечение мышей с ожирением этими частицами через 15 дней привело к снижению массы тела на 24% по сравнению с массой тела до лечения. Для еще более эффективной потери веса были использованы фототермические свойства частиц золота. Брюшную область мышей облучали лазерным светом, вызывая у наночастиц золота фототермический эффект, что приводило к истощению липидных капель из адипоцитов с покрытием и последующим сжатием и некрозом клеток. Благодаря этой процедуре потеря веса достигла 33%. После проведения процедур мышей еще на 15 дней помещали на ДВСЖ. Такие мыши набрали значительно меньший вес, чем все контрольные группы, что демонстрирует потенциал этого подхода для снижения веса и предотвращения его повторного набора.
Таким образом, на восстановление веса после его снижения в некоторой степени могут влиять диета, физические упражнения и доступная в настоящее время фармакотерапия. Однако, чтобы иметь возможность полностью оценить эффективность всех этих стратегий, необходимы более конкретные исследования. Обнаруживаются новые мишени для борьбы с ожирением, основанные на физиологических механизмах, описанных в этой статье, и их следует исследовать не только на предмет влияния на потерю веса, но и на повторный набор массы тела после ее снижения. Учитывая многофакторный характер восстановления веса после его потери, для оптимального решения этой проблемы, скорее всего, потребуется сочетание различных стратегий.
Таблица 2 | Потенциальные стратегии борьбы с повторным набором веса
Заключение
Авторы обзора рассматривают несколько физиологических аспектов, связанных с ожирением, последствия потери веса в связи с изменением образа жизни — в основном в форме диет с ограничением энергии, а также устойчивость таких изменений. Кроме того, авторы искали данные о роли этих физиологических изменений в повторном наборе веса после его потери и обсуждали основанные на них стратегии по ограничению или предотвращению этого явления. Здесь обобщены полученные выводы и приводятся предложения для будущих исследований (Вставка 2).
• Какова роль профиля персистирующих иммунных клеток, индуцированных ожирением, в повторном наборе веса у человека?
• Есть ли разница между индуцируемой потерей веса метаболической адаптацией в виде расхода энергии в покое и 24-часовым расходом энергии и их изменениями в течение времени?
• Что вызывает снижение уровня окисления липидов и липолиза при потере веса? Можно ли им управлять и уменьшает ли оно риск повторного набора веса?
• Как изменения концентрации желудочно-кишечных гормонов натощак и после еды связаны с ощущением аппетита и сытости во время повторного набора веса? Что следует измерить, чтобы получить лучшее представление о роли изменения аппетита в восстановлении веса?
• Следует ли включать чувствительность к желудочно-кишечным гормонам в исследования по восстановлению веса?
• Снижает ли диета, связанная с низким уровнем воспаления, риск повторного набора веса?
• Каковы оптимальный тип и количество физических упражнений, которые могли бы помочь предотвратить повторный набор веса?
• Как физические упражнения или другие вмешательства могут повлиять на устойчивое воспаление гипоталамуса и резистентность к лептину после потери веса, и будет ли снижение воспаления гипоталамуса и резистентности к лептину способствовать предотвращению повторного набора веса?
• Какова эффективность препаратов против ожирения в подавлении повторного набора веса после достижения минимального значения массы тела?
• Можно ли использовать искусственный интеллект для выявления новых мишеней фармакотерапии снижения и восстановления веса, основываясь на имеющихся результатах исследований на животных и с участием людей?
• Существуют ли различные фенотипы повторного набора веса?
В будущих исследованиях по рассматриваемым здесь темам следует обратить внимание на потенциальную разницу между изменениями, вызванными потерей веса, с отрицательным энергетическим балансом и без него, потенциальные половые различия, индивидуальные различия и влияние предыдущего цикла потери веса и его восстановления.
Ожирение сопровождается инфильтрацией макрофагов и других иммунных клеток в жировую ткань. После потери веса часть этого иммунного профиля сохраняется. Ограниченные данные на мышах и людях указывают на то, что такая обезогенная память участвует в риске повторного набора веса. Однако, чтобы охарактеризовать точную комбинацию клеток, которые способствуют ожирению — особенно у людей, — и определить конкретную роль каждого типа клеток в риске повторного набора веса, необходимы дополнительные исследования. До сих пор исследований с участием людей для выяснения того, приводит ли вмешательство в развитие или сохранение обезогенной памяти к улучшению долгосрочных результатов по снижению веса, не проводилось.
Низкий уровень РЭП может предсказать увеличение веса, а в одном исследовании было показано, что более низкий РЭП у людей с ожирением предсказывает большую степень повторного набора веса после его снижения [37]. В целом, снижение расхода энергии в состоянии покоя (также известное как метаболическая адаптация) наблюдается при потере веса на диете с ограничением энергии, но в вопросе сохранения такой метаболической адаптации после восстановления энергетического баланса существуют разногласия. До сих пор нет данных о том, что степень метаболической адаптации, вызванной потерей веса, предсказывает его повторный набор.
Люди с ожирением, как правило, имеют более низкий уровень липолиза и окисления липидов. Потеря веса благодаря диете с ограничением калорий может еще больше ослаблять эти процессы. Есть некоторые свидетельства того, что после прекращения потери веса снижение уровня липолиза и окисления липидов сохраняется, и что степень этого снижения положительно коррелирует со степенью повторного набора массы тела. Стратегией противодействия снижению затрат энергии, липолиза и окисления липидов является увеличение физических упражнений или физической активности. Тем не менее, существует несколько причин, по которым исследования влияния физических упражнений на долгосрочное восстановление веса не всегда убедительны. Одна из них заключается в том, что долгосрочное соблюдение режима тренировок часто бывает проблематичным. Другая причина может состоять в том, что увеличение расхода энергии при физических нагрузках в некоторой степени компенсируется увеличением ее потребления. Эти факты говорят о необходимости в более комплексных стратегиях изменения поведения и окружающей среды, которые облегчают постоянное увеличение физической активности и предотвращают или ограничивают компенсацию за счет усиленного потребления энергии, — например, путем корректировки состава рациона.
Ожирение сопровождается нарушением паттернов концентрации в крови кишечных гормонов, как орексигенных (грелин), так и анорексигенных натощак и после приема пищи. Однако результаты исследований сильно различаются, что может отражать различные фенотипы аппетита, встречающиеся у людей с ожирением. Противоречивыми оказались как данные о влиянии уменьшения массы тела в результате ограничения энергии на концентрацию гормонов кишечника и их сохранение после потери веса, так и свидетельства того, что вызванные потерей веса изменения концентрации гормонов кишечника связаны с его повторным набором. Тем не менее, фармакотерапия, направленная на действие гормонов кишечника, такая как одиночные или двойные агонисты рецептора GLP1, в настоящее время является наиболее эффективным лекарственным средством против ожирения, которое связано со значительной долгосрочной потерей веса. Однако вопрос о том, подавляют ли эти препараты повторный набор веса после достижения его минимального значения, не решен и требует дальнейшего изучения. Существуют и другие новые мишени для фармакотерапии повторного набора веса, основанные на физиологических механизмах, обсуждавшихся выше, и авторы надеются, что в ближайшем будущем будут разработаны новые лекарства, которые также специфически предотвращают этот процесс. На данный момент большая часть данных о роли изменений, вызванных ожирением или потерей веса, в его повторном наборе получена из ассоциативных исследований. Исследования причинно-следственной связи этих изменений в значительной степени отсутствуют, и их необходимо провести, чтобы лучше понять основные механизмы.
Из-за множества факторов, которые участвуют в развитии ожирения, потере веса благодаря образу жизни и его восстановлении, вполне вероятно, что для оптимального управления весом необходимо решить несколько задач. В будущем улучшение жизненных привычек в сочетании с фармакологическим лечением (с применением одного или нескольких препаратов), которое также предотвращает повторное увеличение веса, может помочь в деле поддержания благополучия людей с ожирением и в долгосрочной терапии этого состояния. Более того, учитывая множество факторов, которые регулируют массу тела, вполне вероятно, что существуют разные фенотипы не только ожирения, но и потери и восстановления веса, и персонализация терапии может помочь в дальнейшем повысить ее эффективность. В настоящее время исследования, посвященные повторному набору веса после его снижения, составляют меньшинство среди исследований по контролю веса как с участием людей, так и на лабораторных животных. Влияние повторного набора веса на долгосрочный контроль массы тела и здоровье как отдельных людей, так и населения в целом требует значительно большего внимания со стороны научной и медицинской сферы.
