Раптин — связующее звено между сном и набором веса

Все более возрастающий массив данных свидетельствует о том, что ухудшение сна связано с повышенным риском развития ожирения. Недавно Лин-Ци Се с соавт. (отделение эндокринологии, Медицинская школа Сянъя Центрального Южного университета, г. Чанша, КНР) обнаружили новый гормон, раптин, который выделяется в мозге во время сна, что способствует уменьшению набора веса путем регуляции аппетита.
Согласно последним данным о характере сна, полученным в режиме реального времени, в очередной раз была подтверждена связь плохого качества сна с высокой массой тела и развитием ожирения [1]. В ходе этого нового продленного исследования характера сна с помощью коммерческих портативных устройств удалось точно выявить связь короткой продолжительности сна (< 6 ч) и нарушений сна с повышенным риском возникновения ожирения. Понимание точных механизмов, лежащих в основе этих наблюдений, имеет первостепенное значение, поскольку плохое качество сна и ожирение все больше оказывают влияние на население мира, а также связано с многочисленными нарушениями обмена веществ. По всей видимости, в силу фундаментальной роли в контроле гомеостаза (в том числе, сна и пищевого поведения) [2,3], именно гипоталамус является ключевым местом возникновения наблюдаемой дисрегуляции этих процессов. В гипоталамусе расположен центральный циркадный пейсмекерный механизм — супрахиазматическое ядро (СХЯ) — клеточная активность которого определяется сменой дня и ночи; в свою очередь, СХЯ синхронизирует различные физиологические функции, такие как цикл сна и бодрствования [4]. Кроме того, в гипоталамусе расположены ключевые типы нейронов, которые контролируют гомеостаз питания, массу тела и нейроэндокринную систему. Одним из важных ядер гипоталамуса, в структуре которого находятся популяции нейронов, регулирующие пищевое поведение и, как следствие, влияющие на развитие ожирения, является паравентрикулярное ядро (ПЯ) гипоталамуса [5]. Однако, несмотря на известную роль СХЯ и ПЯ в контроле циркадного ритма и питания, соответственно, остается неясным, связана ли сочетанная дерегуляция этих ядер с развитием ожирения в ответ на нарушения сна.
В новом исследовании, опубликованном в Cell Research, Се с соавт. [6] воспользовались методикой фрагментации сна для идентификации регулируемых белков в гипоталамусе мышей. Авторы определили, что у животных, лишенных сна, наблюдалась сниженная регуляция ретикулокальбина-2 (RCN2). Этот локализованный в эндоплазматическом ретикулуме кальций-связывающий белок в первую очередь экспрессировался в нейронах ПЯ, а во время сна наблюдалась его усиленная экспрессия, что выражалось в циркадном ритме. Поскольку в ПЯ содержатся нейроны, которые опосредованно секретируют гормоны в кровоток, авторы определили содержание продуктов расщепления RCN2 и идентифицировали короткий фрагмент — раптин. Интересно, что пиковые концентрации этого белка в плазме также наблюдались во время сна и у мышей, и у людей. Это свидетельствует о том, что раптин является консервативным гормоном, секреция которого из гипоталамуса индуцируется во время сна. Используя методики вирусного картирования на мышах, авторы обнаружили, что нейроны СХЯ действуют как вышестоящие регуляторы активности нейронов ПЯ, которые экспрессируют RCN2 для стимуляции высвобождения раптина (рис. 1).
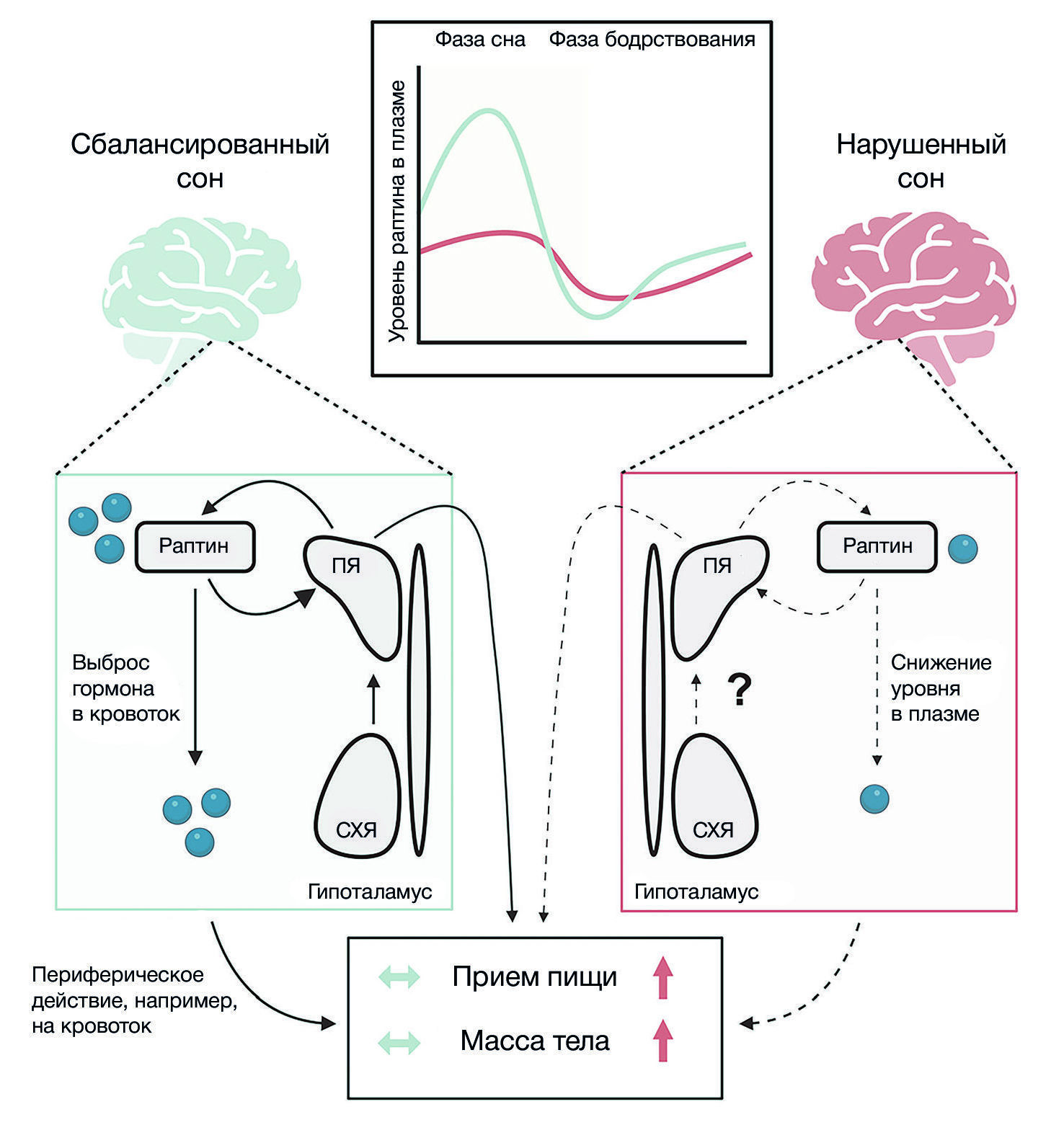
Чтобы оценить роль раптина в регуляции массы тела, авторы вводили этот гормон в мозг мышей, у которых наблюдалась фрагментация сна и его низкое содержание. Это уменьшало набор веса тела (потому что снижалось потребление пищи). В соответствии с подавляющим аппетит действием раптина, повышенная экспрессия RCN2 в ПЯ снижала потребление пищи и набор веса у мышей с фрагментированным сном, тогда как сайт-специфический генетический нокаут увеличивал потребление пищи и вес тела. С точки зрения механизма авторы обнаружили, что раптин снижает потребление пищи, воздействуя на метаботропный глутаматный рецептор GRM3 (mGluR3), активируя нейроны в ПЯ и желудке. Следовательно, раптин, по-видимому, оказывает свое действие по снижению веса тела, действуя как центрально, так и периферически. Наконец, для подтверждения клинической значимости своих выводов авторы изучили функционал раптина у людей. Наблюдалась четкая корреляция пониженного содержания раптина, наблюдаемая у мышей с фрагментацией сна и повышенной массой тела, со сниженным уровнем раптина у людей с ожирением, особенно у лиц с низкой эффективностью сна. Кроме того, у пациентов с ожирением и бессонницей, прошедших курс когнитивно-поведенческой терапии, наблюдалось повышение уровня раптина, снижение потребления пищи и снижение массы тела. Более того, с помощью генетического скрининга авторы выявили трех пациентов с ожирением, обладающих дисфункциональным вариантом гена RCN2, которые страдали синдромом ночного питания (форма расстройства пищевого поведения, характеризующаяся частыми эпизодами потребления пищи среди ночи после пробуждения от сна).
Обнаружение такого вещества, как раптин, несет в себе ряд важных последствий для клинической практики. Во-первых, сильная корреляция между низким уровнем раптина и увеличением веса тела предполагает потенциальный подход к выявлению нарушений сна у пациентов с ожирением. Раннее выявление лиц из группы риска и поощрение их участия в программах КПТ поможет смягчить долгосрочные последствия пагубных сопутствующих заболеваний, связанных с ожирением. Это ставит вопрос о потенциале оценки содержания раптина кровотоке в общеклинических условиях, и будет ли обладать определение раптина в кровотоке какими бы то ни было преимуществами перед методами, используемыми в настоящее время для оценки нарушений сна? Во-вторых, как было установлено на примере мышей, раптин действует центрально и периферически, активируя разные типы нейронов посредством рецептора GRM3. Поскольку терапия раптином улучшила характер питания и остановила набор веса у мышей с фрагментацией сна, обнаружение данного сигнального пути, связанного с G-белком, может служить базой для разработки терапевтических средств для лечения ожирения. Однако, учитывая, что GRM3 широко экспрессируется в мозге и периферических органах, в том числе, и в жировой ткани, потребуются дальнейшие исследования для детализации специфичности и безопасности воздействия на ось раптин-GRM3, особенно в контексте проведенных ранее генетических исследований, в ходе которых были выявлены связи между геном GRM3 и фенотипами, ассоциированными с шизофренией [7]. Наконец, имеются важные наблюдения, что нейроны СХЯ взаимодействуют с нейронами ПЯ, и что стимуляция этого контура приводит к повышению уровня раптина в плазме. Несколько удивительно, что содержание животных в темноте не оказывало влияния на ритмичность секреции раптина. В ходе будущих лабораторных исследований необходимо выявить, как воздействие света на активность СХЯ не влияет на секрецию раптина, и существует ли связь между нерегулярным световым воздействием и циркадным нарушением пищевого поведения. Тем не менее поскольку ожирение представляет собой проблему для здравоохранения из-за ряда метаболических сопутствующих заболеваний, обнаружение раптина будет способствовать разработке новых стратегий, которые помогут людям, страдающим от плохого сна, поддерживать здоровый вес тела.
