Взаимодействие вирусов и бактерий

Два новых исследования предоставляют доказательства и раскрывают механизмы этих взаимодействий, что дает новое понимание микробиологического патогенеза для разработки вакцин.
С появлением современных методов в области молекулярной микробиологии становится очевидно, что легкие не являются стерильными даже при отсутствии заболеваний. Существуют доказательства взаимодействия и коэволюции бактериальных сообществ и иммунной системы позвоночных на протяжении всей истории. Последние данные также свидетельствуют о сходном взаимодействии этих колонизирующих микроорганизмов и эволюции по отношению к патогенезу вирусов.
Это особенно актуально в случае взаимодействия между вирусом гриппа и бактерией Streptococcus pneumoniae, так как коинфекция этими двумя микроорганизмами приводит к более резкому прогрессированию заболевания и увеличению смертности, чем заражение только одним из этих патогеном.
Два новых исследования, опубликованных в Nature Microbiology, предоставляют доказательства взаимодействия между Streptococcus pneumoniae и вирусом гриппа. Это важно не только для понимания патогенеза, но и для разработки эффективных вакцин против таких инфекций.
Rowe и соавторы предоставляют косвенные доказательства физического взаимодействия между Streptococcus pneumoniae и вирусом гриппа путем их совместной седиментации и прямые доказательства связывания вируса с бактериями, используя штамм гриппа, экспрессирующий флуоресцентный белок mRuby2.
Чтобы изучить влияние прямого связывания вируса и бактерии на респираторную инфекцию, ученые продемонстрировали повышенную адгезию вирусно-бактериального комплекса к культивируемым in vitro линиям эпителиальных клеток человека и мышей, которым интраназально инокулировали только Streptococcus pneumoniae или Streptococcus pneumoniae, прединкубированных с вирусом гриппа (рис. 1, левая панель).
.
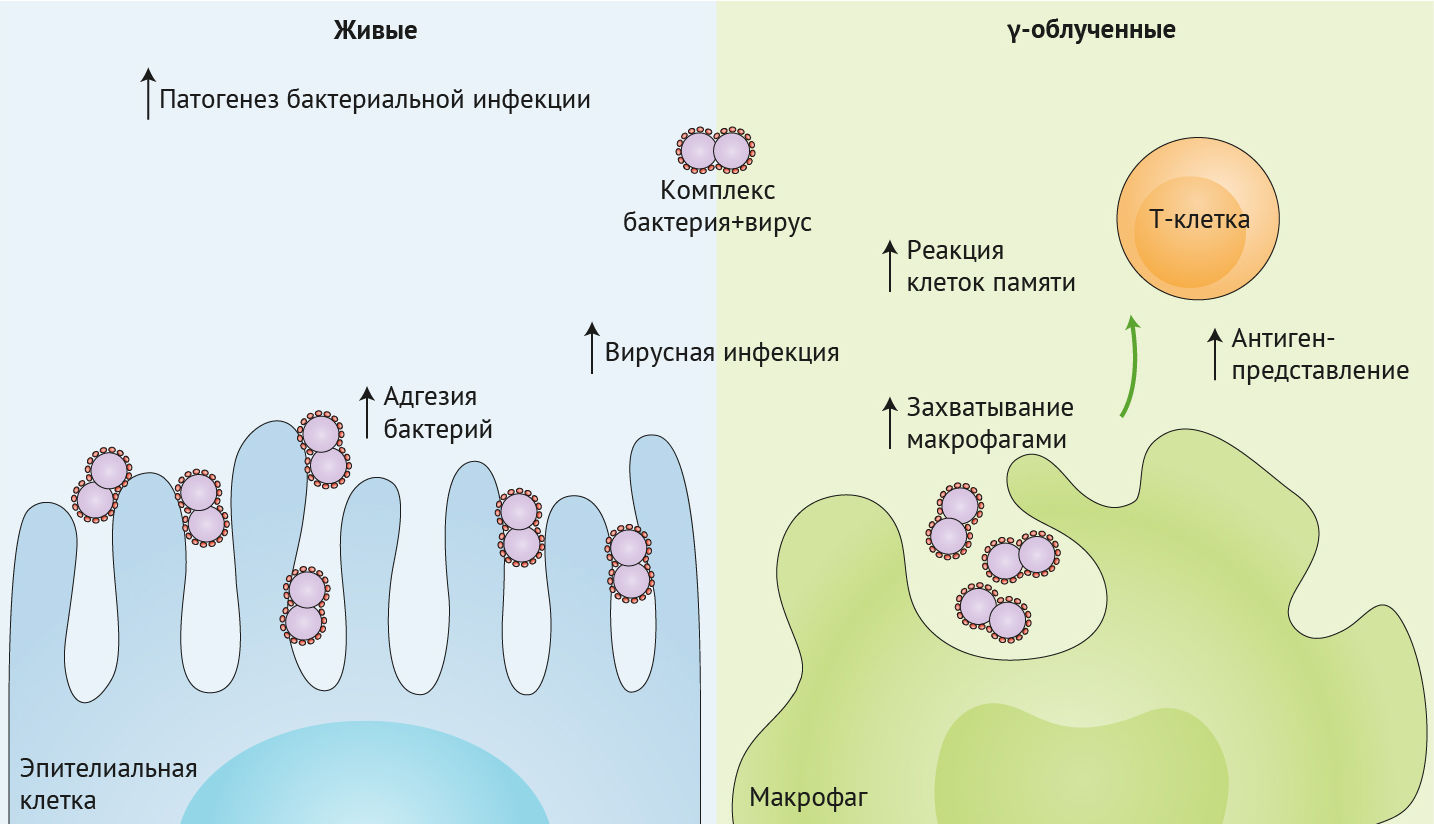
Когда и Streptococcus pneumoniae, и вирус гриппа были облучены γ-лучами, непосредственное связывание между этими двумя патогенами все еще было очевидно, что привело к увеличению поглощения макрофагами. Мукозальная вакцинация мышиной модели этим γ-облученным комплексом патогенов способствовала усилению резидентной памяти и действия Т-клеток легких на вирус гриппа, что, возможно, произошло в результате увеличения антиген-презентации макрофагами (правая панель).
Всего через 24 часа отмечен рост Streptococcus pneumoniae в носовых ходах и среднем ухе у мышиных моделей, которым предварительно инокулировали комплекс, включающий Streptococcus pneumoniae и вирус гриппа. В данном случае рост был более интенсивным, чем при инокулировании двух патогенов без предварительной инкубации. Вследствие этого повышенного связывания комплексных патогенов скорость развития инфекции и смертность значительно увеличились.
Интересно, что увеличение смертности не было связано с повышенной бактериемией. Это позволяет предположить, что прогрессирование заболевания может быть результатом цитокиновой бури в дыхательных путях. Но остается вопрос, как бактериально-вирусное взаимодействие приносит пользу вирусу.
David и его коллеги из Австралии решили изучить этот вопрос. Они представляют электронные микрофотографии для подтверждения факта прямого связывания гриппа с гамма-облученным штаммом Streptococcus pneumoniae и демонстрируют, что этот комплекс повышает способность гриппа инфицировать клетки Мадин-Дарби почек собак (MDCK) (рис. 1, левая панель). Ученые не выяснили, было ли это прогрессирование вирусной инфекции вызвано повышенной адгезией бактериально-вирусного комплекса к клеткам MDCK, но продемонстрировали, что комплекс способствует лучшему захвату и интернализации вируса гриппа макрофагами THP-1 (рис. 1, правая панель).
Есть предположение, что взаимодействие вируса гриппа и Streptococcus pneumoniae способствует заражению организма-хозяина обоими организмами, но можно ли использовать это взаимодействие для усиления иммуногенности к этим патогенам? Группа австралийских ученых ранее продемонстрировала, что совместная мукозальная вакцинация с помощью γ-облученного гриппа A/Puerto Rico/8/1934 (PR8) H1N1 (γ-Flu) и γ-Spn обеспечивает значительную защиту от летальной коинфекции и увеличение специфической реакции на Streptococcus pneumoniae. Данная статья посвящена исследованию специфического иммунитета против гриппа, возникающего в результате интраназальной инокуляции γ-Flu-γ-Spn.
Через три недели после вакцинации γ-Flu-γ-Spn David и соавторы провели эксперимент с заражением мышей смертельной дозой вируса гриппа штамма PR8. Неудивительно, что мыши, вакцинированные одним γ-Flu или γ-Flu-γ-Spn, были полностью защищены в течение трех недель после заражения, тогда как мыши, которые были вакцинированы только одним γ-Spn, умерли в течение первой недели. Мыши, вакцинированные только одним γ-гриппом или γ-гриппом-γ-Spn, также были защищены от последствий смертельного заражения недавним пандемическим штаммом H1N1 2009 года.
Важно отметить, что только мыши, вакцинированные γ-Flu-γ-Spn, были полностью защищены от заражения гетероподтипом H3N2, в то время, как среди мышей, вакцинированных одним γ-Flu, смертность составляла 40 %. Авторы исследования продемонстрировали, что эта совместная вакцинация не была связана с различием реакции нейтрализующих антител и циркулирующих Т-клеток. В отличие от этого, вакцинация γ-Flu-γ-Spn значительно усиливала резидентную память CD4+ и CD8+ T-клеток в легких, которые необходимы для противостояния инфекции гриппа (рис. 1, правая панель).
Такие взаимодействия не ограничиваются Streptococcus pneumoniae. Rowe и соавторы также предоставляют доказательства прямого взаимодействия вируса гриппа с другими респираторными микроорганизмами, такими как нетипируемые Haemophilus influenzae (NTHi) и Moraxella catarrhalis. Эти данные могут объяснить тот факт, что пациенты с хронической обструктивной болезнью легких, которые колонизированы NTHi, в три раза чаще испытывают обострение своего заболевания после вирусной инфекции, чем пациенты без NTHi.
В обоих исследованиях есть недостатки. Большинство наблюдений основаны на экспериментах in vitro или на моделях летальных животных, а не на моделях, которые воспроизводят человеческие заболевания. Над отчетом David и соавторов потребуется провести дополнительную работу — продемонстрировать продолжительность защиты, прежде чем транслировать в массы эти наблюдения.
Обе статьи также посвящены взаимодействию между бактериями и вирусом гриппа А, без упоминания о штаммах гриппа В, хотя штаммы В являются распространенной причиной гриппа. Но эффективность применения комбинированной вакцины впечатляющая, эти результаты можно использовать для разработки вакцины против респираторно-синцитиального вируса, который, как уже известно, непосредственно связывается с Streptococcus pneumoniae. Если перекрестная защита от гетеросубтипических штаммов подействует на риновирус, то, возможно, есть надежда создать вакцину от простуды.
Разработка вакцин — важная задача будущего, но пока наблюдения ученых должны заставить нас обратить внимание на респираторные инфекции. Несмотря на то, что заражение одним патогеном все еще может быть уместными во многих случаях, учитывая наличие микробиоты в легких, модели сочетанной инфекции, а не последовательной инфекции, ближе к реальной картине.
