Патофизиологические основы терапии рассеянного склероза
Рассеянный склероз (РС) — хроническое прогрессирующее заболевание центральной нервной системы с многоочаговой неврологической симптоматикой. Традиционно РС считается патологией белого вещества, однако очаги демиелинизации встречаются во всех отделах ЦНС, включая серое вещество коры и подкорковых ядер. Тяжесть течения и высокая степень инвалидизации определяется тремя основными компонентами: аутоиммунным (активация аутореактивных Т- и В-лимфоцитов), демиелинизирующим (деструкция миелина, обеспечивающего защиту аксонов и высокую скорость проведения нервного импульса), нейродегенеративным (гибель нервных волокон).
В клинической картине периоды обострений (появление новой неврологической симптоматики, выявляемой при клиническом обследовании, или усиление имевшихся ранее симптомов, продолжающееся более 24 часов) могут чередоваться с периодами ремиссии (отсутствие новой неврологической симптоматики) — такая волнообразная форма называется ремиттирующей. Далее она переходит во вторично-прогрессирующую форму с постоянным нарастанием тяжести симптомов. У 10–15 % пациентов наблюдается первично-прогрессирующая форма РС, при которой степень инвалидизации непрерывно увеличивается с момента дебюта заболевания без периодов острых обострений и угасания симптоматики [1].
Сложность основных патогенетических механизмов, отсутствие репрезентативных исследовательских моделей и противоречивые критерии, определяющие терапевтическую пользу, являются основными причинами, по которым эффективная терапия прогрессирующих форм РС все еще отсутствует.
Основа патогенеза РС — хроническое воспаление, которое возникает за пределами гематоэнцефалического барьера, с активацией микроглии и нарастающим вовлечением Т- и В-лимфоцитов. Постоянное высвобождение активных форм кислорода (АФК) и азота (АФА) обусловливает повреждение митохондрий в нейронах и глиальных клетках. Нарастает дефицит энергии, что в конечном итоге приводит к нейродегенерации. Более того, нервные волокна, лишенные миелина, изменяют спектр ионных каналов, что также способствует дегенеративным изменениям. Поддержание воспалительной активности нарушает ремиелинизацию, что усугубляет повреждение нервных волокон [2].
В настоящее время появляются новые стратегии лечения РС, которые нацелены на стимулирование иммунных реакций, предотвращение гибели нервных клеток (нейродегенерации), а также восстановление миелиновой оболочки аксонов (рис.1) [3].
.
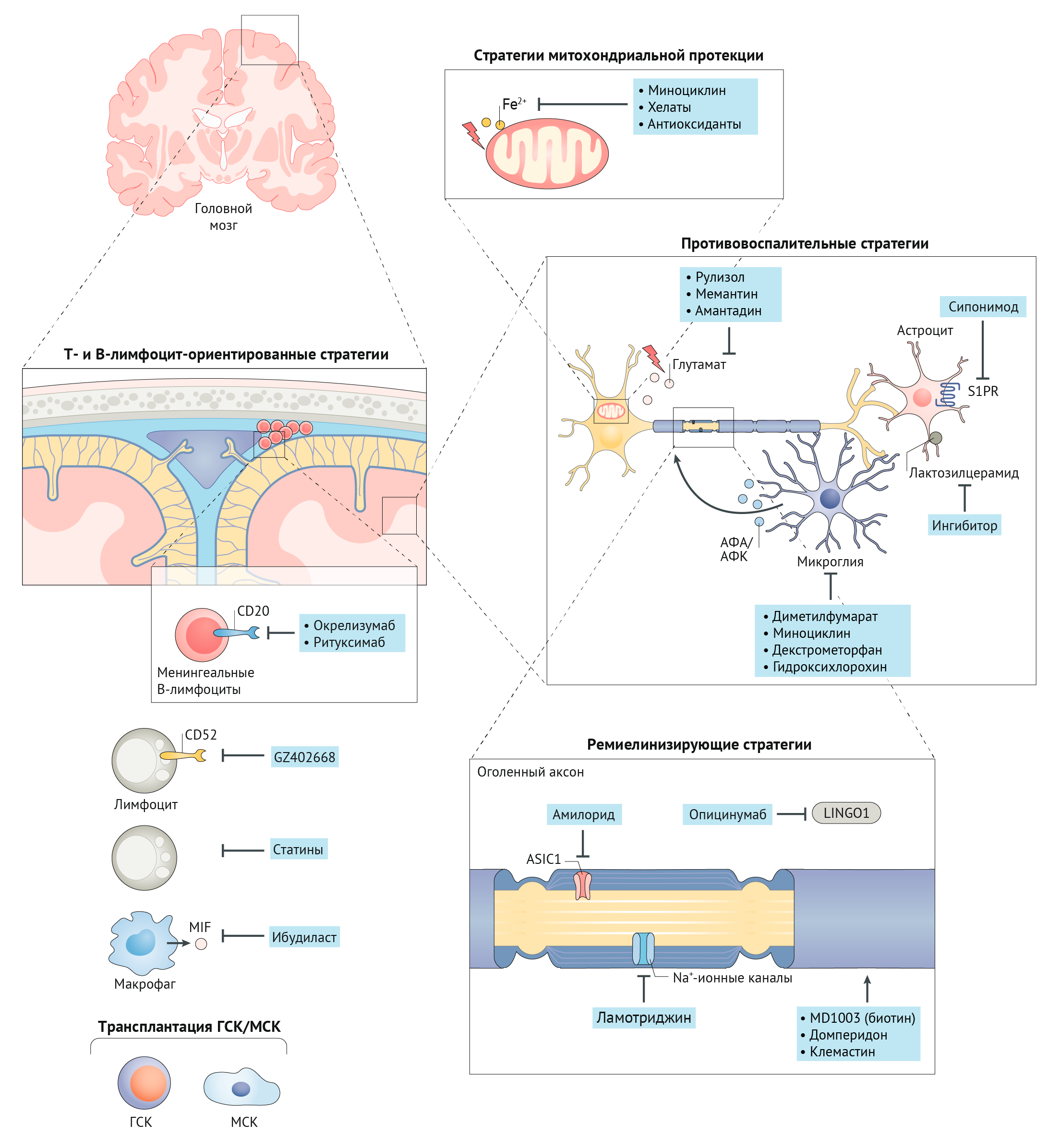
— использование миноциклина (полусинтетический антибиотик группы тетрациклинов),
— применение хелатообразующих соединений, связывающих ионы железа Fe2+ (дефероксамин, деферипрон и деферазирокс);
— использование антиоксидантов, уменьшающих окислительный стресс.
Противовоспалительные стратегии, нацеленные на микроглию и астроциты:
— селективный модулятор рецептора сфингозин-1-фосфата (S1PR) сипонимод, который лицензирован Управлением по контролю за качеством пищевых продуктов и медикаментов (FDA) США в качестве терапии для вторично-прогрессирующего рассеянного склероза (ВПРС);
— ингибиторы иммунной клеточной активности микроглии: диметилфумарат, миноциклин, декстрометорфан и гидроксихлорохин, АФА (активные формы азота), АФК (активные формы кислорода).
Аксон-протективные стратегии, основанные на регуляции работы протон-активируемых ионных каналов:
— амилорид (калий-сберегающий диуретик) блокирует кислоточувствительный канал 1 (ASIC1), активность которого повышена в аксонах и олигодендроцитах пораженных участков;
— ламотриджин (блокирует натриевые каналы).
Ремиелинирующая терапия:
— опицинумаб — полностью человеческое моноклональное антитело, блокирующее нейрональный белок 1, содержащий иммуноглобулиноподобный домен и богатые лейцином повторы, LINGO1 (в активном состоянии этот белок ингибирует дифференцировку олигодендроцитов и их способность к миелинизации аксонов);
— домперидон (повышает уровень пролактина);
— клемастин (антигистаминный препарат первого поколения, блокирует мускариновые рецепторы);
— MD1003 (биотин, витамин Н) в высоких дозах способствует ремиелинизации, благодаря своей функции кофермента для карбоксилаз, необходимых для синтеза миелиновых липидов.
Т- и В-лимфоцит-ориентированные стратегии:
— окрелизумаб — препарат на основе гуманизированных моноклональных антител к CD20 на поверхности В-лимфоцитов (одобрен для терапии первичного прогрессирующего рассеянного склероза, ППРС);
— ритуксимаб;
— препарат нового поколения анти-CD52-гуманизированных моноклональных антител GZ 402668;
— ибудиласт — ингибитор фосфодиэстеразы и фактора, ингибирующего миграцию макрофагов (MIF).
Трансплантация стволовых клеток:
— гемопоэтических стволовых клеток (ГСК);
— мезенхимальных стволовых клеток (МСК);
Обеспечивает иммуномодуляцию и нейропротекцию (влияние на дифференцировку нейральных клеток-предшественников) [3].
Таргетирование нейровоспалительных процессов
Воспалительный компонент при прогрессирующих формах РС отличается от такового при ремиттирующем течении. Клеточный инфильтрат паренхимы ЦНС при прогрессирующем заболевании в меньшей степени представлен Т-клетками. При этом они накапливаются в мягкой мозговой оболочке. Основная популяция клеток воспалительного инфильтрата в ЦНС — моноциты, которые далее дифференцируются в макрофаги, опосредуя локальную активацию микроглии с нарастанием деструкции нервной ткани [3].
Контроль популяции Т-лимфоцитов при прогрессирующем РС остается сложным вопросом. Основным направлением является использование моноклональных антител. Например, в клиническом исследовании фазы III ASCEND применение натализумаба — селективного ингибитора молекул адгезии, связывающегося с α4-субъединицей человеческого интегрина, не привело к снижению инвалидизации (по сравнению с группой плацебо) у пациентов с вторично-прогрессирующим РС.
При прогрессирующем рассеянном склерозе отмечается противовоспалительное действие статинов. Симвастатин способствует трансформации провоспалительного фенотипа Т-хелперов 1 (Th1) в противовоспалительный фенотип Th2. Также отмечалось снижение популяции Тh1 и Th17 и ингибирование перехода Тh17 в CD4+ Т-лимфоциты (потенциально агрессивные к антигенам миелина) in vitro [3]. Показано, что терапия статинами уменьшает атрофию белого вещества при прогрессирующем течении [4], но не оказывает значимого влияния при наличии в клинической картине острых симптомов: согласно данным Кокрановского обзора, комбинация симвастатина или аторвастатина с интерфероном не снижала частоту рецидивов, скорость прогрессирования заболевания или развитие МРТ-признаков активности воспалительного процесса [5].
Трансплантация стволовых клеток рассматривается как «перезагрузка» собственной иммунной системы. Формирование клонов патологических лимфоцитов происходит не на уровне полипотентных стволовых клеток, а при их дальнейшей дифференцировке. Иммуносупрессия с помощью высокодозной химиотерапии позволяет использовать клетку-предшественницу для нового пула здоровых лимфоцитов. Также используются стволовые клетки мезенхимального происхождения. Они имеют выраженное иммуномодулирующее действие. На фоне ингибирования Т-клеточного ответа, снижения экспрессии CD4+-активационных маркеров, CD25+, CD38+, CD69 и Т-клеточной активации наблюдается увеличение популяции Т-reg, ограничение пролиферации В-лимфоцитов и подавление продукции интерферона, интерлейкинов 4 и 10 [6].
Таргетирование В-лимфоцитов
При аутопсийном исследовании пациентов с вторично-прогрессирующими формами РС в образцах ткани мозговых оболочек обнаружена выраженная воспалительная инфильтрация с примесью большого количества В-клеток, на отдельных участках формирующих эктопичные лимфоидные фолликулы [7]. Наличие менингеальных В-клеток сочетается с субпиальной демиелинизацией серого вещества и микроглиальной активностью в корковых структурах [8].
Для контроля В-клеточной популяции используются моноклональные антитела. При использовании ритуксимаба (анти-CD20 антитело) отмечалось истощение очагов инфильтрации периферических В-лимфоцитов при интратекальном введении и при комбинации его с внутривенным [9].
Комбинированной активностью обладают анти-CD52 антитела, которые воздействуют как на Т-, так и на В-лимфоциты. Помимо применяемого в настоящее время алемтузумаба, к препаратам этой группы относится GZ402668. Это вещество связывается с различными эпитопами CD52, позволяя также уменьшить уровни фактора некроза опухоли и интерферона-γ [10].
Таргетирование миелоидо-микроглиальной активности
Эта группа клеток является основным поставщиком активных форм кислорода и азота, провоспалительных цитокинов и хемокинов. К ингибиторам макрофаго-микроглиальной активности относятся гидроксихлорохин — противомалярийное лекарственное средство, которое блокирует липополисахарид-индуцированную продукцию провоспалительных цитокинов в микроглии. Соединение MIS416 создано при помощи методов биоинженерии и содержит два встречающихся в природе лиганда — нуклеотид-связывающий домен олигомеризации, включающий белок 2 (NOD2) и толл-подобный рецептор 9 (TLR9). Они взаимодействуют с цитозольными рецепторами миелоидных клеток, активируя сигнальные каскады, стимулирующие низкую выработку воспалительных цитокинов. [11].
Также отмечена активность препарата ибудиласт. Это неселективный ингибитор фосфодиэстераз 3, 4, 10 и 11, функциональный антагонист TLR4, блокатор фактора ингибирования миграции макрофагов (MIF). Ибудиласт обладает способностью ослаблять активность активированных глиальных клеток, смещая цитокиновый баланс в противовоспалительную сторону [12].
Для воздействия на агрессивные формы кислорода оправдано использование различных веществ с антиоксидантной активностью, например, липоевой кислоты или диметилфумарата, который обладает цитопротекторным действием. Также оправдывают себя стратегии антицитокиновой терапии [3].
Астроциты вносят большой вклад в поддержание хронического воспаления. Это наиболее распространенная популяция клеток в ЦНС, играющая значительную роль в патофизиологии РС из-за стимулирования склеротических процессов и высвобождения медиаторов воспаления. Для перехода нормальных астроцитов на «темную сторону» они должны быть активированы (А1). Такая «вербовка» осуществляется микроглиальной секрецией интерлейкинов, фактора некроза опухоли и комплемента C1q. В астроцитах гликосфинголипид лактозилцерамид способен стимулировать синтез хемокиновых фрагментов и гранулоцит-макрофаг-колониестимулирующего фактора, что поддерживает патологическую активность микроглии и макрофагов. Ингибирование лактозилцерамида ассоциировалось со снижением нейродегенерации.
Альтернативным методом воздействия на астроциты является модуляция плейотропного сфинголипидного медиатора сфингозин-1-фосфата (S1P). Этот биоактивный лизофосфолипид также регулирует циркуляцию лимфоцитов в крови и, в частности, выход Т- и В-клеток из лимфатических узлов. Для ремиттирующих форм подтверждена эффективность финголимода, подавляющего функцию S1P-рецепторов в лимфоцитах, что замедляет выход лимфоцитов из лимфатических узлов. Это в свою очередь снижает рециркуляцию Т-клеток в ЦНС, ограничивая воспаление и, соответственно, степень повреждения нервной ткани [13]. При вторично-прогрессирующем РС в снижении скорости инвалидизации отмечена эффективность сипонимода — селективного модулятора рецептора сфингозин-1-фосфата [14].
Обеспечение нейропротекции является ключевой задачей для уменьшения дегенерации аксонов и гибели нейронов. Основными целями нейропротективной терапии служат нормализация гомеостаза железа в мозговой ткани, регуляция экспрессии ионных каналов и коррекция повреждения митохондрий (рис. 1) [3].
Необходимо отметить, что одна из проблем выбора терапии прогрессирующего рассеянного склероза заключается в непоследовательных критериях эффективности, используемых в разных клинических исследованиях. Зачастую исследования опираются на различные цели, что означает, что терапевтический успех понимается и оценивается индивидуально в каждом отдельном случае. В идеале должны применяться единые критерии для сопоставимости результатов и обеспечения их достоверности.
Источники:
- Lassmann H. Pathogenic mechanisms associated with different clinical courses of multiple sclerosis. Front- Immxxnol.2018; 9: 3116.
- Reich D. S., Lucchinetti C. F., Calabresi P. A. Multiple sclerosis. N- Engl- J- Med. 2018;378:169–180.
- Faissner S., Plemel J.R., Gold R., Yong V.W. Progressive multiple sclerosis: from pathophysiology to therapeutic strategies. Nat Rev Drug Discov. 2019 [Epub ahead of print].
- Chataway J. et al. Effect of high-dose simvastatin on brain atrophy and disability in secondary progressive multiple sclerosis (MS-STAT): a randomised, placebo- controlled, phase 2 trial. Lancet. 2014;383:2213–2221.
- Wang J.et al.. Statins for multiple sclerosis. Cochrane Database Syst- Res. 2011;12: CD008386.
- Muraro P. A. et al. Long-term outcomes after autologous hematopoietic stem cell transplantation for multiple sclerosis. JAMA Nexxrol.2017;74:459–469.
- Magliozzi R. et al. B-cell enrichment and Epstein-Barr virus infection in inflammatory cortical lesions in secondary progressive multiple sclerosis. J- Nexxropathol- Exp- Nexxrol. 2013;72:29–41.
- Choi S. R. et al. Meningeal inflammation plays a role in the pathology of primary progressive multiple sclerosis. Brain. 2012;135:2925–2937.
- Naegelin Y. et al. Association of rituximab treatment with disability progression among patients with secondary progressive multiple sclerosis. JAMA Nexxrol.2019;76:274-281.
- Siders W. et al. GZ402668, a next-generation anti-CD52 antibody, displays decreased
proinflammatory cytokine release in vitro. Nexxrology;86 (Suppl. 16): P3.068. - White M. et al. Targeting innate receptors with MIS416 reshapes Th responses and suppresses CNS disease in a mouse model of multiple sclerosis. MLRWS RWNE. 2014;9:e87712.
- Cho Y. et al. Allosteric inhibition of macrophage migration inhibitory factor revealed by ibudilast. Mroc- Natl Acad- Sci- USA. 2010;2010107:11313–11318.
- Bigaud M. et al. Second generation S1P pathway modulators: research strategies and clinical developments. Biochim- Biophys- Acta. 2014;1841:745–758.
- Kappos L.et al.EXPAND Clinical Investigators. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double-blind, randomised, phase 3 study. Lancet. 2018;391(10127):1263-1273.
