Неалкогольная жировая дистрофия печени
Неалкогольная жировая дистрофия печени была впервые описана как отдельная клиническая единица четыре десятилетия назад. Тем не менее, она стала центром внимания гепатологов из-за высокой распространенности и возрастающего влияния на прогрессирование болезни печени до терминальной стадии. В связи с этим, в данной статье предлагается к прочтению обзор информации.
Неалкогольная жировая дистрофия печени (НАЖДП) вызвана накоплением жира в печени; состояние может прогрессировать с течением времени, увеличивая риск развития цирроза и гепатоцеллюлярной карциномы. Распространенность быстро растет из-за глобального распространения ожирения и сахарного диабета 2 типа; по расчетам ученых НАЖДП станет показанием номер 1 для трансплантации печени в течение следующего десятилетия.
.
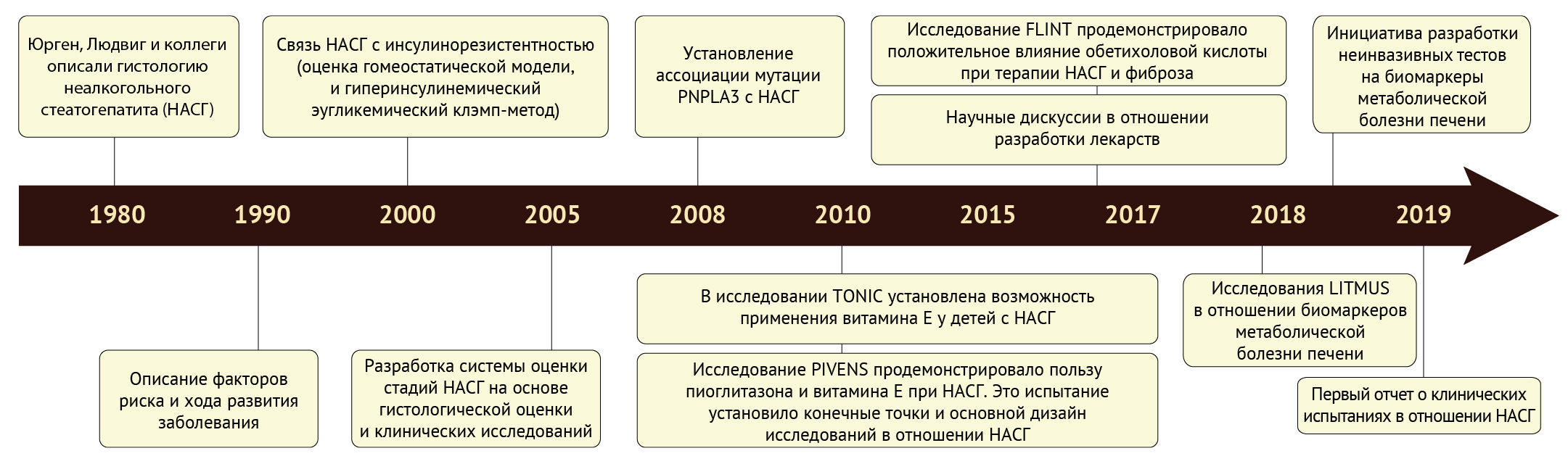
Рисунок 1. Хронология основных событий в мире науке, связанных с неалкогольной жировой дистрофией печени
Уже сейчас неалкогольная жировая болезнь печени является самой распространенной хронической болезнью печени во всем мире. Ученые оценили распространенность, частоту и результаты НАЖДП среди населения Азии, проведя анализ исследований, в которых сообщалось о распространенности, заболеваемости и исходе НАЖДП в PubMed, EMBASE и Кокрановской библиотеке с момента создания ее базы данных до 17 января 2019 года. Были учтены только те исследования, которые охватывали разные группы людей и многолетние обсервационные исследования пациентов с НАЖДП, диагностированной по УЗИ, показателям сыворотки крови или биопсии печени. Двое ученых независимо друг от друга проверяли и анализировали данные. Суммарные оценки были рассчитаны с использованием модели со случайными эффектами. Исследование зарегистрировано в PROSPERO, номер CRD42018088468.
Для анализа были отобраны 237 исследований (13 044 518 участников). Общая распространенность НАЖДП, независимо от метода диагностики, составила 29,62 %. Распространенность НАЖДП значительно увеличивалась с течением времени (25–28 % в период с 1999 по 2005 год, 28,46 % в период с 2006 по 2011 год и 33,90 % между 2012 и 2017). Суммарный годовой уровень заболеваемости НАЖДП составил 50,9 случая на 1000 человеко-лет. У пациентов с НАЖДП ежегодная заболеваемость гепатоцеллюлярной карциномой составила 1,8 случаев на 1000 человеко-лет , а общая смертность — 5,3 на 1000 человеко-лет. Распространенность НАЖДП в мире и особенно в Азии растет и связана с плохими исходами, включая гепатоцеллюлярную карциному и смерть.
Также становится все более очевидным, что НАЖДП не только влияет на печень, но также может увеличить риск развития других заболеваний, включая СД 2 типа, сердечно-сосудистые заболевания и хронические заболевания почек (ХБП), которые являются распространенной проблемой здравоохранения. Накопленные данные свидетельствуют о том, что НАЖДП усиливает резистентность к инсулину, предрасполагает к атерогенной дислипидемии и способствует высвобождению различных провоспалительных факторов, протромботических факторов и профиброгенных молекул, которые могут способствовать повреждению тканей сосудов и почек. Кроме того, взаимовлияние пораженных органов или тканей друг на друга при этих заболеваниях может привести к дальнейшему нарушению функции и ухудшению прогнозов лечения. Все больше фактических данных указывает на тесную связь между НАЖДП и ХБП. Существуют причинно-следственные связи между НАЖДП и ХБП или нет — еще предстоит установить окончательно.
Клиника
НАЖДП — это термин, который охватывает весь клинико-патологический спектр заболеваний печени, начиная от простой жировой инфильтрации более 5 % гепатоцитов (простой стеатоз печени), до жировой инфильтрации, совмещенной с воспалением (неалкогольный стеатогепатит; НАСГ) до прогрессирующего фиброза и, в конечном счете — цирроза, который может прогрессировать до гепатоцеллюлярной карциномы.
Диагноз НАЖДП основан на трех критериях:
- стеатоз печени, подтвержденный на УЗИ или гистологически;
- умеренное потребление алкоголя — обычно 20 г в день для женщин и 30 г в день для мужчин;
- отсутствие конкурирующих причин для стеатоза печени (таких как вирусы, лекарства, избыток железа или аутоиммунитет).
В целом, клинические признаки и симптомы заболевания печени отсутствуют у большинства пациентов с НАЖДП на момент постановки диагноза; умеренная гепатомегалия часто является единственным признаком, хотя некоторые пациенты сообщают об усталости и чувстве сытости или дискомфорта в животе. У значительного числа пациентов с НАЖДП наблюдаются типичные признаки метаболического синдрома (абдоминальное ожирение, атерогенная дислипидемия, гипертония, резистентность к инсулину, непереносимость глюкозы или сахарный диабет 2 типа).
Наиболее распространенной и часто единственной патологией, обнаруживаемой при лабораторных исследованиях у пациентов с НАЖДП, является умеренно повышенный уровень ферментов печени в сыворотке (аминотрансферазы и γ-глутамилтрансферазы). Другие нарушения (например, тромбоцитопения, повышение уровня билирубина и увеличение протромбинового индекса) могут быть обнаружены у пациентов с более запущенной дистрофией (например, цирроз). Однако уровень ферментов печени в сыворотке не является надежными маркером для скрининга и диагностики НАЖДП и поэтому не должен интерпретироваться без дальнейшего исследования. У пациентов с нормальными уровнями ферментов печени в сыворотке крови вполне может быть диагностирована НАЖДП.
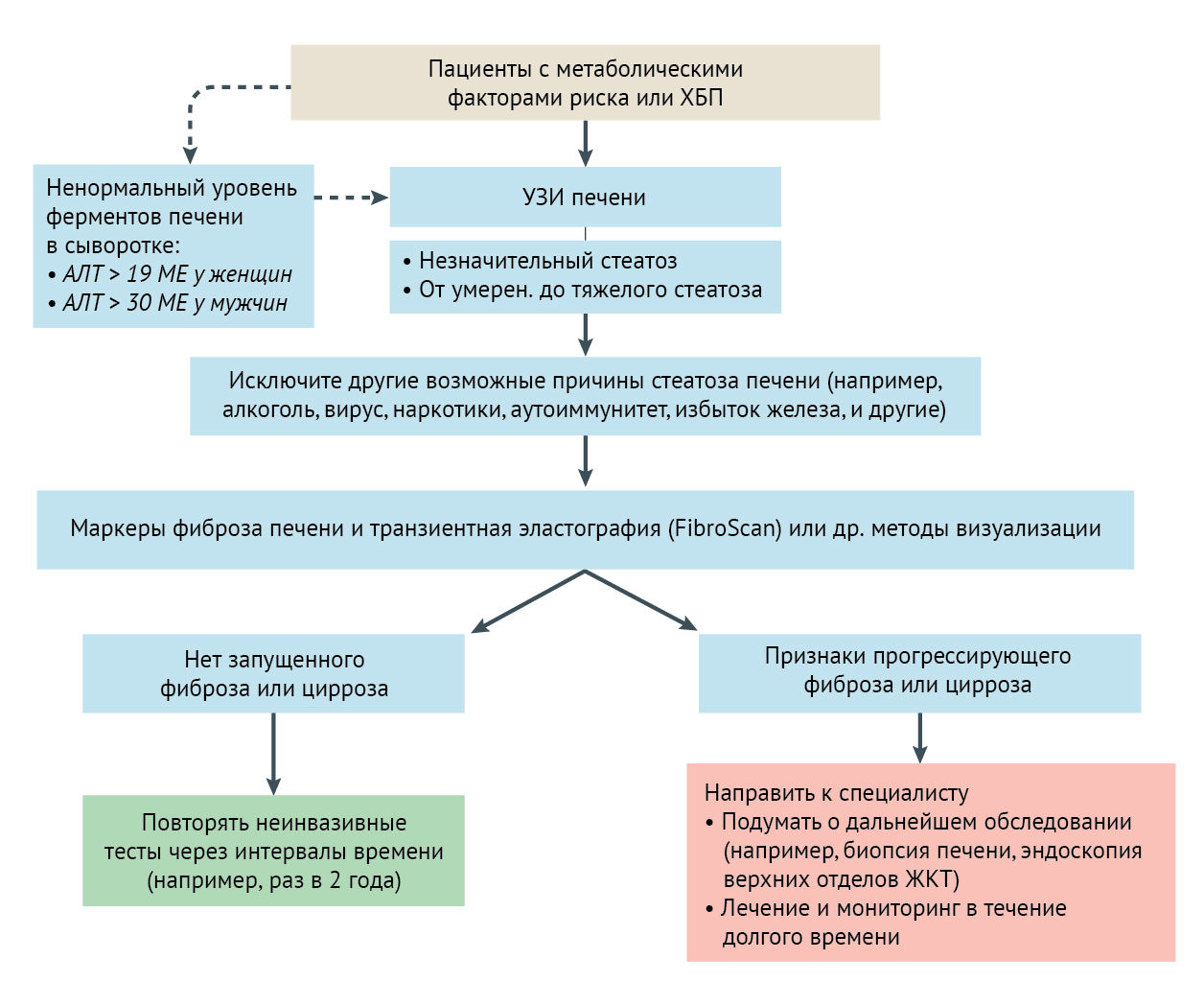
УЗИ печени является рекомендуемым методом визуализации первой линии для выявления НАЖДП в клинической практике. При ультразвуковом исследовании стеатоз печени характеризуется типичным диффузным увеличением эхогенности (так называемая светлая печень). Ультрасонография выявляет стеатоз печени с хорошей диагностической точностью, демонстрируя чувствительность и специфичность приблизительно 85 % и 95 %, соответственно (при инфильтрации печени жиром не менее 20-30 %). Кроме того, ультрасонография относительно недорога и может помочь клиницистам исключить другие причины заболеваний печени и выявить любые ранние признаки цирроза или портальной гипертензии. На сегодняшний день Т1-взвешенная МРТ с двойным эхом и протонная магнитно-резонансная спектроскопия определяют стеатоз печени с наилучшей диагностической точностью. Протонная магнитно-резонансная спектроскопия позволяет количественно оценить содержание триглицеридов в печени, обладает превосходной воспроизводимостью и чувствительностью, но требует значительных ресурсов и не может надежно отличить простой стеатоз от неалкогольного стеатогепатита.
Прогрессирование от простого стеатоза до НАСГ и далее до прогрессирующего фиброза, а также масштаб и стадия фиброза представляют особый клинический интерес, поскольку известно, что осложнения, связанные с терминальной стадией заболевания печени, возникают у пациентов с НАЖДП, у которых диагностирован прогрессирующий фиброз. Биопсия печени остается стандартной процедурой диагностики НАСГ и установления степени поражения печени и фиброза у пациентов с более запущенной НАЖДП, но эта процедура является инвазивной, потенциально рискованной и может привести к ошибочному результату, поэтому она не подходит для мониторинга пациентов или для диагностики в больших группах. Ряд неинвазивных тестов на биомаркеры, большинство из которых требуют дальнейшей проверки могут быть полезны для выявления пациентов с НАЖДП, которым требуется биопсия печени для постановки окончательного диагноза. Чувствительность и специфичность этих неинвазивных тестов для оценки прогрессирующего фиброза печени также были описаны.
Система оценки фиброза FIB-4 score учитывает клинические и лабораторные переменные, такие как: возраст, уровень аминотрансфераз и альбумина в сыворотке, количество тромбоцитов, индекс массы тела и статус диабета. Расширенный тест фиброза печени (ELF) и FibroTest являются примерами запатентованных методов, которые были предложены для неинвазивной оценки прогрессирующего фиброза печени в соответствии с конкретными сывороточными биомаркерами. Другой подход к постановке диагноза фиброза печени, известный как FibroScan, измеряет скорость низкочастотной упругой волны, распространяющейся через печень: чем жестче ткань, тем быстрее распространяется волна. Тем не менее, во многих случаях (~ 20 % пациентов; в основном, пациенты с ожирением), этот подход не гарантирует точного результата, и его использование нежелательно у пациентов с ожирением.
.
.
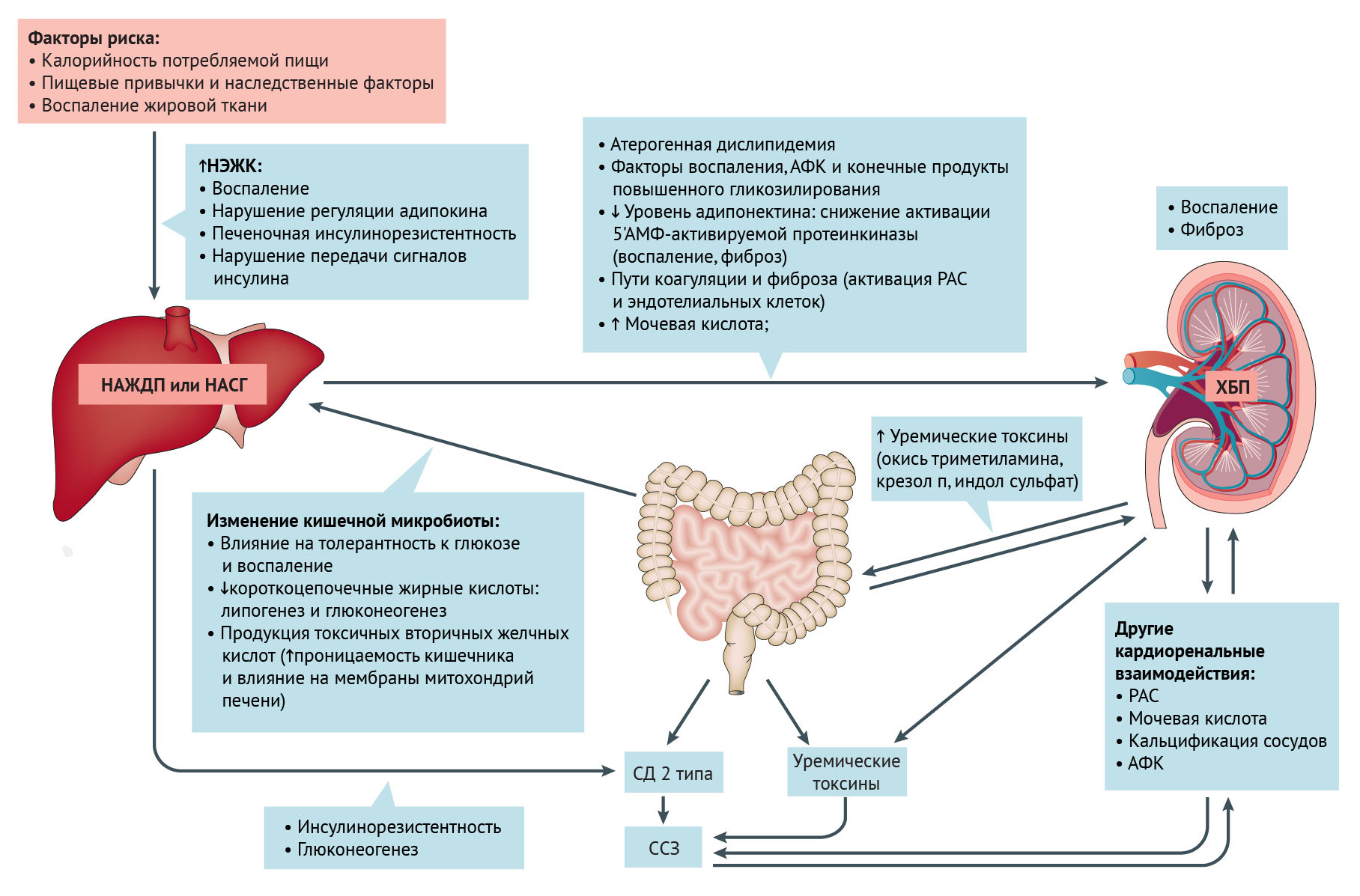
Прогрессирование дисфункции печени запускает пути, которые могут влиять на развитие ХБП. Например, инсулинорезистентность и атерогенная дислипидемия, а также провоспалительные факторы, протромботические факторы и профиброгенные молекулы могут способствовать повреждению тканей сосудов и почек. Снижение активации 5ʹ-AMP-активированной протеинкиназы в ответ на снижение уровня адипонектина дополнительно стимулирует провоспалительные и профиброгенные механизмы. Активация ренин-ангиотензиновой системы и эндотелиальных клеток также может способствовать дисфункции печени и почек за счет усиления окислительного стресса, воспаления и процессов коагуляции.
Повышенная продукция уремических токсинов кишечной микробиотой в условиях ХБП может вызывать дальнейшее повреждение почек, печени и сердечно-сосудистой системы через воспалительные, окислительные и фиброзные пути. Дисбиоз кишечной микробиоты, который часто возникает при ожирении, потенциально влияет на НАЖДП, ХБП и сахарный диабет 2 типа через сложные механизмы. Наконец, сердечно-сосудистые заболевания (ССЗ), риск которых увеличивается при НАЖДП, СД 2 типа или дисбиозе кишечника, могут влиять на развитие почечной дисфункции (и наоборот) посредством кардиоренальных взаимодействий.
Неалкогольная жировая дистрофия печени (НАЖДП) тесно связана с печеночной инсулинорезистентностью. Накопление печеночного диацилглицерина активирует PKC-ε, нарушая активацию рецептора инсулина и стимулированный инсулином синтез гликогена. Резистентность к инсулину косвенно влияет на метаболизм глюкозы и липидов в печени, увеличивая поток субстратов, которые способствуют липогенезу (глюкоза и жирные кислоты) и глюконеогенезу (ацетил-КоА, происходящий из глицерина и жирных кислот, аллостерического активатора пируваткарбоксилазы). Потеря веса с помощью диеты или бариатрической хирургии эффективно лечит НАЖДП, но лекарства, специально одобренные для лечения НАЖДП, отсутствуют. Некоторые новые фармакологические препараты широко применяются для изменения энергетического баланса или влияния на пути, которые способствуют НАЖДП (например, агонисты для PPAR γ, PPAR α / δ, FXR и аналоги для FGF-21 и GLP-1). Другие специфически ингибируют ключевые ферменты, участвующие в синтезе липидов (например, митохондриальный переносчик пирувата, ацетил-КоА-карбоксилаза, стеароил-КоА-десатураза и моноацил- и диацил-глицерол-трансферазы). Наконец, новый класс митохондриальных разобщающих агентов, нацеленных на печень, увеличивает расход энергии на гепатоцеллюлярные клетки, препятствуя метаболическим и печеночным осложнениям НАЖДП.
Источники:
- Targher G., Byrne C. D. Non-alcoholic fatty liver disease: an emerging driving force in chronic kidney disease // Nature Reviews Nephrology. – 2017. – Т. 13. – №. 5. – С. 297.
- Li J. et al. Prevalence, incidence, and outcome of non-alcoholic fatty liver disease in Asia, 1999–2019: a systematic review and meta-analysis //The Lancet Gastroenterology & Hepatology. – 2019. – Т. 4. – №. 5. – С. 389-398.
- Samuel V. T., Shulman G. I. Nonalcoholic fatty liver disease as a nexus of metabolic and hepatic diseases //Cell metabolism. – 2018. – Т. 27. – №. 1. – С. 22-41.
- Sanyal A. J. Past, present and future perspectives in nonalcoholic fatty liver disease //Nature Reviews Gastroenterology & Hepatology. – 2019. – С. 1.
