Внутриутробная инфекция как причина психических расстройств
Внутриутробный период является одним из самых важных этапов развития всех органов и систем, включая головной мозг. Быстрый рост и пластичность делают мозг чувствительным к воздействиям факторов окружающей среды. Психосоциальный стресс матери, нарушения метаболизма и, наконец, инфекционные агент предположительно являются факторами риска развития таких заболеваний, как расстройство аутистического спектра, СДВГ, депрессия и шизофрения. О роли внутриутробной инфекции в развитии психических расстройств заговорили после эпидемиологического исследования, в котором была выявлена корреляция между сезонной заболеваемостью вирусными инфекциями и увеличением числа больных шизофренией среди детей, рожденных в зимний сезон. Мнения ученых о роли вируса гриппа в развитии психических расстройств в последующем неоднократно менялись, но было положено начало многим крупным исследованиям влияния инфекционных заболеваний матери на формирование мозга плода.
Самые ранние исследования связи психических заболеваний и контакта с инфекцией в утробе матери сосредоточены на шизофрении. Это заболевание обычно впервые диагностируется у молодых людей и наиболее вероятно связано с генетическими факторами и внутриутробным нарушением формирования головного мозга. В 1960-е и 1970-е годы многочисленные исследования обнаружили повышенную заболеваемость шизофренией среди взрослых, рожденных в зимние месяцы, и предложили теорию «сезонности рождения». В исследовании взрослых в Финляндии был выявлен более высокий риск госпитализации с шизофренией у взрослых, у которых второй триместр внутриутробного развития совпал с эпидемией гриппа, в то время как рожденные за 6 лет до эпидемии не были подвержены риску. Позднее были изучены медицинские записи >12 000 беременных женщин, после чего обнаружилось, что респираторная инфекция во втором триместре повышает риск развития шизофрении у потомства в 3–7 раз. Из-за высокой распространенности инфекции гриппа, по оценкам исследователей, 14–21 % случаев шизофрении вызваны материнской инфекцией. Эти результаты также подтверждаются ассоциацией между повышенным уровнем цитокинов или антител против гриппа в материнской сыворотке и шизофренией у потомства.
Интересные результаты получены в исследовании на мышах: у потомства от самок, которым проводилась интраназальная инфузия вируса гриппа в середине беременности, наблюдалось снижение исследовательского поведения, уменьшение контакта с новыми объектами, снижение «социального» поведения и дефицит предимпульсного торможения для акустического испуга.
Несколько систематических и метааналитических обзоров предоставляют сходные доказательства, что инфицирование во время беременности повышает риск развития расстройства аутистического спектра (РАС) у потомства. Метаанализ 15 исследований с более чем 40000 случаев РАС продемонстрировал повышение риска развития заболевания после перенесенной во время беременности инфекции, особенно если мать была госпитализирована. Пренатальная лихорадка также была связана с развитием РАС в норвежском когортном исследовании матери и ребенка (114 500 беременных женщин), при этом количество эпизодов лихорадки и риск развития заболеваний находятся в прямой зависимости. На животных моделях вирусных и бактериальных инфекций у грызунов и макак-резусов данные выводы были подтверждены. Материнские инфекции были связаны с РАС-подобными фенотипами у потомства: с уменьшенной социализацией, нетипичной вокализацией и повторяющимся поведением.
Связь между внутриутробной инфекцией и развитием биполярного расстройства и депрессии менее ясна. Хотя было проведено несколько исследований в попытке определить, увеличивали ли материнские инфекции во время беременности риск биполярного расстройства у ребенка, результаты были смешанными, а недавние исследования говорят об отсутствии риска развития биполярного расстройства после перенесенной во время беременности инфекции. Что касается депрессии, последнее когортное исследование в Швеции продемонстрировало повышенный риск депрессии после госпитализации матери с любым инфекционным заболеванием, в том числе инфекциями мочевыводящих путей. Отдельно стоит отметить данные из шведского реестра смерти, которые продемонстрировали повышенный риск самоубийства начиная с 21 года среди взрослых, чья мать была госпитализирована с инфекцией во время беременности. Кроме того, несколько исследований на мышиных моделях обнаружили, что плод мыши, подвергшийся воздействию активированного иммунитета матери, может демонстрировать депрессивное поведение.
Механизмы повреждения мозга плода
.
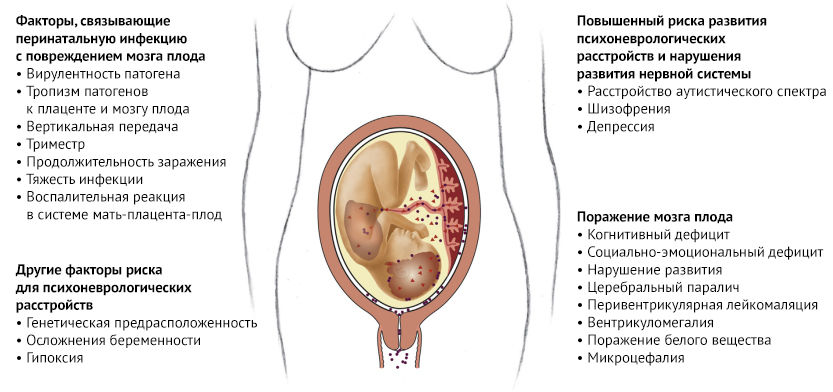
Рисунок 1 | Факторы, связывающие инфекционные агенты с умеренным и тяжелым повреждением мозга плода
Многие бактерии, вирусы и паразиты могут вызывать прямое или косвенное повреждение головного мозга плода, что в свою очередь приводит к нарушениям развития нервной системы разной степени тяжести. Известно, что TORCH-инфекции напрямую повреждают головной мозг плода, проникая через плаценту и вызывая повреждение белого вещества головного мозга, органов зрения и слуха и, как следствие, неврологический дефицит, слепоту и глухоту. Однако многие другие инфекционные агенты также могут повредить ЦНС плода, косвенно потенцируя воспалительный ответ, что приводит к повышению проницаемости гематоэнцефалического барьера, активации микроглии, высвобождению цитокинов, апоптозу, замедлению роста и, наконец, прямому повреждению клеток.
Воспаление в плаценте также связано с повреждением ЦНС плода: медиаторы воспаления и воспалительные клетки проникают через фетоплацентарный барьер, что в свою очередь приводит к высвобождению фетальных цитокинов, нейротрансмиттеров или глутаматной эксайтотоксичности. Эксайтотоксичность - это патологический процесс, при котором нервные клетки повреждаются или погибают из-за чрезмерной стимуляции нейротрансмиттерами, такими как глутамат. Это происходит, когда рецепторы для возбуждающего нейротрансмиттера - глутамата (NMDA и АМРА рецепторы) чрезмерно активируются от глутаматергического шторма. Эксайтотоксины запускают реакции вследствие которых большое количество ионов кальция (Ca 2+) входят в клетку. Приток Ca 2+ в клетки активирует ряд ферментов, включая фосфолипазы, эндонуклеазы и протеазы, которые повреждают клеточные структуры, такие как компоненты цитоскелета, мембраны и ДНК.
.
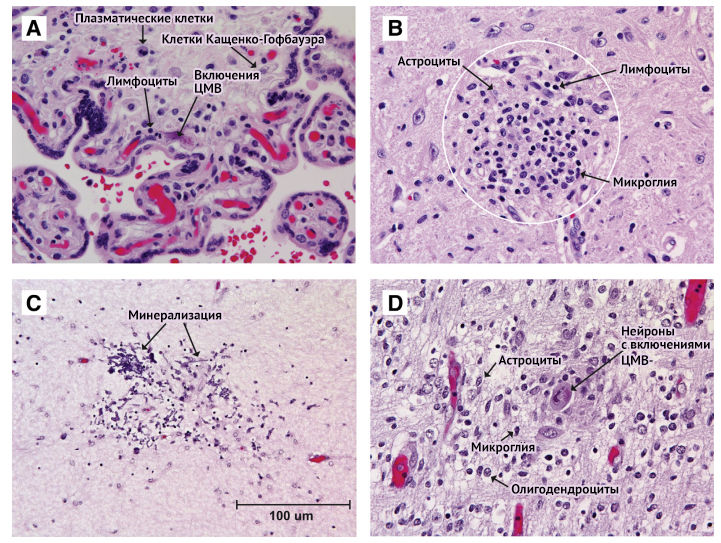
Рисунок 2 | Микропрепараты плаценты (A) и головного мозга новорожденного (B, C, D) инфицированного ЦМВ
В плаценте (А) наблюдается гиперплазия плацентарных макрофагов (клетки Кащенко-Гофбауэра) и инфильтрация лимфоцитами и плазматическими клетками, включения являются патогномоничными для ЦМВ-инфекции. (B) В стволе мозга 4-месячного ребенка, родившегося на 26 неделе беременности с внутриутробной ЦМВ-инфекцией, обнаруживается микроглиальный узелок (внутри белого круга) с большим количеством клеток, включающим лимфоциты, активированную микроглию и реактивные астроциты. (С) В белом веществе 25-дневного новорожденного, рожденного на 24 неделе беременности внутриутробной инфекцией ЦМВ, обнаруживается очаг некроза и дистрофической минерализации (темно-фиолетовые отложения). (D) В мозге плода 23-недельного плода острая фаза инфекции ЦМВ, на большом увеличении можно увидеть смесь активированных клеток микроглии, реактивных астроцитов и нейрон с патогномоничными цитоплазматическими и ядерными включениями ЦМВ.
.
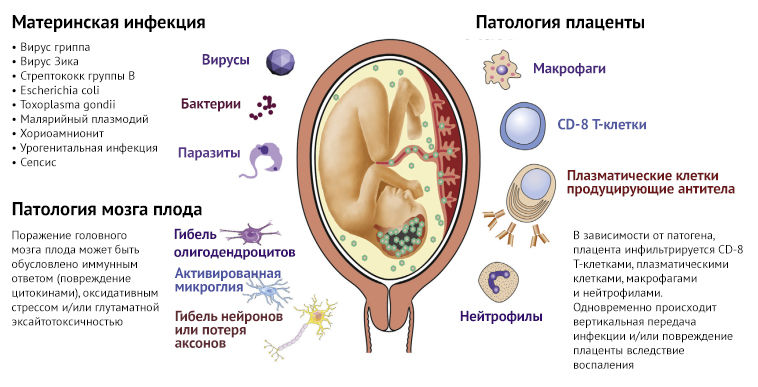
Рисунок 3 | Внутриутробные инфекции, плацентарный иммунный ответ и клеточные мишени в головном мозге плода
Спектр материнских инфекций, вызываемых вирусами, бактериями и паразитами, вовлечен в развитие патологии плаценты и повреждение мозга плода. Вследствие инфицирования происходит инфильтрация плаценты иммунными клетками, в частности материнскими CD-8 Т-клетками и плазматическими клетками. Нейтрофильная инфильтрация плаценты классически связана с бактериальными инфекциями, такими как стрептококки группы B, которые могут вызывать менингит с последующим поражением головного мозга. Клеточный ответ в мозге плода, обычно связанный с перинатальным инфекционным или воспалительным повреждением, связан с активацией микроглии и астроцитов, последующей потерей нейронов и дисфункцией олигодендроцитов.
Внутриутробное воспаление может активировать микроглию — основную защитную систему головного мозга плода. Астроциты запускают выброс цитокинов, которые повреждают нейроны и олигодендроциты. При гистопатологическом исследовании мозга людей с РАС обнаруживается активация микроглии, ее аномальная морфология и распределение. В исследованиях на моделях животных внутриутробная инфекция индуцирует активацию микроглии, в исследованиях in vitro наблюдается повышение выброса нейротоксических цитокинов из активированной микроглии. Воспалительные цитокины из активированной микроглии и астроцитов могут нарушить развитие олигодендроцитов, которые играют роль в патогенезе шизофрении, депрессии, аутизма и биполярного расстройства. Олигодендроциты являются миелинизирующими клетками ЦНС, и данные свидетельствуют о том, что предшествующее нарушение формирования олигодендроцитов и гипомиелинизация могут обусловливать патофизиологию РАС. Несколько недавних исследований также предполагают, что дефицит миелинизации и нарушение целостности белого вещества играют роль в патогенезе шизофрении (так называемого «разъединения» мозга). Поврежденный головной мозг также более восприимчив к воздействию гипоксии в течение всей жизни, и комбинация этих факторов может быть триггером для психических расстройств в будущем.
Некоторые организмы, такие как токсоплазма, могут увеличивать риск развития шизофрении через активацию астроцитов и нарушение регуляции метаболизма кинурениновой кислоты — физиологического антагониста NMDA-рецепторов.
Роль воспалительных цитокинов
Отдельно стоит сказать о цитокинах, играющих роль системных медиаторов воспалительной реакции. В исследованиях обнаруживается почти двукратное повышение уровня материнского интерлейкина-8 (провоспалительного хемокина) во втором триместре и в начале третьего триместра среди беременностей, приводящих к рождению потомства с шизофренией. Этот хемокин имеет определяющее значение в развитии иммунного ответа, в том числе в процессе адгезии нейтрофилов к эндотелиальным клеткам, что приводит к их миграции в ткани и выделению лизосомальных ферментов из нейтрофилов, в результате чего образуются активные формы кислорода. IL-8 также обладает непрямой хемотаксической активностью в отношении T-лимфоцитов. Следовательно, любая бактериальная или вирусная инфекция будет стимулировать выработку IL-8, и во время беременности наиболее высокий уровень интерлейкина был связан с хориоамнионитом.
Схожие результаты получены в исследованиях интерлейкина-6. Материнский иммунный ответ вызывает поведенческие изменения и изменения экспрессии генов у потомства беременных мышей. Однако когда IL-6 удаляется из материнского иммунного ответа с использованием генетических методов или с помощью блокирующих антител, поведенческие дефициты, связанные с ним, у взрослого потомства отсутствуют. Антитела к IL-1β или IFNγ не предотвращали поведенческие нарушения, что свидетельствует о специфичности анти-IL-6-эффекта.
Источники:
- Al-Haddad B. J. S. et al. The fetal origins of mental illness //American journal of obstetrics and gynecology. – 2019.
- Brown A. S., Derkits E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies //American Journal of Psychiatry. – 2009. – Т. 167. – №. 3.
- Brown A. S. et al. Elevated maternal interleukin-8 levels and risk of schizophrenia in adult offspring //American Journal of Psychiatry. – 2004. – Т. 161. – №. 5.
- Karlsson H., Dalman C. Epidemiological Studies of Prenatal and Childhood Infection and Schizophrenia. – 2019.
- Severance E. G., Yolken R. H. From infection to the microbiome: an evolving role of microbes in schizophrenia. – 2019.
- Smith S. E. P. et al. Maternal immune activation alters fetal brain development through interleukin-6 //Journal of Neuroscience. – 2007. – Т. 27. – №. 40.
- Костюкова А. Б., Мосолов С. Н. Нейровоспалительная гипотеза шизофрении и некоторые новые терапевтические подходы //Современная терапия психических расстройств. – 2013. – №. 4.
