Маркер бесконечности Ki-67
Белок Ki-67 — самый широко используемый маркер пролиферации как в нормальных, так и в опухолевых клетках. Впервые описан в 1983 году в Институте патологии в немецком городе Киль, где и были синтезированы первые антитела к нему в 67 лунке планшета [1].
Негистоновый белок Ki-67 кодируется геном MKI67. Он участвует в клеточном цикле, вовлекаясь в биогенез рибосом, организацию гетерохроматина и разделение митотических хромосом. Полный спектр его функций все еще неясен. Трудности исследования Ki-67 связаны с отсутствием гомологичных белков с уже известной функцией, а также с его большой молекулярной массой и высокой чувствительностью к разрушению протеазами [2].
Ki-67 обнаруживается в ядрах клеток во все активные фазы клеточного цикла: G1, S, G2, M. Ki-67 весьма «ветреный» белок: его распределение и количество вариабельно и зависит от конкретного момента жизни клетки (рис. 1) [3]. От фазы G1 к фазе М его количество увеличивается, достигая максимума во время метафазы митоза. В самом начале фазы G1 локализация Ki-67 совпадает с локализацией сателлитной ДНК в центромерах и теломерах хромосом. Далее при прогрессии фазы G1 эта колокализация исчезает. К середине фазы G1 белок Ki-67 начинает выявляться в ядрышках, затем, в фазу G2, — и в ядрышках, и в кариоплазме.
.
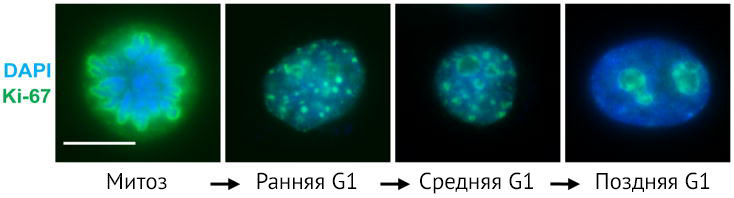
Но все меняется, когда происходит митоз. В профазу Ki-67 в виде тонкой сети связан с конденсированным хроматином. В метафазу эта сетчатая структура окружает уже отдельные хромосомы. После разрушения ядерной мембраны часть Ki-67 распределяется диффузно в цитоплазме. В анафазу и телофазу митоза количество Ki-67 в клетках начинает быстро снижаться.
При переходе клетки после митоза в фазу G0 Ki-67 быстро подвергается катаболизму (путем опосредованной протеасомами деградации) и перестает выявляться в ядрах интерфазных клеток [4].
Ki-67 также обнаруживается при гиперэкспрессии p53 и p21, вызванной блокированием репликации или повреждением ДНК [2].
Длительное время Ki-67 определялся как иммуногистохимический маркер, отражающий лишь активность пролиферации. Это обусловило его важную роль в классификации злокачественных новообразований, таких как рак молочной железы, нейроэндокринные опухоли и лимфомы [5]. Определение индекса Ki-67 является более чувствительным методом для оценки пролиферативной активности, чем подсчет фигур митоза, поскольку позволяет выявлять клетки во всех активных фазах клеточного цикла и уменьшает вероятность неверной интерпретации микроскопической картины. Переход патоморфологов в своей рутинной практике к расчету индекса пролиферации по уровню Ki-67 стал начальным этапом движения в сторону стандартизации и объективизации гистологических исследований. От двоичной системы «есть экспрессия» (1) / «нет экспрессии» (0) фокус сместился к оценке степени выраженности маркера в исследуемых образцах.
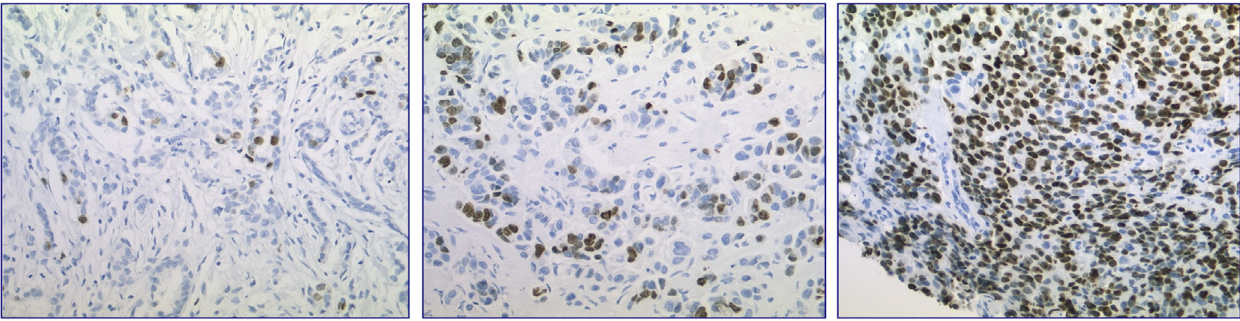
Индекс пролиферации — это процент клеток с ядерным окрашиванием от общего числа опухолевых клеток. Интенсивность и тип экспрессии маркера не учитывается (перинуклеолярный, нуклеоплазменный, перихромосомный). Подсчет включает в себя не менее 500 опухолевых клеток (в идеале не менее 1000) не менее чем в 3 полях зрения при увеличении ×400. В случае гетерогенности опухоли выбирают участки с наибольшей митотической активностью [6].
Общие характеристики уровня пролиферации для опухолевой ткани различных локализаций:
- < 10 % — низкий уровень;
- 10–20 % — пограничные опухоли;
- > 20 % — высокий.
В лабораториях используют антитела к Ki-67 клонов MIB-1 (для работы с материалом, полученным от человека, крупного рогатого скота, собак, овец и лошадей) и MIB-5 (для работы с материалом, полученным от крыс и других грызунов). Эти структуры показали более высокое сродство к эпитопу антигена Ki-67 в условиях формалиновой фиксации доставляемого материала [2].
Особую значимость этот маркер приобрел при патоморфологическом исследовании опухолей молочной железы. Гистологический подтип гормон-позитивных люминальных опухолей определяется на основании индекса Ki-67: подтип А (Ki-67 < 20 %) и подтип В (Ki-67 ≥ 20 %) (рис. 2) [6].
.
Прогностические горизонты применения маркера Ki-67 постоянно расширяются. Уточняется и дополняется его значение в предикции результатов лекарственной терапии опухолей. Например, для рака молочной железы, который не отвечает на химиотерапию, повышение Ki-67 является плохим прогностическим маркером. Напротив, в опухолях, реагирующих на химиотерапию, этот эффект не наблюдается, и даже присутствует корреляция увеличения Ki-67 с улучшением прогноза.
Объяснение этому феномену можно логически вывести из понимания биологии каждого подтипа опухоли:
- Низко пролиферирующие опухоли хуже реагируют на химиотерапию, но в любом случае имеют хороший прогноз ввиду меньшей агрессивности (низкий Ki-67 — хороший результат).
- В тех высокопролиферирующих опухолях, которые чувствительны к терапии, высокий Ki-67 связан с большей частотой достижения полного патоморфологического ответа (pCR) и улучшением выживаемости (высокий Ki-67 — хороший результат).
- Но в высокопролиферирующих опухолях, которые при этом также являются резистентными к химиотерапии, увеличение индекса Ki-67 связано с уменьшением выживаемости: активно пролиферирующие клетки обусловливают агрессивное поведение опухоли, не контролируемое химиопрепаратами (высокий Ki-67 — плохой результат) [6].
В настоящее время методы иммуногистохимической детекции Ki-67 представляются в виде несколько упрощенной картины, как будто Ki-67 «включен» во время клеточной пролиферации (характерное коричневое окрашивание ядер) и «выключен» во время покоя и старения клетки (нет окрашенных ядер, может обнаруживаться в цитоплазме). Но важное клиническое значение может иметь также интерпретация факта неуклонного роста экспрессии Ki67 от фазы G1 к фазе М. Также выяснено, что чем дольше клетка находится в состоянии покоя, тем ниже будет уровень Ki-67 при повторном входе в клеточный цикл [5,7]. Для анализа этих данных требуются методы системной биологии с выведением формулы, позволяющей учесть все характеристики Ki-67 в доставленном материале. Это позволит более точно отразить пролиферативный статус клеток и определить клиническую стратегию. Ключевым моментом эффективности таких многофакторных алгоритмов является, несомненно, точность «сырых» данных. И здесь мы уже говорим о стандартизации патоморфологического исследования, которое в современной практике должно базироваться на цифровой обработке гистологических изображений.
Источники:
- Gerdes J., Schwab U., Lemke H., Stein H. Production of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation. Int J Cancer. 1983;31(1):13-20.
- Sun X., Kaufman P.D. Ki-67: more than a proliferation marker. Chromosoma. 2018;127(2):175–186.
- Matheson T.D., Kaufman P.D. The p150N domain of chromatin assembly factor-1 regulates Ki-67 accumulation on the mitotic perichromosomal layer. Mol Biol Cell. 2017;28(1):21–29.
- Kreipe H. [Ki67: biological intertumor variance versus variance of assay].Pathologe. 2018;39(Suppl 2):272-277.
- Cidado J.et al. Ki-67 is required for maintenance of cancer stem cells but not cell proliferation. Oncotarget. 2016;7(5):6281–6293.
- Denkert C. et al. Strategies for developing Ki67 as a useful biomarker in breast cancer. Breast.
2015;24 Suppl 2:S67-72. - Miller I.et al. Ki67 is a Graded Rather than a Binary Marker of Proliferation versus Quiescence. Cell Rep. 2018;24(5):1105–1112.e5.
