Амилоид: свет яблочно-Зеленого Фонаря

Во тьме ночной, при свете дня
Злу не укрыться от меня…
Те, злые мысли в ком царят,
Страшитесь… света фонаря!
Традиционно амилоидоз характеризуется экстрацеллюлярными фибриллярными белковыми включениями (преимущественно патологическими) в тканях человека и животных.
По мере исследования фокус в определении амилоидной сущности сместился от локализации амилоида к структурным свойствам. Архитектурно амилоид — это неветвящиеся белковые фибриллы, состоящие из мономеров, связанных преимущественно за счет водородных связей между β-цепями межмолекулярных β-слоев, расположенных перпендикулярно к латеральной оси фибриллы. Данный вариант структуры фибриллы называют «кросс-β», и он является наиболее универсальным. β-слои в амилоидной фибрилле могут располагаться параллельно друг другу и в регистре (сходные аминокислоты соседних β-цепей находятся друг над другом и соединены водородными связями) [1]. Реже встречаются амилоиды с антипараллельной ориентацией β-цепей. Также интересный вариант укладки имеют фибриллы приона (инфекционного амилоидного белка) HET-s аскомицета Podospora anserina в виде β-спиралей [2].
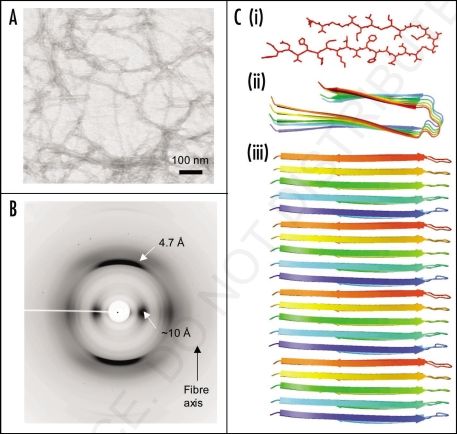
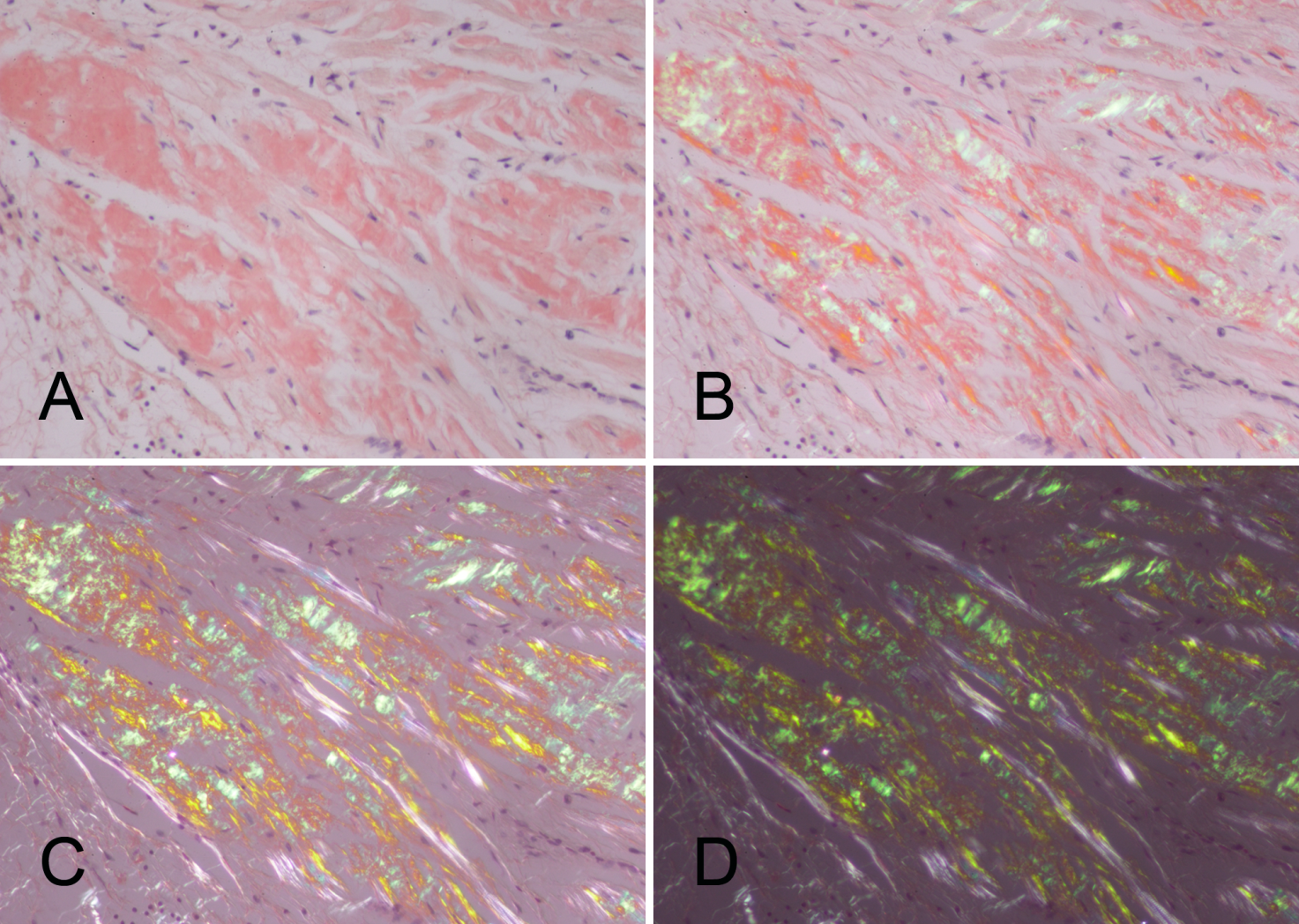
Важным критерием «амилоидности» являются физические свойства, вызванные кросс-β-структурой (рис. 1) [3]. «Фонарем», осветившим путь идентификации амилоида, стал поляризованный свет. Истинно амилоидные фибриллы связывают аффинный к β-слоям анилиновый краситель конго красный, что вызывает двойную рефракцию (двойное преломление) в поляризованном свете. При этом только амилоидные отложения приобретают яблочно-зеленую окраску (рис. 2) [4]. Также характерная кросс-β-складчатая конформация белковых фибриллярных агрегатов отмечается при двумерной рентгеновской дифракции [4].
История изучения амилоида полна поистине шекспировских страстей. Озаглавим пьесу «под маской овцы таился лев» или «белок в углеводной шкуре». Трагедия «непонятого амилоида» началась с момента его обнаружения. Собственно термин «амилоид» (крахмалоподобный, от лат. amylum и греч. amylon — «крахмал») введен Матиасом Шлейденом в 1838 году для описания конгломератов крахмала, в норме присутствующих в клетках растений. Рудольф Людвиг Карл Вирхов в 1854 году обнаружил, что включения при морфологической картине «восковой» печени окрашиваются йодом, как и крахмал. В дальнейших своих работах он придерживался концепции крахмалистой природы таких конгломератов, что способствовало закреплению и самого «ложного» термина. Но в 1859 г. Карл Фрейдрих и Август Кекуле показали, что амилоиды не содержат включений, химически близких крахмалу или целлюлозе, но обогащены азотом и сходны с белками [5].
Феномен положительной окраски йодом нашел свое объяснение позже: амилоидные включения, помимо основного фибриллярного белкового компонента, содержат также протеогликаны [6] и глюкозамингликаны [7,8].
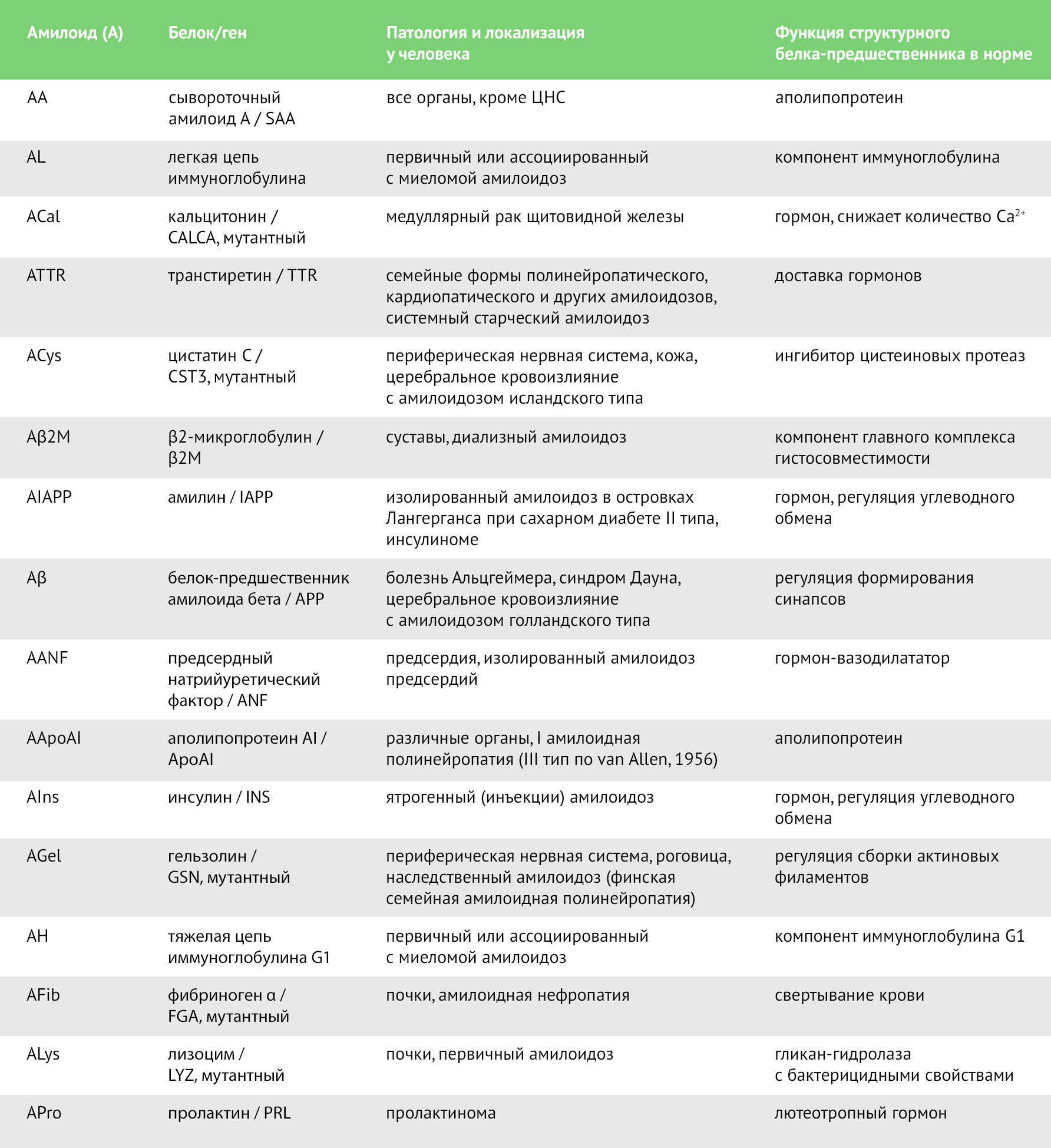
Медицинское значение имеют патологические амилоиды, характеризующиеся преимущественно экстрацеллюлярным накоплением в органах и тканях, что приводит к прогрессирующей дисфункции последних. Выделяют системные (генерализованные) и локальные формы амилоидозов. Около 30 видов амилоидов ассоциированы с различными патологиями (в табл. 1 приведены наиболее распространенные типы) [9,10].
Таблица 1. Наиболее распространенные типы амилоида.
Таким образом, амилоидозы — группа заболеваний, отличительным признаком которых является отложение в тканях и органах фибриллярного гликопротеида амилоида. Амилоидоз диагностируется только морфологически (рис. 3) [11,12]. Производится биопсия слизистой оболочки прямой кишки, подкожной жировой клетчатки, десны, реже почек или печени, что является достаточным для постановки диагноза при системном характере процесса. Биопсийный материал окрашивается конго красным и при обнаружении конгофилии исследуется в поляризованном свете для выявления эффекта двойного лучепреломления. Также возможно дополнительное окрашивание флуоресцентным тиофлавином Т и S с получением светло-зеленого свечения. Макроскопически определяется выраженный амилоидоз: органы увеличены в размерах, становятся очень плотными и ломкими, на разрезе приобретают светлый оттенок с сальным блеском.
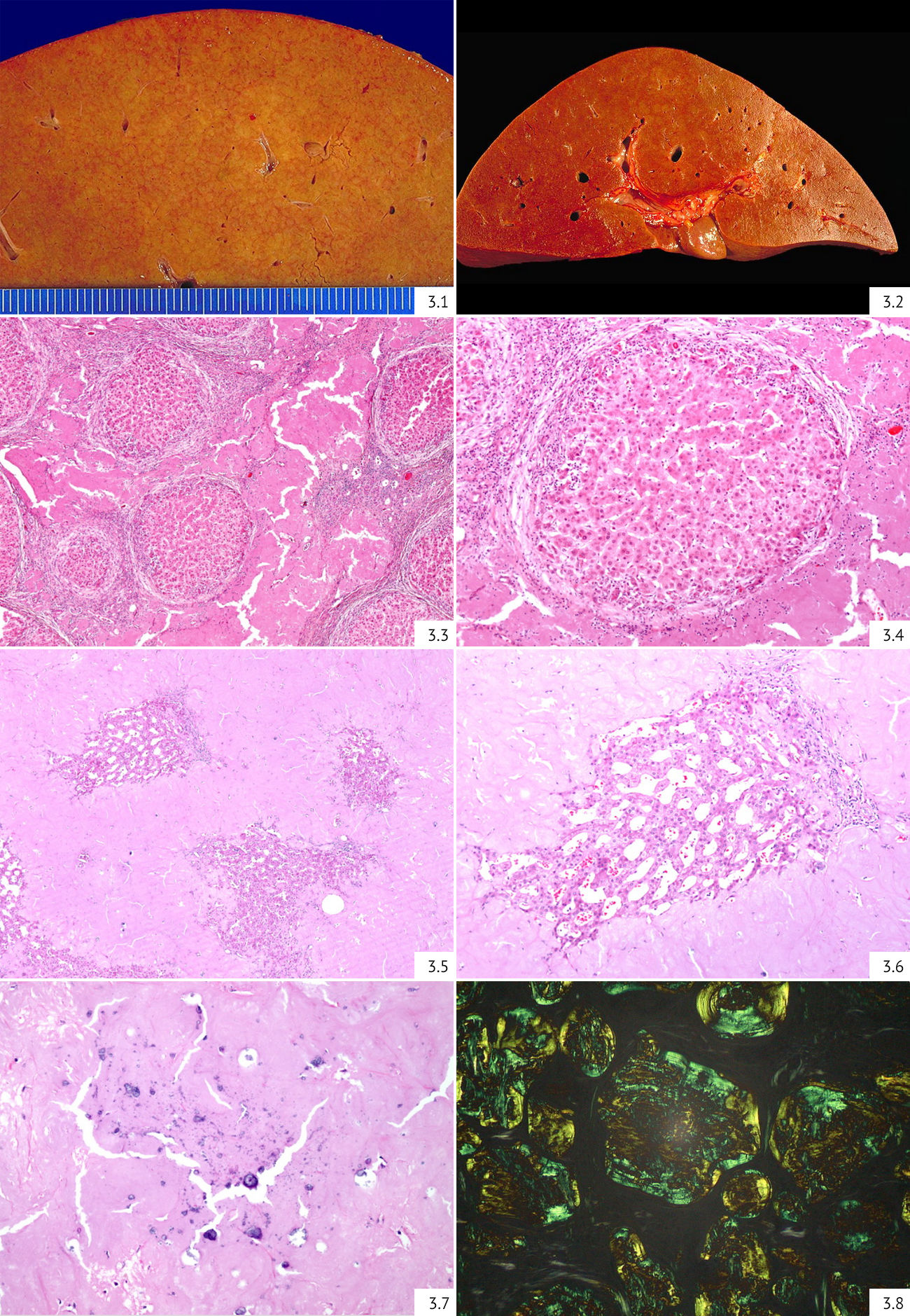
Особенности строения амилоида определяют клиническую картину заболевания и, соответственно, терапевтическую тактику. Для типирования амилоидов применяют пробу с перманганатом калия. При обработке 5 % раствором перманганата калия окрашенных конго красным препаратов амилоид АА теряет окраску и утрачивает свойство двойного лучепреломления, в отличие от амилоида AL. Также используют щелочной гуанидин: АА тип теряет конгофилию, AL тип, напротив, длительно ее сохраняет. Более эффективны иммуногистохимические методы с использованием антисывороток к основным типам амилоидного белка (специфические антитела против АА белка, легких цепей иммуноглобулинов, транстиретина и β2-микроглобулина). Но все же самым точным является протеомный анализ амилоидной структуры.
Помимо патологических амилоидов, обнаружены их функциональные собратья на различных доменах жизни. У человека такие амилоиды принимают участие в контроле полимеризации меланина и запасании целого ряда гормонов. У биопленок архей выявлены амилоидоподобные свойства [14,13]. Это доказывает, что амилоиды больше чем патогенные агенты. В широком смысле их можно считать вариантом функциональной четвертичной структуры белка. С расширением технических возможностей формируется новый вектор — системная биология амилоидов или амилоидомика. Изучаются особенности аминокислотной последовательности белка, которые обусловливают способность формировать амилоиды. Короткие амилоидогенные фрагменты, агрегирующие in vitro, нередко выявляются при помощи методов биоинформатики [15]. При этом в части случаев полноразмерные белки in vivo к агрегации не способны. Закономерно сфокусироваться на поиске структурных особенностей белковой молекулы, которые препятствуют амилоидогенезу.
Источники
1. Kryndushkin D., Wear M.P., Shewmaker F. Amyloid cannot resist identification. Prion. 2013;7(6):464–468.
2. Van Melckebeke H.et al. AtomicResolution ThreeDimensional Structure of Het s(218–289) Amyloid Fibrils by Solid state NMR Spectroscopy. J. Am. Chem. Soc.2010;132:13765–13775.
3. Rambaran R.N., Serpell L.C. Amyloid fibrils: abnormal protein assembly. Prion. 2008;2(3):112–117.
4. Tanskanen M.Amyloid—Historical Aspects. In Amyloidosis. IntechOpen.2013.
5. Westermark P. Aspects of the History and Nomenclature of Amyloid and Amyloidosis. In: Picken M., Herrera G., Dogan A. (eds) Amyloid and Related Disorders. Current Clinical Pathology. Humana Press, Cham.2015.
6. Niewold T.A. et al. Characterization of proteoglycans and glycosaminoglycans in bovine renal AA type amyloidosis. Virchows Arch. B Cell. Pathol. Incl. Mol. Pathol.1991;60:321–328.
7. Snow A.D. et al. An important role of ibrill sulfate proteoglycan (Perlecan) in a model system for the deposition and persistence of ibrillary A beta amyloid in rat brain. Neuron.1994;12:219–234.
8. Snow A.D., Willmer J., Kisilevsky R. Sulfated glycosaminoglycans: a common constituent of all amyloids? Lab. Invest.1987;56:120–123.
9. Milani P., Palladini G., Merlini G. New concepts in the treatment and diagnosis of amyloidosis. Expert Rev Hematol. 2018;11(2):117-127.
10. Wechalekar A.D., Gillmore J.D., Hawkins P.N. Systemic amyloidosis. Lancet. 2016;387(10038):2641-2654.
11. Image Copyright: pathorama.ch.
12. Image courtesy of: Ed Uthman, MD, Houston, Texas. Used with permission.
13. Pham C.L., Kwan A.H., Sunde M. Functional amyloid: widespread in Nature, diversein purpose. Essays Biochem. 2014;56:207-19.
14. Shanmugam N. et al.Microbial functional amyloids serve diverse purposes for structure, adhesion and defence. Biophys Rev. 2019;11(3):287-302.
15. Villalobos Acosta D.M.Á.et al. Recent Advances by In Silico and In Vitro Studies of Amyloid-β 1-42 Fibril Depicted a S-Shape Conformation. Int J Mol Sci. 2018;19(8):2415.
