Мы — Иные... Клеточный атипизм

Отсюда мораль: всякому овощу свое время. Или если сказать попроще… Никогда не думай, что ты иная, чем могла бы не быть иначе, чем будучи иной в тех случаях, когда иначе нельзя не быть.
Льюис Кэрролл, «Алиса в стране чудес»
Злокачественная трансформация клеток опосредована генетическими нарушениями. Опухолевые клетки приобретают особый, отличный от нормальных клеток фенотип, на выявлении которого основана морфологическая верификация онкологического диагноза.
Архитектурные перестройки в опухолевой ткани отмечаются на разных уровнях организации. Глобальные изменения, такие как нарушение соотношения паренхимы и стромы, изменение величины и формы тканевых структур, представляют явление тканевого атипизма. Но помимо масштабных нарушений, при «строительстве» опухоли используются и неправильные, атипичные «кирпичи»-клетки. Характерный комплекс цитологических критериев злокачественности формирует клеточный атипизм — одно из фундаментальных понятий в онкоморфологии. Для максимальной объективизации анализа материального субстрата патологического процесса используются критериальные системы оценивания, способствующие унификации, и, следовательно, упрощению исследования. У патоморфолога складывается «образ злокачественной клетки» — некая визуальная форма, достаточно яркая для быстрой идентификации. Рассмотрим на светооптическом уровне штрихи (критерии), из которых складывается этот образ.
1. Клетка:
- Увеличение размеров атипичных клеток, по сравнению с нормальными клетками ткани, вплоть до гигантских размеров; но это необязательный признак;
- Изменение формы клеток, вплоть до самых причудливых. В опухолевой массе может отмечаться как выраженный клеточный полиморфизм (различие размеров и формы), так и, напротив, упрощение строения — мономорфность (наблюдается в низкодифференцированных мезенхимальных опухолях);
- Нарушение ядерно-цитоплазматического соотношения (за счет увеличения ядра);
- Наличие многоядерных клеток с отчетливым ядерным полиморфизмом;
- Атипичная локализация ядра;
- Диссоциация в созревании ядра и цитоплазмы (молодое ядро в зрелой клетке, зрелое ядро в незрелой цитоплазме) [1].
2. Ядро:
- Увеличение размера;
- Изменение формы, ядерный полиморфизм;
- Контур ядра неправильный, неравномерно извилистый, иногда с глубокими вырезками, грубо очерчен;
- Нарушение строения ядерной мембраны: неравномерно утолщена, отмечаются разрывы [1, 2].
- Патология митотического режима. Митотический режим — это комплекс параметров, характеризующих различные аспекты митоза. Например, митотический индекс — процент делящихся клеток от всей популяции — показатель, который отражает митотическую активность; структура митотически активных клеток — процентное соотношение делящихся клеток, находящихся на разных стадиях митоза; относительное количество всех патологических митозов; процентное содержание отдельных видов патологических митозов.
Спектр патологии митоза крайне широк. Но отмечаются некоторые характерные особенности. В частности, под ударом при злокачественной трансформации оказывается метафаза. Отмечается проявление колхицинового митоза, или К-митоза (форма патологического митоза с торможением процесса в результате инактивации веретена деления под действием статокинетических ядов, к которым относится в т. ч. и колхицин), а именно — К-метафаза. Для нее характерны слипание или рассеивание гиперспирализованных хромосом, отставание хромосом и их фрагментов в метафазе. Встречаются трехгрупповые метафазы, при которых, помимо основной экваториальной пластинки, присутствуют еще две группы в области полюсов деления клетки. Возможны метафазы с рассеиванием и массовой фрагментацией хромосом, ассиметричные, многополюсные и моноцентрические митозы [3].
3. Ядрышки:
- Визуализируются при исследовании;
- Увеличены в размерах;
- Форма неправильная, нередко полиморфизм;
- Увеличение количества ядрышек.
4. Хроматин:
- Различные паттерны: нарушение распределения, соотношения эу- и гетерохроматина;
- Крупнозернистый, грубый (часто отмечается в различных опухолях);
- Тонкий, мелкодисперсный, нежный, бластный (например, при остром миелобластном лейкозе);
- Неравномерность распределения: мелкозернистый, сетчатый или мелкоглыбчатый (например, при гранулезоклеточных опухолях яичников);
- Высокая интенсивность окрашивания (гиперхромия) [4].
Выраженность цито- и гистологических нарушений увеличивается с ростом степени злокачественности.
Патологическая анатомия немыслима без визуализации информации, поэтому представим процесс озлокачествления клеток на конкретном примере. В доставленном материале — фрагмент ткани мочевого пузыря. В нормальных условиях уротелиальные клетки относительно мономорфны, содержат достаточный объем цитоплазмы и овальные ядра, имеют округлые гладкие контуры, нежный хроматин, мелкие или вовсе невидимые ядрышки (рис. 1) [5].
.
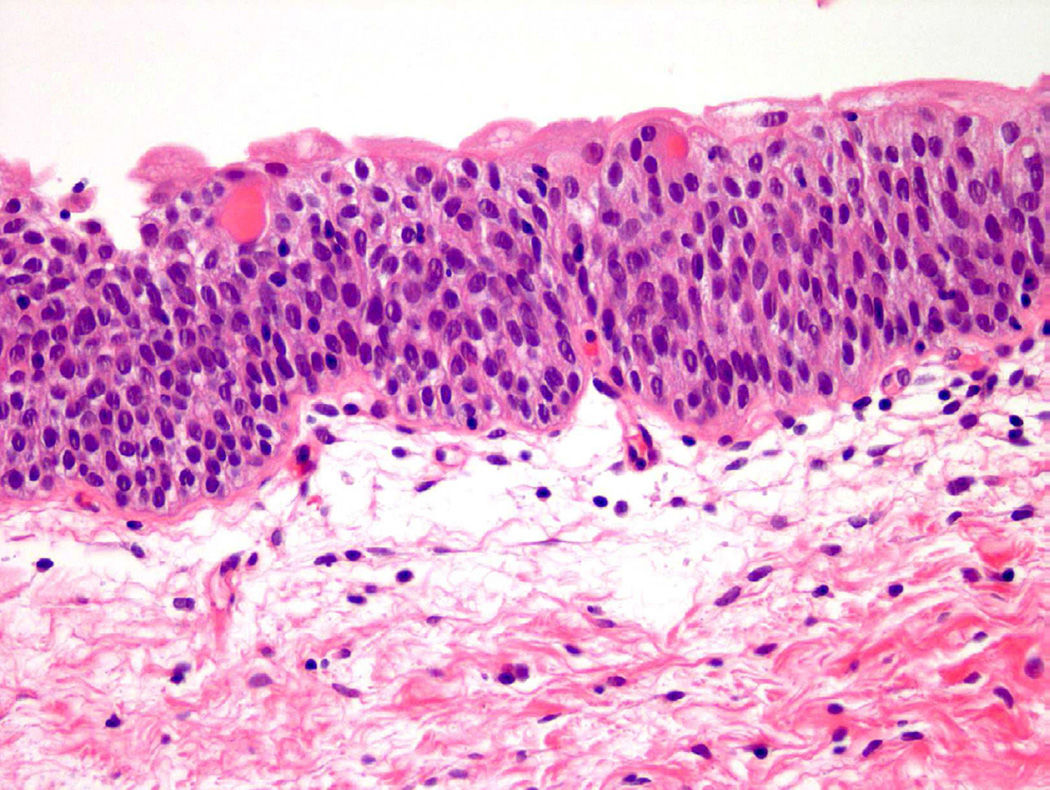
Рисунок 1 | Микроскопическая картина нормального уротелия [5]
Определимся с относительностью мономорфности клеток. Даже нормальным уротелиальным клеткам «разрешено» иметь определенные вариации в размерах. Особенно это характерно для самого поверхностного (апикального) слоя уротелия, который находится в постоянном контакте с содержимым мочевого тракта. Он представлен крупными зонтичными клетками с обильной эозинофильной цитоплазмой. Их наличие служит одним из критериев злокачественности уротелиальной карциномы. В опухолях High Grade (высокой степени злокачественности) они не определяются. Но в то же время физиологический фактор — растяжение мочевого пузыря — может привести к уплощению поверхностных зонтичных клеток до такой степени, что слой может быть трудно определить микроскопически, что дополнительно затрудняет морфологическую диагностику [6].
Несмотря на большое разнообразие морфологии нормальных уротелиальных клеток, определены специфические особенности, указывающие на атипию. Информативны не поверхностные и не дегенеративные уротелиальные клетки. Основной маркер — увеличение ядерно-цитоплазматического соотношения (более 0,5) [5]. Дополнительные критерии: гиперхромия, неравномерный, грубый хроматин, неравномерный контур ядра. Если ядерно-цитоплазматическое соотношение более 0,7 и присутствуют два дополнительных признака, необходимо заподозрить уротелиальную карциному высокой степени злокачественности (рис. 2) [6].
.
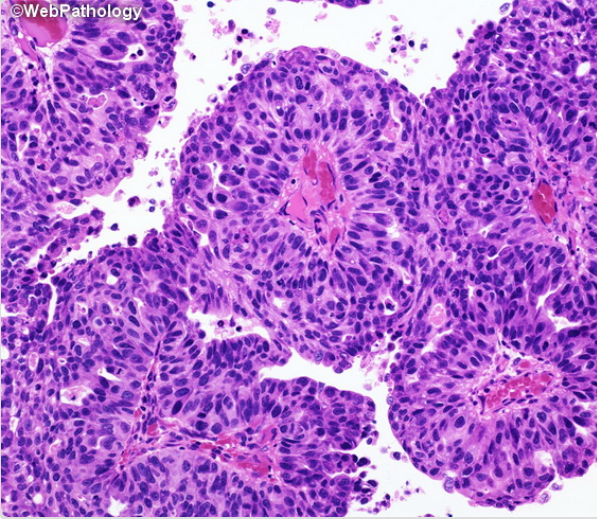
Рисунок 2 | Папиллярная уротелиальная карцинома High Grade
Выраженная тканевая и клеточная атипия. Внутри папиллярных структур опухолевые клетки расположены хаотично, с утратой полярности. Значительный полиморфизм ядер, гиперхромность, отчетливые ядрышки. Митотическая активность увеличивается, фигуры митоза отмечаются во всех слоях уротелия. Единичные очаги некроза [8].
Цитологические критерии уротелиальной карциномы высокой степени злокачественности: высокое ядерно-цитоплазматическое соотношение, неравномерный контур мембран ядер, эксцентрическая локализация ядра, крупные, полиморфные ядра, выраженные ядрышки (рис. 3.1, 3.2) [7], могут обнаруживаться признаки плоскоклеточной и железистой дифференцировки (рис. 4) [8].
.
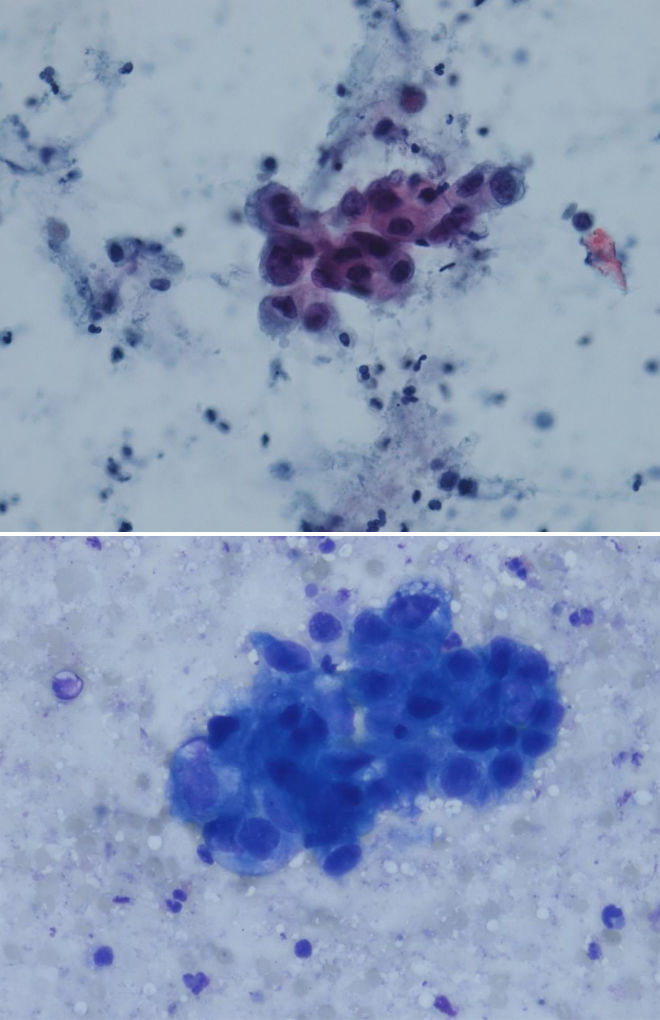
Рисунки 3.1 и 3.2 | Папиллярная уротелиальная карцинома High Grade
Крупные ядра с высоким ядерно-цитоплазматическим соотношением, грубый хроматин и нечеткие, размытые контуры ядра (окраска Papanicolaou и DiffQuik) [9].
.
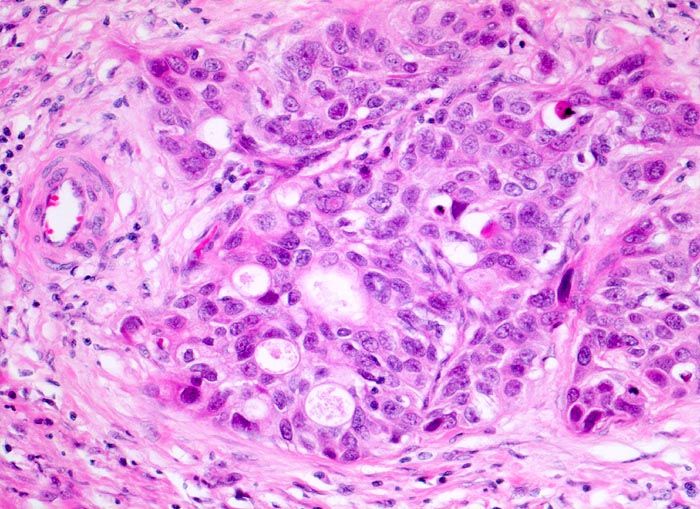
Рисунок 4 | Папиллярная уротелиальная карцинома High Grade с формированием железистых структур [10]
Фундаментальное понимание явления атипизма как отличия от нормы может рассматриваться в различных аспектах. Помимо морфологического атипизма, в опухолевой клетке наблюдается антигенный, функциональный, метаболический атипизм. Морфологию, в свою очередь, можно рассматривать на уровне электронной микроскопии, анализируя ультраструктуры клетки (патологию рибосом, митохондрий, мембранных структур, компонентов цитоскелета и т. д.). В рутинной практике большее значение имеет все же светооптический уровень исследования. Для снижения доли субъективизма в определении различных степеней «атипичности» в доставленном материале требуются как четкие критерии каждого этапа анапластических изменений, так и внедрение систем анализа изображений.
Источники:
- Liu J. The "life code": A theory that unifies the human life cycle and the origin of human tumors. Semin Cancer Biol. 2019; pii:S1044-579X(19)30053-7.
- Niu N., Mercado-Uribe I., Liu J. Dedifferentiation into blastomere-like cancer stem cells via formation of polyploid giant cancer cells. Oncogene. 2017;36(34):4887-4900.
- Orr B., Maiato H. No chromosome left behind: The importance of metaphase alignment for mitotic fidelity. J Cell Biol. 2019;218(4):1086–1088.
- Taipale J.The chromatin of cancer. Science. 2018;362(6413): 401-402.
- Sanfrancesco J., Jones J.S., Hansel D.E. Diagnostically challenging cases: what are atypia and dysplasia? Urol Clin North Am. 2013;40(2):281–293.
- Compérat E.M. et al. Grading of Urothelial Carcinoma and The New "World Health Organisation Classification of Tumours of the Urinary System and Male Genital Organs 2016". Eur Urol Focus. 2019;5(3):457-466.
- Tan T.Z., Rouanne M., Tan K.T., Huang R.Y., Thiery J.P. Molecular Subtypes of Urothelial Bladder Cancer: Results from a Meta-cohort Analysis of 2411 Tumors. Eur Urol. 2019;75(3):423-432.
- Изображение предоставлено Dharam М. Ramnani, MD; база электронных изображений WebPathology;
- Изображение предоставлено Nicole K. Andeen, M.D. и Maria Tretiakova, M.D;
- База электронных изображений the University of Basel;
