Донорство митохондрий в клинической практике

Законодательство, принятое палатой лордов в 2015 году, позволило проводить пересадку митохондрий на территории Соединенного Королевства с целью предотвращения тяжелых митохондриальных заболеваний. Регулирование этой процедуры было поручено управлению по репродукции и эмбриологии человека, которое в 2017 году предоставило свою первую лицензию объединению больниц Фонда национальной службы здравоохранения (NHS) Ньюкасла-апон-Тайн. В настоящее время услуги по пересадке митохондрий (или «дети от трех родителей», как эту технологию называют в СМИ) в Англии и Уэльсе оказывает NHS.
В 2016 году сообщалось, что женщина из Мексики родила здорового мальчика после пересадки веретена ооцитов, чтобы предотвратить передачу наследственной патологии митохондриальной ДНК (мтДНК) [1]. Однако настораживает, что метод стал применяться для лечения бесплодия во многих центрах репродуктологии по всему миру [2]. Понятие донорства митохондрий объединяет ряд методов, предназначенных для переноса митохондрий из одной клетки в другую. Эти методы включают в себя перенос цитоплазмы (с митохондриями) из донорского ооцита в ооцит или эмбрион реципиента. Перенос, как правило, осуществляется путем добавления или обмена небольшой доли общего цитоплазматического объема, как, например, при процедуре, которая была предложена в качестве лечения связанного с возрастом бесплодия.
Более экстремальная форма донорства митохондрий представляет собой обмен как можно большего объема цитоплазмы. Такая процедура была разработана с целью предотвращения передачи наследственных заболеваний мтДНК. На практике этот процесс достигается путем удаления пронуклеусов или ядерных веретен и помещения их в донорский эмбрион или ооцит (рис. 1). Перенос донорской цитоплазмы в яйцеклетку будущей матери для лечения женского бесплодия не новость, но мы пока располагаем лишь косвенными данными о связи возрастной дисфункции митохондрий с бесплодием. Пока нельзя со всей уверенностью утверждать, что митохондриальные дефекты, которые наблюдаются в ооцитах, полученных от пожилых женщин, увеличивают риск бесплодия, или же они являются просто случайным побочным эффектом процесса старения.
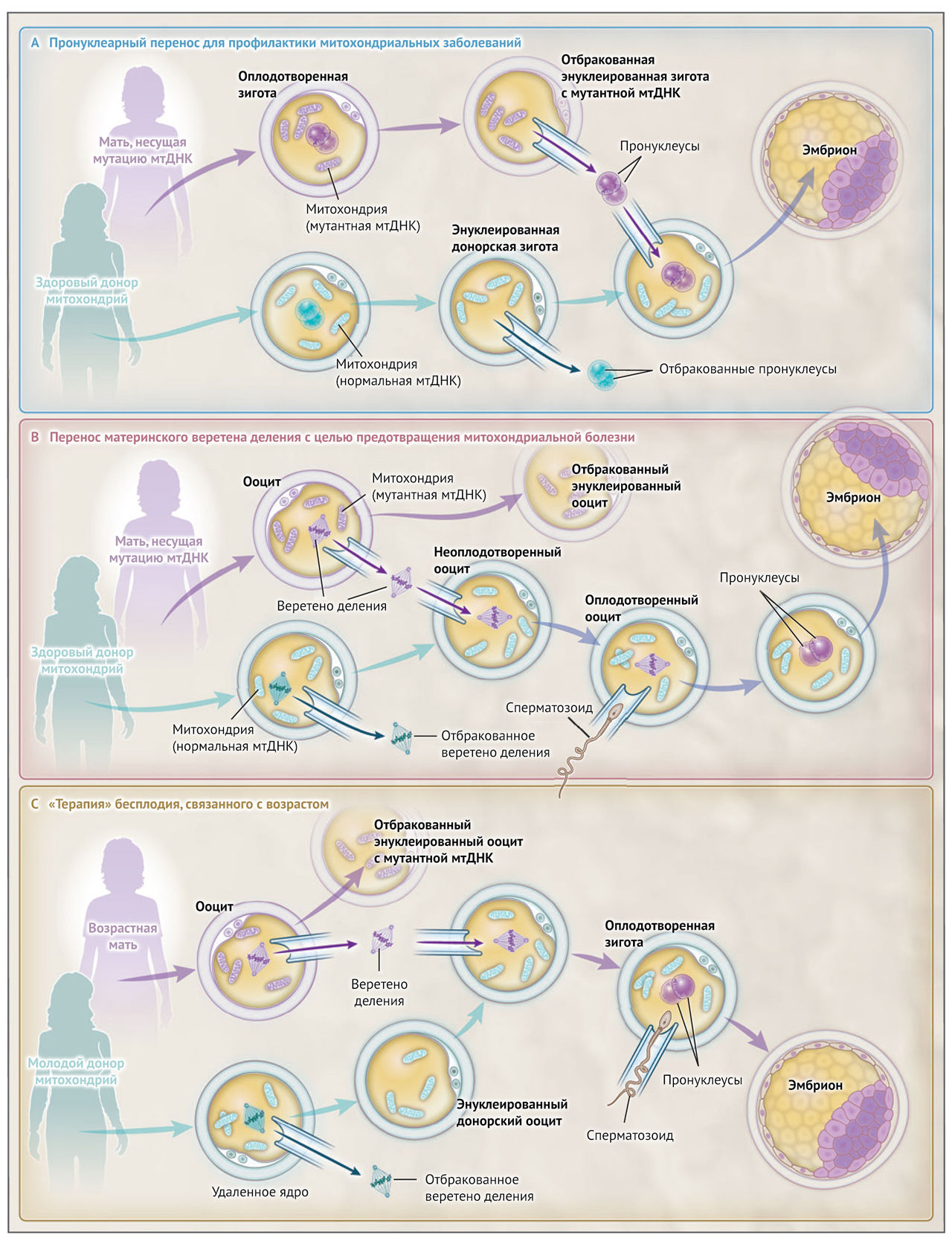
Более того, неизвестно, улучшает ли фертильность перенос митохондрий сам по себе. Описанная в литературе польза от этой процедуры, если она реальна, может быть связана с переносом цитоплазматического содержимого, которое неизбежно сопровождает любую форму митохондриального донорства. Эти опасения лежат в основе недавнего моратория, предложенного Европейским обществом репродукции человека и эмбриологии (ESHRE) на основе рекомендации группы экспертов, которые пришли к выводу, что «применение переноса митохондрий в качестве средства для лечения бесплодия остается сомнительным и недоказанным». Группа также сделала заявление о безопасности этой процедуры: «На данном этапе, и до тех пор, пока эта технология не доказала свою эффективность и безопасность, ESHRE настоятельно не рекомендует использовать донорство митохондрий для терапии бесплодия».
Такое заявление привлекло внимание к новым данным о взаимодействии между митохондриями и ядром клетки [2] и указало на возможность возникновения осложнений. Должно ли беспокойство о последствиях влиять на нашу позицию о донорстве митохондрий в целом, включая его применение для предотвращения редких наследственных заболеваний мтДНК? В конце концов, будущая мать с патогенной мутацией в мтДНК с такой же вероятностью захочет иметь здорового ребенка, как и мать с бесплодием. До 2015 года некоторые свидетельства, что митохондриальный перенос может оказывать неблагоприятное воздействие, основывались на экспериментальной работе по изучению инбредных линий лабораторных мух и мышей, у которых низкий уровень гетерозиготности создает совершенно иную ситуацию, чем в гетерогенной человеческой популяции. У людей мтДНК и ядерная ДНК, по-видимому, свободно комбинируются без каких-либо последствий для организма. Однако в трех лабораториях наблюдался непредвиденный возврат к исходному генотипу мтДНК приблизительно у 15 % клонов эмбриональных стволовых клеток, полученных от эмбрионов человека после переноса митохондрий.
Эти возвраты включали в себя тяжелую патогенную мутацию мтДНК, которая вызывает болезнь Лея (подострая некротизирующая энцефаломиопатия), неврологическое расстройство, которое обычно диагностируется в первые годы жизни [3–5]. Риск реверсии можно снизить с помощью традиционных методов диагностики как до, так и после имплантации, но причины возвратов в исходное состояние неизвестны. В настоящее время есть доказательства того, что митохондрии это не просто клеточные «блоки питания», которые можно заменить, когда они исчерпали свой ресурс. У мышей обмен мтДНК между здоровыми, хотя и инбредными, лабораторными линиями привел к несоответствию между ядерным и митохондриальным геномами, которые не могут сосуществовать в одной и той же линии. Такое несоответствие может привести к кардиометаболическим фенотипам, которые проявляются у мышей только в пожилом возрасте [5].
Тем не менее несколько обезьян, рожденных с использованием этого метода, кажутся здоровыми, что дает некоторую надежду. Не существует объективных доказательств эффективности митохондриального переноса для лечения бесплодия, поэтому его не следует использовать в обычной клинической практике. И будет ли клиническое испытание этого метода этически приемлемым, если есть неопределенность в отношении побочных эффектов? Как это часто бывает в медицине, новые методы лечения сначала тестируются при более тяжелых заболеваниях. Могут ли митохондриальные заболевания стать полигоном для проверки? В отличие от донорства митохондрий с целью лечения бесплодия, использование данного метода для предотвращения митохондриальных заболеваний имеет четкое научное обоснование его преимуществ, но что мы знаем о рисках? Обычно приводится аргумент, что риск возникновения тяжелой неизлечимой болезни мтДНК уравновешивает теоретические риски экспериментального лечения.
Однако предотвращение митохондриальных заболеваний это не то же самое, что лечение митохондриальных заболеваний. До митохондриального переноса ребенка еще нет. Риски для ребенка возникают из-за самого лечения, и основное его преимущество заключается в том, чтобы дать будущим родителям возможность зачать ребенка, который с одной стороны наследует их ядерный геном, а с другой стороны не несет патогенную мутацию мтДНК. В Великобритании управление репродукции человека и эмбриологии разумно обосновало необходимость долгосрочного мониторинга состояния здоровья всех детей, родившихся в результате донорства митохондрий. Поскольку развитие гипотетических побочных эффектов может занять годы, если не десятилетия [6], полное прояснение этих вопросов займет некоторое время. Причина, по которой в настоящее время приемлемо предлагать донорство митохондрий в одном контексте, но не в другом, зависит исключительно от научного обоснования процедуры, а не от риска побочных эффектов. В том случае, если будет установлен механизм предотвращения бесплодия посредством донорства митохондрий, можно будет рассматривать возможность проведения клинического испытания донорства митохондрий для лечения бесплодия, когда все другие варианты потерпели неудачу. До тех пор, пока не будут проведены такие испытания, лечебные центры, предлагающие эту процедуру сегодня, должны прекратить это делать, и врачи должны предупреждать пациентов об отсутствии доказанной эффективности.
