Способ борьбы с болезнью Паркинсона путем преобразования астроцитов в нейроны
Астроциты — это нейроглиальные клетки головного мозга, которые экспрессируют белок, называемый PTB. Выяснилось, что истощение запасов PTB потенцирует превращение астроцитов в нейроны в мышиной модели болезни Паркинсона.
Можно ли заменить нейроны, которые подвергаются дегенерации в черной субстанции среднего мозга при болезни Паркинсона? Совершенно фантастической возможностью стало бы преобразование нейроглиальных клеток, называемых астроцитами, которых много в ткани мозга, в нейроны. В статье для журнала «Nature» Qian и коллеги описали довольно простую стратегию реализации данного механизма, что привело к уменьшению неврологического дефицита в мышиной модели болезни Паркинсона [1]. Их работа, наряду с параллельными исследованиями Zhou и коллег, недавно изложенными в журнале «Cell» [2], имеет большие перспективы в сфере лечения нейродегенеративных заболеваний.
Такие типы клеток, как клетки кожи или астроциты, могут быть преобразованы in vitro (посредством принудительной экспрессии факторов транскрипции, микроРНК или малых молекул) в другие типы клеток, в том числе нейроны [3–8], которые продуцируют молекулы нейротрансмиттера дофамина [5,8]; эти нейроны подвергаются дегенерации при болезни Паркинсона. Такой подход использовался для преобразования астроцитов мышиного мозга в нейроны in vivo [6–8]. Например, астроциты в стриатуме мозга мыши были преобразованы в нейроны, продуцирующие дофамин (iDA), которые могут частично скорректировать моторный дефицит в мышиной модели болезни Паркинсона [8]. Однако нейроны iDA, полученные с использованием вышеизложенного метода, не образовывали протяженных нейрональных связей, характерных для здорового мозга, и не полностью восстанавливали моторную функцию. Две группы исследователей, возглавляемые Qian и Zhou, использовали альтернативную стратегию для эффективного преобразования астроцитов в iDA-нейроны: истощение запасов РНК-связывающего белка, называемого PTB, который экспрессируется в астроцитах и ингибирует дифференцировку нейронов.
Qian и коллеги начали свои эксперименты in vitro, используя астроциты, выделенные из коры и среднего мозга мыши и из коры головного мозга человека. Исследователи использовали молекулу РНК (маленькую РНК-шпильку), чтобы способствовать деградации РНК-мессенджера, транскрибируемого с гена Ptbp1, который кодирует белок PTB. Это вызвало преобразование всех трех типов астроцитов в нейроны. Zhou и его коллеги достигли того же эффекта, используя технику редактирования генома CRISPR-CasRx для уменьшения количества мРНК, синтезируемой с гена Ptbp1 в астроцитах, выделенных из коры головного мозга мыши.
Затем две команды истощали запасы белка PTB in vivo в мозге взрослой мыши. Qian и его коллеги использовали мышей, генетически сконструированных таким образом, что к их астроцитам была тропна маленькая РНК-шпилька, блокирующая ген Ptbp1, которая была перенесена в мозг в составе вирусной конструкции. Zhou и коллеги инфицировали астроциты у мышей дикого типа вирусом, который нес механизм CRISPR-CasRx. Обе стратегии привели к преобразованию астроцитов в клетки нейронального типа.
Затем группы исследователей истощали запасы белка PTB на мышиной модели болезни Паркинсона. У этих животных, как и у людей с данным расстройством, высвобождающие дофамин нейроны черной субстанции подвергаются дегенерации, а уровни дофамина в полосатом теле (области, в которую проецируются эти нейроны) становятся аномально низкими, что приводит к нарушениям в двигательной сфере. Qian с командой исследователей истощали запасы белка PTB астроцитов в черной субстанции, Zhou с коллегами — в стриатуме. Оба подхода дали один и тот же результат: преобразование некоторых инфицированных астроцитов в нейроны, схожие с дегенерировавшими при болезни Паркинсона, и восстановление нормальной двигательной активности.
Обе группы продемонстрировали, что истощение запасов белка PTB стимулирует превращение астроцитов в нейрональные клетки, в значительной степени соответствующие области мозга, в которой они находятся. Как передается эта специфичность? Qian и его коллеги обнаружили, что астроциты в среднем мозге экспрессируют низкие уровни факторов транскрипции Lmx1a и Foxa2; последние являются маркерами предшественников дофамин-высвобождающих нейронов во время развития среднего мозга и необходимы для созревания этих клеток-предшественников в нейроны [9]. Истощение запасов белка PTB еще больше усиливало экспрессию этих факторов в астроцитах среднего мозга. Напротив, в корковых астроцитах лечение приводило к увеличению уровней транскрипционных факторов, связанных с корковыми нейронами, таких как Ctip2 и Cux. Кроме того, преобразование астроцитов в черной субстанции или в соседней области вентрального сегмента приводило к появлению различных подтипов нейронов iDA, которые экспрессируют специфичные для этого подтипа факторы транскрипции и белки: Sox6 и Aldh1a1 в черной субстанции, Otx2 в вентральной области.
Qian и его коллеги получили результаты, показывающие, что специфичные для конкретной области мозга транскрипционные факторы способствуют превращению астроцитов в нейроны типа iDA. Однако такой механизм не объясняет, каким образом Zhou и его коллеги смогли преобразовать астроциты полосатого тела в нейроны iDA, учитывая, что такие астроциты экспрессируют различный набор факторов транскрипции. Каким может быть механизм, приводящий к преобразованию нейронов iDA в стриатуме?
Результаты работы Zhou и его коллег демонстрируют почти трехкратное увеличение эффективности преобразования астроцитов в iDA-нейроны в мышиной модели болезни Паркинсона по сравнению с контрольными мышами через месяц после лечения. Данные результаты предполагают, что сами астроциты или клетки их окружения реагируют на потерю эндогенных дофамин-продуцирующих нейронов экспрессией факторов, способствующих превращению астроцитов в нейроны iDA. Qian и коллеги обнаружили более высокую эффективность преобразования в среднем мозге мыши, чем в изолированных астроцитах среднего мозга, что указывает на роль местных факторов в преобразовании iDA. Выявление локальных и специфических для заболевания факторов — как эндогенных, так и внешних — является ключом к разгадке механизма преобразования астроцитов в нейроны.
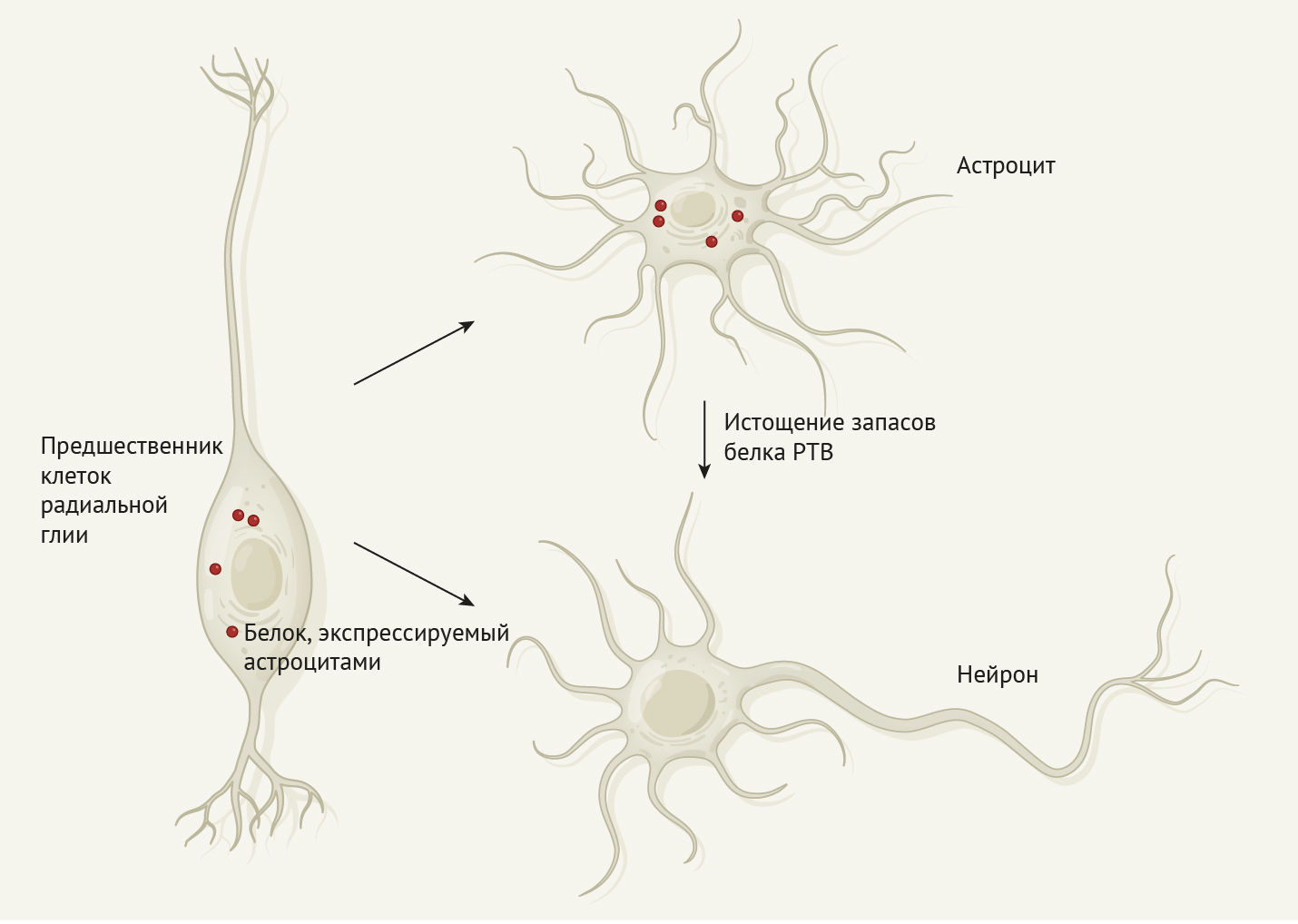
Один интригующий вопрос, который вытекает из данных исследований, заключается в следующем: почему астроциты постоянно репрессируют нейрональные гены? Одно из объяснений может быть связано с развитием клеток. Астроциты и нейроны имеют общих предков, называемых предшественниками радиальной глии. Эти клетки, подобно стволовым, дают начало нейронам, а затем дифференцируются в астроциты и глиальные клетки, поддерживающие нейроны [10]. В развивающемся среднем мозге мыши все типы клеток радиальной глии экспрессируют ген Ptbp1, тогда как дифференцирующиеся предшественники нейронов и сами нейроны — нет [11]. Возможно, астроциты среднего мозга как потомки радиальной глии унаследовали программу по генерации нейронов, которая не активируется до тех пор, пока не истощены запасы белка PTB (Рис. 1). Ген Ptbp1 экспрессируется также в других типах клеток среднего мозга: клетках эндотелия и перицитах в кровеносных сосудах; эпендимальных клетках, выстилающих полость желудочков; иммунных клетках, называемые микроглией. В дальнейших исследованиях необходимо изучить, может ли истощение запасов белка PTB превращать и эти клетки в нейроны iDA на животных моделях болезни Паркинсона.
Чтобы данная технология была полезной в клинической практике, ее эффективность должна быть высокой. Так, 60–65 % инфицированных астроцитов не становятся нейронами iDA. Этот процент может быть уменьшен либо за счет повышения тропности вирусов к астроцитам в черной субстанции, либо за счет введения факторов, которые позволят астроцитам вне черной субстанции превращаться в нейроны iDA. Также необходимо определить качество и подлинность преобразованных клеток iDA на уровне отдельно взятых нейронов и выяснить, генерируются ли нежелательные клетки. Обе группы исследователей, возглавляемые Qian и Zhou, предоставили доказательства того, что астроциты превращаются не только в iDA нейроны, но и в другие их типы. Более того, Qian с коллегами утверждает, что преобразованные нейроны iDA в основном проецируются в перегородку, а не в стриатум, и что только 8 % волокон, которые проецируются в перегородку, происходят из нейронов iDA. Однако есть и хорошая новость: более половины волокон, достигающих полосатого тела, были внесены нейронами iDA. Это открытие — наряду с демонстрацией того, что процесс конверсии астроцитов восстанавливает оптимальные уровни дофамина в полосатом теле и двигательную активность — свидетельствует о значительном функциональном улучшении нигро-стриатального пути нейронами iDA.
В заключительной серии экспериментов Qian и его коллеги исследовали способ, который может быть применим в клинической практике: использование коротких нуклеиновых кислот, называемых антисмысловыми олигонуклеотидами, которые связываются с мРНК и предотвращают ее трансляцию. Авторы утверждают, что локальная доставка антисмысловых олигонуклеотидов, нарушающих синтез белка PTB, приводит к образованию iDA-подобных нейронов и к моторному восстановлению на мышиной модели болезни Паркинсона, что демонстрирует эффективность данного подхода.
В дальнейших экспериментах необходимо изучить вопрос о том, можно ли преобразовывать астроциты среднего мозга или стриатума человека в iDA-нейроны, а также определить, сохранят ли преобразованные типы клеток свою правильную и стабильную функциональную активность в течение длительных промежутков времени. Должна быть тщательно оценена безопасность данного метода, чтобы исключить любые сопутствующие повреждения клеток мозга или преобразованных клеток, а также иные патологии, вызванные уменьшением количества астроцитов. Хотя на многие вопросы еще только предстоит ответить, лаконичность и эффективность этого генно-терапевтического подхода к замене клеток делает его достаточно перспективным. Текущие исследования обещают открыть новую главу в развитии регенеративной медицины для лечения неврологических расстройств, в том числе болезни Паркинсона.
