Диабетическая ретинопатия: диагностика и лечение
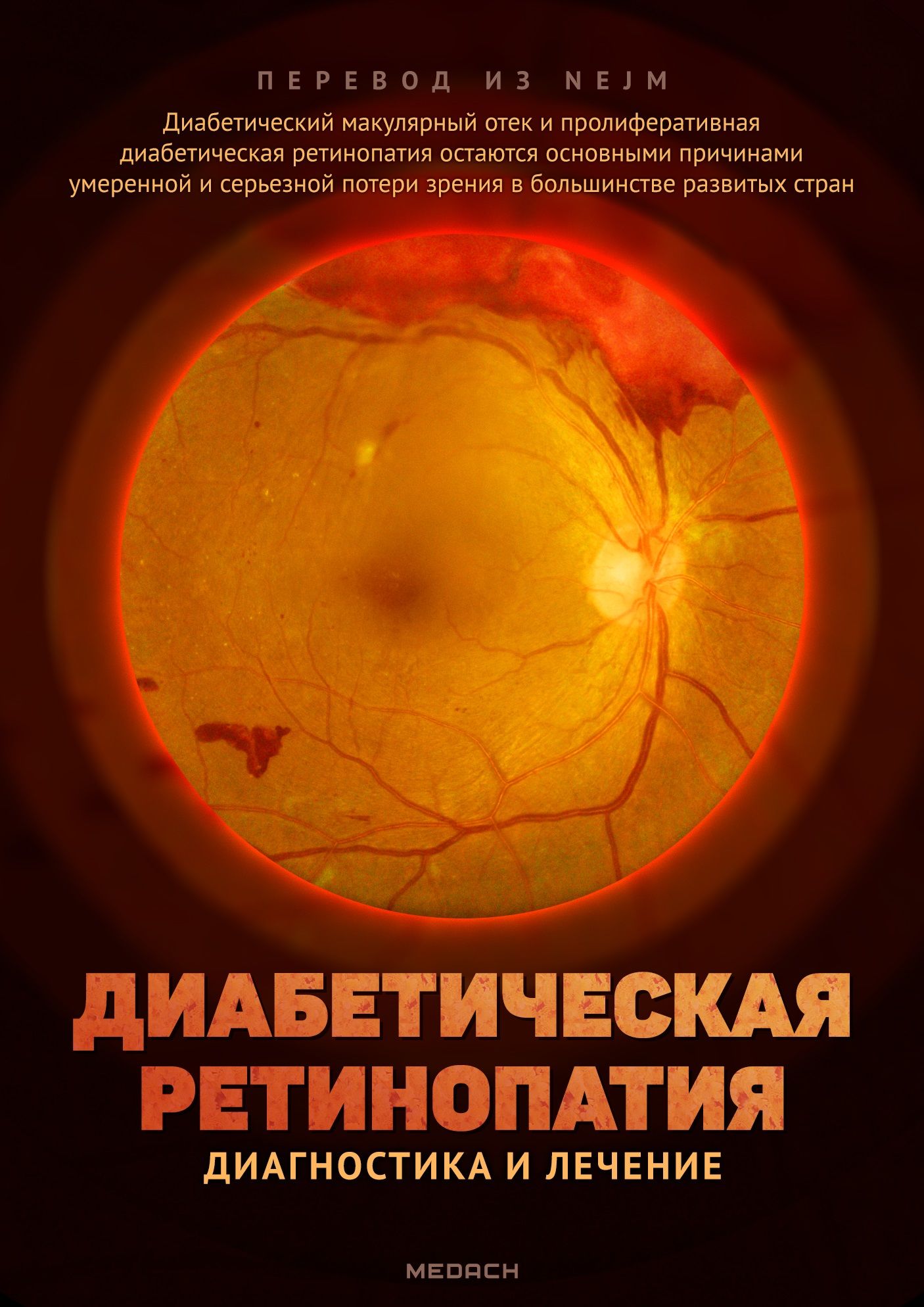
Повреждение сетчатки, известное как «диабетическая ретинопатия», является общепризнанным осложнением уже на протяжении многих веков. За последнее десятилетие прогресс в технологии визуализации сетчатки и разработке новых методов лечения значительно улучшил клиническую оценку и результаты лечения пациентов с диабетической ретинопатией. Тем не менее, диабетический макулярный отек и пролиферативная диабетическая ретинопатия остаются основными причинами умеренной и серьезной потери зрения в большинстве развитых стран. В этой статье рассматривается и обсуждается мировое влияние диабетической ретинопатии последние изменения в клинической диагностике и лечении пациентов.
Диабет и диабетическая ретинопатия: мировые тенденции
В большинстве случаев ретинопатия развивается через 10–15 лет после того, как был диагностирован диабет. По мере роста заболеваемости диабетом все большее количество людей подвергаются риску ретинопатии, для диагностики и лечения которой требуются большие денежные ресурсы. Ожидается, что к 2045 году во всем мире 629 миллионов человек будут болеть сахарным диабетом. Распространенность диабета растет как в развивающихся, так и в развитых странах. В Китае распространенность диабета возросла с 1 % в 1980 году до 11,6 %, причем в 2013 году диагноз был поставлен 114 миллионам человек. В 2018 году предполагаемая распространенность диабета среди взрослых в Соединенных Штатах составила 10,2 % (26,8 миллионов случаев). В 2019 году заболевание стало причиной 4,2 миллионов смертей во всем мире, что обошлось здравоохранению США в 760 миллиардов долларов. Эффективная и точная диагностика диабетической ретинопатии, оценка риска и лечение имеют решающее значение, учитывая распространенность этой болезни. Во всем мире с 1990 по 2010 год нарушение зрения из-за диабетической ретинопатии увеличилось на 64 %, а слепота — на 27 %. К 2010 году диабетическая ретинопатия стала причиной 3,7 миллионов случаев нарушения зрения и более 833 000 случаев слепоты во всем мире, а заболевания глаз, связанные с диабетом, были пятой наиболее распространенной причиной потери зрения от умеренной или серьезной степени вплоть до необратимой слепоты. К счастью, недавний прогресс в диагностике, клинической оценке и лечении заболеваний глаз, связанных с диабетом, помогают уменьшить общую долю потери зрения в некоторых странах, особенно в тех, где имеются общенациональные программы скрининга диабетической ретинопатии.
Патогенез диабетической ретинопатии
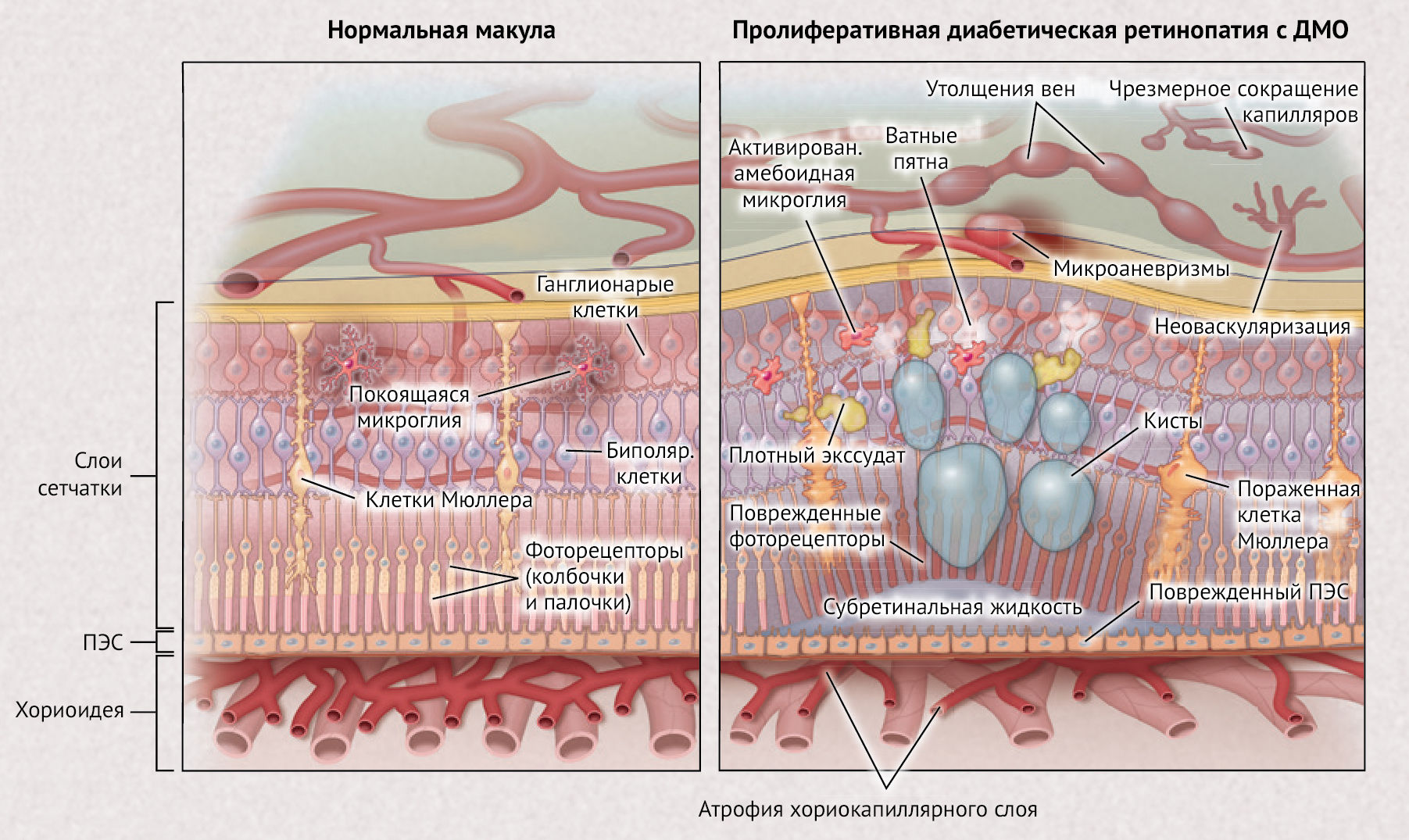
Давность заболевания и степень гликемического контроля оказывают основное влияние на развитие диабетических осложнений (рис. 1). Однако известные факторы риска являются относительно неблагоприятными предикторами развития или прогрессирования ретинопатии, исследования генетических взаимосвязей вызвали разочарование. Фатальные для зрения осложнения обычно возникают из-за повышенной проницаемости сосудов сетчатки, осложнений, связанных с развитием неоваскуляризации сетчатки или передней камеры, а также выраженной васкулопатии сосудов центральной сетчатки. Были описаны различные механизмы, лежащие в основе диабетической ретинопатии. Противовоспалительные лекарственные средства, например, глюкокортикоиды, могут эффективно бороться с диабетическим макулярным отеком и снижать частоту осложнений пролиферативной диабетической ретинопатии, свидетельствуя о том, что воспаление может быть ключевым компонентом патогенеза. Также неизвестно, начинается ли диабетическая ретинопатия как васкулопатия или невропатия. Истончение внутренних слоев сетчатки предшествует клиническим признакам васкулопатий, связанных с диабетом. Кроме того, психометрическое тестирование показало, что нейроны начинают аномально функционировать еще до развития видимой васкулопатии, однако наличие нейропатии все еще нельзя считать предиктором развития васкулопатии. Ишемия сетчатки приводит к гипоксии тканей и проявляется в виде капиллярной непроходимости. Гипоксия является мощным индуктором экспрессии фактора роста эндотелиоцитов (VEGF), что приводит к повышению концентрации VEGF в стекловидном теле и сетчатке. VEGF является мощным регулятором процесса ангиогенеза и проницаемости сосудов. В экспериментальных животных моделях, ишемия сетчатки или введение VEGF в стекловидное тело могут вызвать сосудистые изменения, которые аналогичны диабетической ретинопатии, а ингибиторы VEGF могут блокировать процесс. По мере развития диабетической ретинопатии имеет место развитие некоторых аберрантных процессов, причем как параллельно друг другу, так и отдельно. Повышенная проницаемость сосудов сетчатки может вызвать утолщение макулярной зоны (диабетический макулярный отек) из-за присутствия в данной области интраретинальной и субретинальной жидкости (рис. 2). Диабетический макулярный отек является основной причиной потери зрения (часто определяемой как потеря трех или более строк по таблице проверки зрения, на которой одна линия равна пяти буквам-оптотипам; имеется в виду шкала Снеллена — аналог шкалы Сивцева, используемый в США — прим. ред.). Когда ишемия сетчатки распространяется шире, она может вызвать потерю зрения из-за дисфункции или гибели нервных клеток сетчатки, включая светочувствительные фоторецепторы сетчатки. Пролиферативная диабетическая ретинопатия может развиваться с явлением неоваскуляризации в диске зрительного нерва, радужной оболочке или в других местах по всей сетчатке; этот процесс и связанные с ним осложнения, такие как кровоизлияние в стекловидное тело, центральная ишемия сетчатки и тракционная отслойка сетчатки, являются основными причинами потери зрения у пациентов с диабетом.
Достижения в визуализации
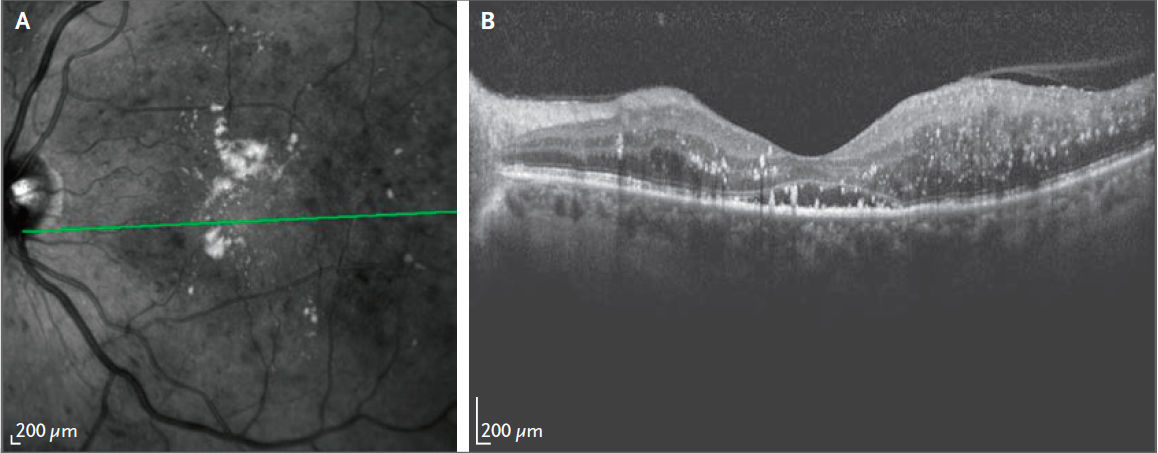
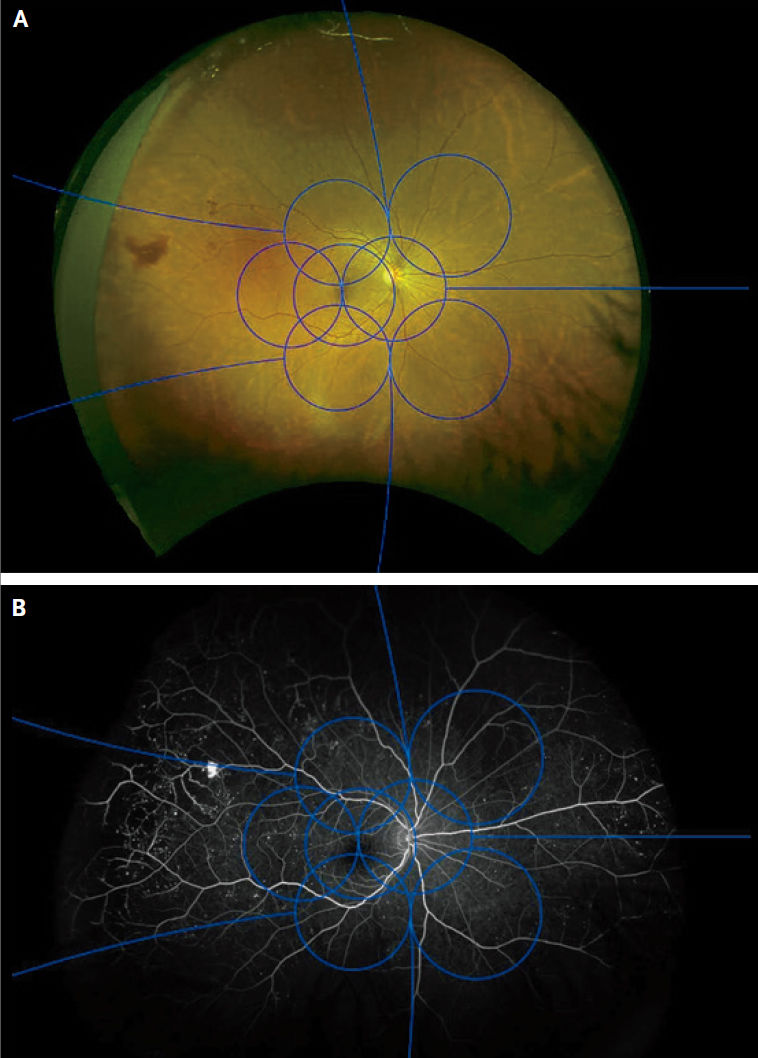
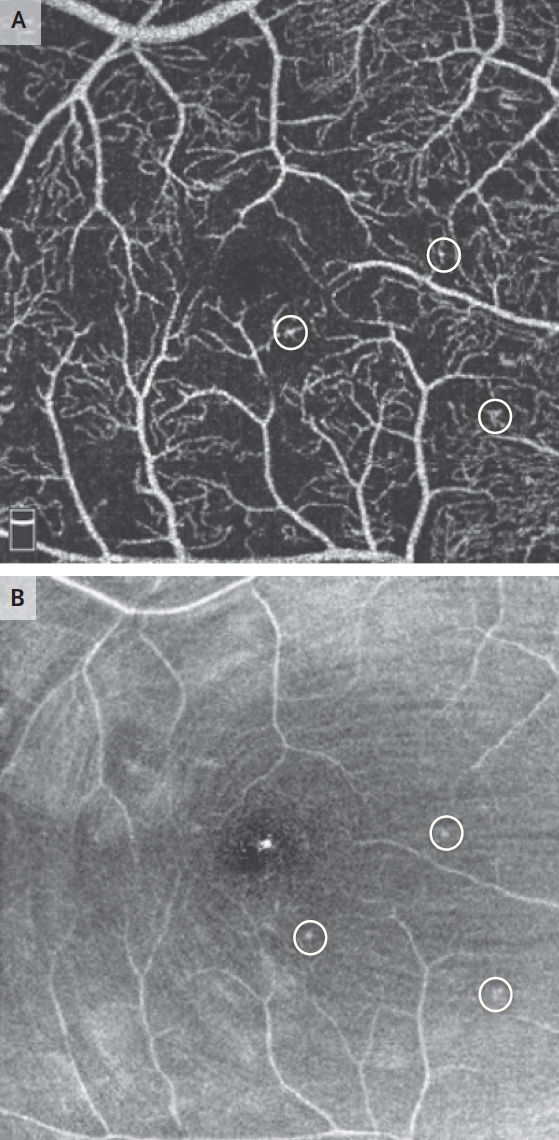
В отличие от многих других органов и тканей, морфологические признаки сетчатки можно просмотреть непосредственно с помощью неинвазивной визуализации в кабинете офтальмолога. Исторически клиническая оценка степени диабетической ретинопатии основывалась на проведении стандартной цветной фоторегистрации сетчатки глаза, которая могла использоваться для визуализации приблизительно одной трети поверхности сетчатки (задней), и на флюоресцентной ангиографии, в ходе которой пациенту внутривенно вводили флюоресцентный краситель для оценки структуры и проницаемости сосудов. Более современная методика под названием сверхширокоугольная фоторегистрация глазного дна, позволяет оценить более 80 % поверхности сетчатки на одном изображении (см. рис. 3А и 3В). Морфологические признаки, зафиксированные на периферии сетчатки, которые не видны на стандартных фотографиях глазного дна, могут быть связаны с повышенным риском прогрессирования ретинопатии. Кроме того, с развитием все более сложных методов, таких как, например, оптическая когерентная томография (ОКТ) врачи могут неинвазивно оценивать структуры сетчатки как во фронтальном, (см. рис. 2А) так и в поперечном разрезе (рис. 2В), включая степень и местоположение утолщенного участка сетчатки и морфологические изменения в слое нервных волокон сетчатки, которые могут оказывать влияние на зрительные функции. Еще более современная технология, получившая название ОКТ-ангиография, позволяет осуществлять неинвазивную визуализацию и проводить морфологическую оценку перфузированных сосудов сетчатки (рис. 4). ОКТ-ангиография позволяет визуализировать движение кровяных клеток, которое в последующем используется для составления карты перфузии в трех слоях сосудов сетчатки. Учитывая повреждение сосудов микроциркуляторного русла сетчатки, которое происходит на ранних стадиях диабетической ретинопатии, количественное определение аномалий сосудистой сети сетчатки может быть очень информативным в контексте оценки прогрессирования диабетической ретинопатии. Однако этот метод не так уж легко использовать для оценки проницаемости сосудов или величины кровотока. Таким образом, флюоресцентная ангиография остается важным диагностическим методом для обнаружения просачивания (то есть повышенной проницаемости) сосудов. Другой сложный метод визуализации включает технологию адаптивной оптики. Этот метод может быть использован в сочетании со сканирующей лазерной офтальмоскопией, либо с ангиографией сетчатки с регистрацией кровотока. Благодаря измерению оптических дефектов глаза и использованию технологии деформируемых зеркал для коррекции возникающих аберраций во фронте волны, отраженной от глаза, адаптивная оптика неинвазивно приводит к пространственному разрешению сетчатки (вплоть до капилляров диаметром около 2 мкм), позволяющему визуализировать отдельные фоторецепторы и эритроциты. Вместе эти новые технологии позволяют неинвазивно произвести беспрецедентную оценку структуры сетчатки и патологических очагов в ней. Однако использование таких современных технологий визуализации может быть затруднено из-за отсутствия наработанной технологии, уверенности в надежности и технической сложности получения высококачественных изображений, а также из-за высокой стоимости данных процедур. По мере продвижения в опыте работы с современными технологиями визуализации, с приобретением опыта и большого числа данных, полученных с применением современных методов визуализации, искусственный интеллект (ИИ) вкупе с технологиями глубокого обучения будут применяться и к изображениям сетчатки, чтобы идентифицировать факторы, которые связаны с результатами ретинопатии. В частности, было показано, что подходы ИИ эффективны при выявлении ретинопатии на определенных стадиях, включая стадии, требующие направления к офтальмологу с целью осмотра сетчатки. Дополнительные усилия направлены на выявление особенностей изображения сетчатки, которые могут предсказать риск ухудшения ретинопатии и появления нежелательных реакций на лечение. Становится ясно, что, поскольку новые методы визуализации предоставляют более подробную и более обширную информацию, а компьютеризированные подходы анализируют эту информацию по-новому, вероятно, появятся открытия, которые позволят выявить самые ранние изменения в диабетической ретинопатии и предсказать прогрессирование или же регрессию заболевания.
Изменения в тенденциях лечения диабетической ретинопатии
До начала 1970-х годов абляция гипофиза была основным методом лечения тяжелой степени диабетической ретинопатии, несмотря на ее ограниченную эффективность и частые, часто тяжелые осложнения, вплоть до летального исхода. С появлением панретинальной лазерной фотокоагуляции в 1970-х годах риск полной потери зрения из-за пролиферативной диабетической ретинопатии снизился более чем на 90 %. Фокусное лазерное лечение диабетического макулярного отека уменьшило связанный с этим риск потери зрения на 50 %. Благодаря таким успехам в развитии технологий, значительно улучшились, диагностика, классификация и лечение диабетиков с риском потери зрения. Как отмечалось выше, повышенные концентрации VEGF в заднем сегменте сетчатки глаза играют важную роль в развитии диабетической ретинопатии и диабетического макулярного отека. Проницаемость и ангиогенные эффекты VEGF у пациентов с диабетической ретинопатией послужили основанием для разработки терапии, нацеленной на VEGF. Исследования, отвечающие на вопрос, может ли введение антител к VEGF в стекловидное тело уменьшить диабетический макулярный отек, приостановить пролиферативную диабетическую ретинопатию и улучшить остроту зрения, послужили началу многочисленных клинических испытаний, которые в последующем изменили стандарты лечения диабетической ретинопатии и диабетического макулярного отека. Эти исследования описаны ниже.
Диабетический макулярный отек
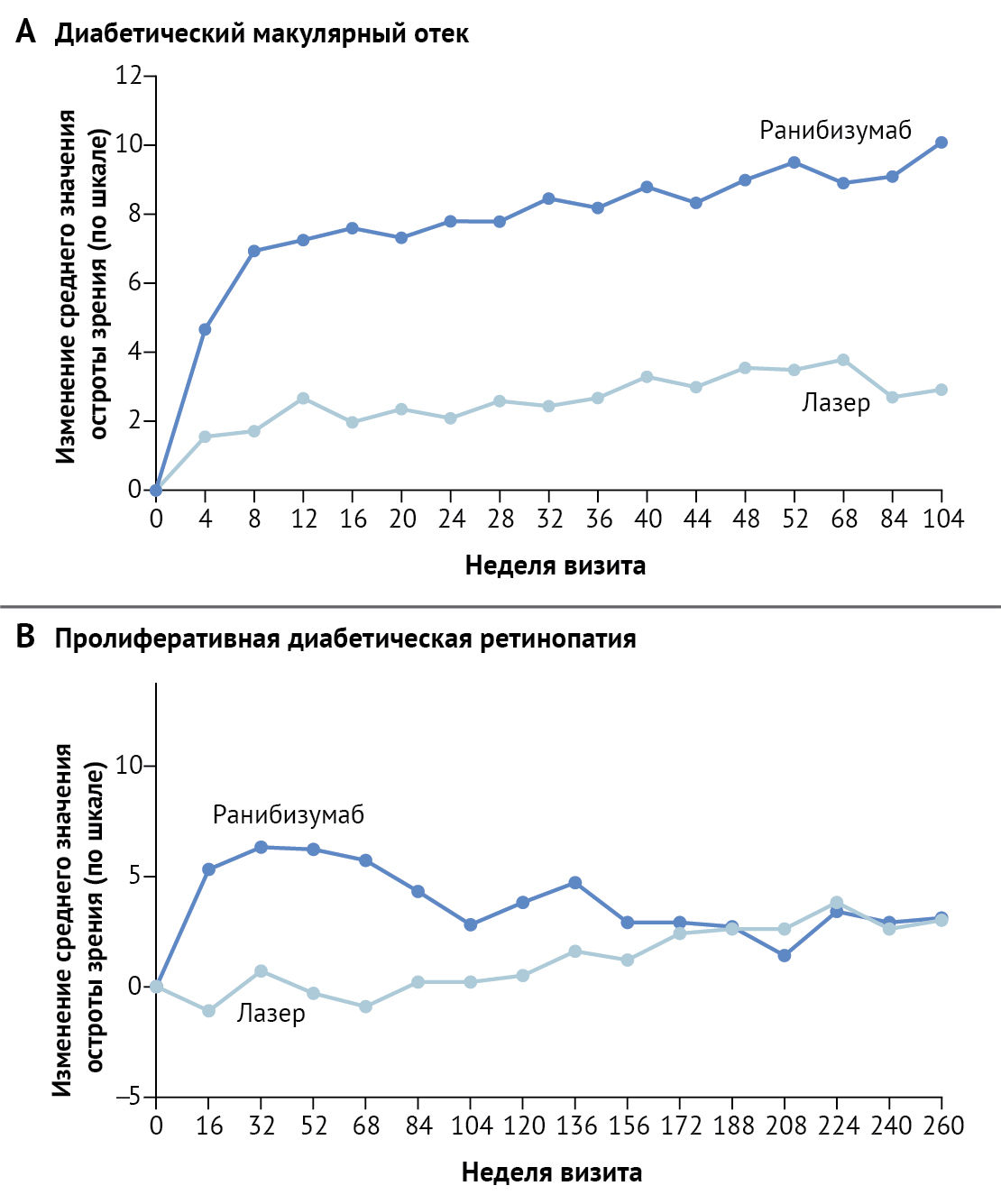
В 2010 году сеть Retric Network DRCR (сеть клинических исследований диабетической ретинопатии) показала, что интравитреальные инъекции ранибизумаба, антитела к VEGF с немедленным или отсроченным лазерным лечением диабетического отека макулы или отсроченным лечением макулярного отека с помощью лазерных технологий, превосходят использование одного лишь лазера в лечении отека, сопровождающегося нарушением зрения (рис. 5). Через 1 год после терапии показатели зрения у 88 из 188 пациентов (47 %), случайным образом распределенных в группу получавших ранибизумаб, улучшились на две или более строчки на таблице проверки зрения по сравнению с 81 из 293 пациентами (28 %), получавших только терапию лазером (относительный риск улучшения, 1,68 [95 % доверительный интервал, 1,27–2,21; P < 0,001]). И наоборот, только у шести пациентов, получавших ранибизумаб (3 %), зрение ухудшилось на две или более линий на таблице проверки зрения по сравнению с 39 пациентами, получавшими только лазер (13 %). Изменение остроты зрения в пределах двух линий зрения на таблице проверки зрения обычно считается клинически значимым. Впоследствии, несколько крупных рандомизированных исследований расширили первоначальные выводы Retina Network DRCR, показав, что другие препараты-антитела к VEGF (бевацизумаб и афлиберцепт) также превосходили лазерное лечение. Как афлиберцепт, так и ранибизумаб были одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для лечения диабетического макулярного отека. Из-за высокой эффективности в лечении диабетического макулярного отека и улучшении зрения терапия интравитреальным введением анти-VEGF в целом заменила лазерную терапию во всем мире в качестве исходного стандартного лечения для пациентов с потерей зрения из-за диабетического макулярного отека.
До применения лекарственных средств против VEGF большой популярностью среди врачей пользовалась интравитреальная терапия глюкокортикоидами. Однако в 2008 году Retina Network DRCR показала, что лазерная фотокоагуляция превосходит терапевтический эффект интравитреальных инъекций триамцинолона при диабетическом макулярном отеке. Также было показано, что глюкокортикоиды, такие как имплантаты с флюоресцирующим ацетонидом и дексаметазоном, замедляют утолщение сетчатки и улучшают зрение. Но интравитреальное введение глюкокортикоидов приводит к повышенному риску возникновения катаракты, требующей хирургического вмешательства, и может вызвать повышение внутриглазного давления и глаукому. Учитывая изменчивую эффективность глюкокортикоидов и большие вопросы к безопасности этих методов для зрения, терапия антителами к VEGF стала основным средством лечения диабетического макулярного отека.
С быстрым переходом к использованию инъекций анти-VEGF препаратами для лечения диабетического макулярного отека возник ряд проблем. Препараты против VEGF обычно удаляются из глаз в течение месяца после инъекции, однако продолжительность лечебного эффекта может варьироваться. Частота инъекций и общая продолжительность лечения для достижения адекватных результатов в настоящее время также неизвестны. Тем не менее, в исследовании Retina Network DRCR, оценивающем эффект ранибизумаба при терапии диабетического макулярного отека, был разработан алгоритм лечения, который позволил сократить количество инъекций с течением времени, если был достигнут либо терапевтический эффект, либо стабильность состояния. В этом исследовании лечение проводилось каждый месяц в течение полугода (но только в случае, пока не разрешился диабетический макулярный отек и зрение было 20/20 на четвертом или пятом месяце). Через шесть месяцев, согласно терапевтическому алгоритму, лечение можно прекратить, если после двух последовательных инъекций зрение и толщина макулы остаются стабильными. Нет прямого сравнения этого подхода с ежемесячным лечением или применением препаратов раз в два месяца. Однако с использованием этого алгоритма медиана из 8, 2, 1 и 0 инъекций вводилась в 1, 2, 3 и 4 годы соответственно с сохранением эффекта в течение всех 5 лет. Полученный эффект был аналогичен тому, который был достигнут в исследованиях с более частым и даже ежемесячным применением препарата. Этот подход, по-видимому, уменьшил бремя лечения для пациентов и врачей и сэкономил деньги (например, для пациентов, поставщиков страховых услуг и Medicare) для сохранения зрительной функции.
Решение отдельно взятого врача относительно того, какой анти-VEGF препарат использовать, является многогранным и зависит от эффективности, доступности и стоимости препарата. В 2020 году компенсация за каждую инъекцию, допустимая страховой компанией Medicare, составляла 1876 долларов для афлиберцепта (2,0 мг на 0,05 мл), 1030 долларов для ранибизумаба (0,3 мг на 0,05 мл) и приблизительно 65 долларов для бевацизумаба (1,25 мг на 0,05 мл). Прямое сравнение этих ингибиторов VEGF в исследовании Retina Network с участием 660 пациентов с диабетическим макулярным отеком показало, что все три препарата приводят к улучшению остроты зрения и уменьшению утолщения сетчатки. Когда острота зрения была относительно хорошей в начале лечения (эквивалент Снеллена от 20/32 до 20/40), средняя острота зрения через 2 года была одинаковой для всех трех агентов против VEGF. Однако когда начальная острота зрения была 20/50 или хуже, лечение афлиберцептом приводило к лучшему увеличению остроты зрения через 2 года, чем лечение бевацизумабом.
Последние результаты, полученные сетью Retina Network DRCR, позволяют предположить, что, когда исходная острота зрения в глазу с диабетическим макулярным отеком составляет 20/25 или выше, наблюдение врачом является более разумной стратегией, чем немедленная анти-VEGF-терапия или лечение лазером, при условии, что за пациентом внимательно следят и в случае ухудшения зрения прибегают к терапии анти-VEGF препаратами. В рандомизированном слепом плацебо-контролируемом исследовании начальных подходов к лечению диабетического макулярного отека, афлиберцепт, лазерная терапия и наблюдение за пациентом были связаны со статистически сходными показателями потери зрения через 2 года (16 % с афлиберцептом, 17 % с лазером и 19 % с одним лишь наблюдением).
Большинство пациентов, страдающих диабетическим макулярным отеком реагируют на терапию VEGF-ингибиторами определенной степенью анатомического улучшения, улучшения зрения или обоих, но почти у 40 % глаз полное разрешение диабетического макулярного отека не достигается. Добавление интравитреальной терапии глюкокортикоидами к лечению препаратами ингибиторами VEGF замедляет процесс утолщения сетчатки, но не улучшает показатели зрения у пациентов. При обычной клинической терапии неполный ответ на лечение анти-VEGF препаратами часто обусловлен неправильным режимом дозирования или неадекватным количеством инъекций, что могло произойти в результате различных факторов, связанных с пациентом и врачом, включая трудности с частыми визитами для адекватного лечения. Последующие посещения один раз в пять лет, которые необходимы через три года после того, как пациенты закончили участие в двухлетнем испытании анти-VEGF-терапии для лечения диабетического макулярного отека, показали, что в среднем зрение через пять лет было лучше, чем в начале исследования, но ухудшалось в течение трех лет стандартной терапии.
Пролиферативная диабетическая ретинопатия
При отсутствии лечения почти половина пациентов, у которых развивается пролиферативная диабетическая ретинопатия, входят в группу риска полной потери зрения из-за связанных с ретинопатией осложнений, включая отслоение сетчатки и кровоизлияние в стекловидное тело. С 1970-х годов пролиферативная диабетическая ретинопатия лечится панретинальной лазерной фотокоагуляцией, которая эффективна для сохранения центрального зрения, но может приводить к обострению отека желтого пятна, потерей поля зрения, нарушением ночного видения и потерей контрастной чувствительности. Совсем недавно два рандомизированных исследования предоставили доказательства того, что анти-VEGF-терапия может успешно использоваться в качестве альтернативы панретинальной лазерной фотокоагуляции для лечения пролиферативной диабетической ретинопатии. Исследование CLARITY показало, что через 1 год пациенты, случайным образом отнесенные к группе, получающей терапию афлиберцептом, имели лучшую остроту зрения, чем пациенты из группы получающих терапию при помощи панретинальной лазерной фотокоагуляции. Рандомизированное исследование Retina Network DRCR показало, что результаты, сравниваемые по остроте зрения с ранибизумабом, не уступали результатам, полученным при панретинальной лазерной фотокоагуляции через два года и пять лет. Как в исследованиях CLARITY, так и в исследованиях Retina Network DRCR, пациенты, получающие анти-VEGF терапию, реже страдали диабетическим макулярным отеком и не так часто теряли поля зрения в течение исследования.
Тем не менее, существуют определенные сложности для широкомасштабного применения анти-VEGF терапии пролиферативной диабетической ретинопатии. Требуются частые инъекции анти-VEGF, а для некоторых пациентов соблюдение режима частых посещений является сложной задачей. Продолжительность действия препарата в течение пяти лет, несмотря на максимальные усилия по протоколу Retina Network DRCR, составила только 66 %, исключая пациентов, которые умерли. В одном большом ретроспективном когортном исследовании 584 из 2302 пациентов (25,4 %) с пролиферативной диабетической ретинопатией выбыли из исследования в течение 4-х лет. Появляется все больше доказательств того, что лечение анти-VEGF вряд ли улучшает перфузию сетчатки и может не предотвратить постепенное прогрессирование неперфузии или потерю периферического поля зрения, что ассоциированно с прогрессированием заболевания глаз, связанного с диабетом. После прекращения анти-VEGF-терапии может произойти существенная потеря зрения, так как рецидивирующая неоваскуляризация приводит к серьезным осложнениям, таким как тракционная отслойка сетчатки или неоваскулярная глаукома. Таким образом, панретинальная лазерная фотокоагуляция может быть более подходящим начальным терапевтическим подходом для некоторых пациентов. Некоторые врачи используют комбинацию панретинальной лазерной фотокоагуляции и анти-VEGF-терапии, однако этот подход и его результаты не были надлежащим образом оценены в многоцентровых рандомизированных клинических испытаниях.
Частые инъекции VEGF-ингибиторов, в частности афлиберцепта или ранибизумаба, обходятся дороже, чем панретинальная лазерная фотокоагуляция (начальная ставка возмещения Medicare за фотокоагуляцию 351 доллар), даже если лазерная фотокоагуляция осуществляется более одного раза, как это было в среднем в описанных выше испытаниях. При выборе терапевтического подхода для пациента с пролиферативной диабетической ретинопатией необходимо учитывать эффективность лечения, вероятность соблюдения режима и стоимость лечения.
Соображения на будущее
Несмотря на то, что глобальная распространенность диабета увеличивается, недавние успехи в оказании медицинской помощи приводят к снижению частоты потери зрения в группах населения, которые надлежащим образом обследуются и получают своевременный доступ к медицинским услугам. За последние четыре десятилетия в США и других развитых странах показатели пролиферативной диабетической ретинопатии и полной потери зрения существенно снизились. Впервые за последние пять десятилетий диабетическая ретинопатия больше не является основной причиной слепоты среди людей трудоспособного возраста в Англии и Уэльсе, что, как полагают, отчасти является результатом активного внедрения национальных программ скрининга и лечения. Поскольку распространенность диабета во всем мире продолжает быстро расти, крайне важно обеспечить доступность медицинских достижений и улучшить надлежащий уход для пациентов по всему миру.
На сегодняшний день, безусловно, все еще существует потребность в модернизации терапевтических подходов. Расходы, которые частые интравитреальные инъекции накладывают на пациентов и медицинских работников, является очень ощутимым и дорогостоящим. Кроме того, многие пациенты с диабетическим макулярным отеком не дают полного ответа на терапию: отек у них не разрешается полостью, причем зрение у такого пациента может быть 20/20 или лучше. Проводятся исследования, оценивающие VEGF-независимые способы лечения, которые могут быть нацелены на повышение терапевтической эффективности, и альтернативные механизмы доставки, которые неинвазивны или обеспечивают более длительную продолжительность действия. Изучаются также подходы к предотвращению возникновения диабетической ретинопатии или замедлению ухудшения ранее существовавшей диабетической ретинопатии. Наконец, учитывая ограниченные ресурсы и резкое глобальное увеличение диабета, существует существенная необходимость в выявлении риска ретинопатии и прогрессирования потери зрения у человека с диабетом, а также прогноз вероятности ответа к данному лечению.
Резюме
Достижения в области визуализации сетчатки и новые методы лечения меняют принципы лечения пациентов с диабетической ретинопатией. Благодаря имеющейся в настоящее время беспрецедентной способности неинвазивно наблюдать структуры сетчатки, диагностировать ретинопатию и выявлять пациентов с наибольшим риском потери зрения, теперь офтальмологическая помощь людям с диабетом может осуществляться быстрее, точнее и тем способом, который уместен как для врача, так и для пациента. С одновременным введением внутриглазной терапии ингибитором VEGF, которая может не только предотвратить потерю зрения, но и улучшить его, лечение диабетического макулярного отека и диабетической пролиферативной ретинопатии кардинально изменилось в лучшую сторону, поэтому развитие эффективного лечения должно продолжаться еще долгие годы.
