Боковой амиотрофический склероз

Боковой амиотрофический склероз (БАС) — идиопатическое нейродегенеративное заболевание двигательных отделов центральной нервной системы (ЦНС) человека с абсолютной летальностью. В этом обзоре авторы суммируют последние данные о происхождении заболевания, предрасположенности к нему и обсуждают вопрос о том, почему не все случаи БАС похожи друг на друга. Надо сказать, что спустя 150 лет после первого описания склероза Шарко (J-M. Charcot) прогресс в поиске ответов на данные вопросы едва ли сдвинулся с места. Авторы фокусируют внимание на том, что известно об этой болезни и в каком направлении движутся исследования, начиная с небольших шагов по увеличению продолжительности жизни, улучшению качества терапевтического ухода, прохождению клинических испытаний и компилированию эпидемиологических данных, а заканчивая комплексными мерами по предотвращению БАС и обнаружению триггеров этого заболевания.
Введение
С 90-х годов прошлого века интерес ученых и клиницистов к БАС постоянно возрастал. Прогресс в нашем понимании работы глутаматных систем, а также открытие генов, связанных с развитием наследственного БАС, значительно стимулировали исследовательский интерес: были получены данные, позволившие осознать клиническое разнообразие БАС. Переносимость болезни пациентами в данный момент зависит от нескольких факторов, включая клиническую форму, темп развития заболевания, раннее проявление респираторной недостаточности и режим питания. Увеличение продолжительности жизни пациентов с БАС, по-видимому, зависит от степени нашего понимания его патогенеза. Развитие представления о БАС позволит разработать ранние и специфические диагностические методы для выявления этого заболевания. Крайне важно сформировать терапевтическую стратегию, которая не только замедлит прогрессирование заболевания, но и позволит справиться с последствиями недостаточного питания и дыхательной недостаточности.
В настоящий момент не существует диагностического теста или биомаркера, который указывал бы на наличие БАС, и неврологи при постановке диагноза полагаются исключительно на клинические показатели. Разработка инновационных биомаркеров для объективной оценки тяжести заболевания обещает значительно усовершенствовать дизайн клинических исследований в этой области и удешевить их. К тому же, регистры населения в наши дни все чаще признаются обязательными дополнениями к клинической диагностике. Эти совместные усилия непременно приведут к лучшему пониманию патогенеза БАС, его зачастую непредсказуемых последствий и будут способствовать созданию руководств для улучшения качества ухода за такими пациентами. В этом обзоре авторы предоставляют актуальную характеристику ключевых разработок, связанных с БАС.
Эпидемиология и молекулярная генетика
Проводить эпидемиологические исследования БАС затруднительно по нескольким причинам, включая сложность определения точной даты начала заболевания и потенциально длительный промежуток между появлением патологических изменений на молекулярном уровне и клиническими проявлениями болезни. Наличие продромального периода между началом заболевания и появлением у пациента первых симптомов, возможно, указывает на существование в нервной системе избыточных популяций нейронов. Ряд сложно организованных эпидемиологических исследований, в которых были задействованы обширные группы пациентов, обеспечил ученых обилием данных о различных механизмах развития заболевания. В ходе популяционных исследований было установлено, что заболеваемость БАС в Европе составляет примерно 2,6 на 100 000 человеко-лет. Несмотря на то, что проблема БАС затрагивает население всего мира, точная цифра заболеваемости до сих пор неизвестна. Заболеваемость у мужчин составляет примерно 3,0 на 100 000 человек (доверительный интервал [ДИ] 95 % в диапазоне 2,8–3,3); у женщин — 2,4 на 100 000 человек (ДИ 95 % в диапазоне 2,2–2,6). Тем не менее, частота заболеваний в случае семейного БАС у представителей обоих полов примерно одинакова. Суммарный риск развития БАС в течение жизни составляет 1:400 для женщин и 1:350 для мужчин. В возрасте 58–63 года особенно вероятно развитие спорадического БАС, 47–52 года — пик манифестации наследственного БАС. Вероятность появления БАС после 80 лет резко снижается.
Несмотря на то, что проявления БАС в различных популяциях могут показаться одинаковыми, присутствуют едва заметные различия в его клинических аспектах в зависимости от части Европы, где он наблюдается. Благодаря популяционным исследованиям получены доказательства меньшей вероятности возникновения БАС у людей смешанного происхождения, чем у людей с испанскими корнями. В исследовании населения Кубы летальность оказалась на 60 % меньше, чем в случае популяций Европы или Северной Америки. Это подтверждает предыдущие наблюдения, в ходе которых была выявлена сниженная частота возникновения БАС среди населения Северной Америки с испанскими корнями.
Примерно 5–10 % случаев БАС наследуются по генетическим законам Менделя. На момент написания этой статьи (2011 год) были открыты 13 генов и локусов, значительно влияющих на вероятность возникновения данного заболевания (при этом многие их них были открыты лишь после 2009 года). Из числа уже известных генов мутации в SOD1 (кодирует Cu2+/Zn2+-связывающую супероксиддисмутазу), TARDBP (также известный как TDP43; кодирует TAR-ДНК-связывающий белок), FUS (кодирует слияние клеток в саркоме — Fusion in Sarcoma), ANG (кодирует рибонуклеазу ангиогенин, RNase A family 5) и OPTN (кодирует синтез оптинейрина) вызывают типичную клиническую форму БАС. Мутации SOD1 индуцируют усиление функции кодируемого фермента до достижения токсического эффекта, однако его точные патофизиологические механизмы все еще остаются неясными. TDP43 и FUS (также известен как TLS-транслируемый в липосаркоме [translated in liposarcoma]) — мультифункциональные протеины, вовлеченные в экспрессию и регуляцию генов, включая транскрипцию, сплайсинг РНК, транспорт и трансляцию. FUS и TDP43 также участвуют в процессинге небольших регуляторных РНК (микроРНК) и в созревании и сплайсинге обычной РНК. Экспрессия гена ANG повышается в ответ на гипоксию, а его продукт регулирует транскрипцию РНК. OPTN — ген, определяющий развитие первичной открытоугольной глаукомы. Мутации этого гена, которые вызывают БАС, препятствуют началу активации Nf kB (nuclear factor kappa-light-chain-enhancer of activated B-cells — фактор транскрипции, контролирующий экспрессию генов иммунного ответа, апоптоза и клеточного цикла) и изменяют распределение оптинейрина в цитоплазме. Мутации в гене SOD1 вызывают 20 % наследственных форм БАС и 5 % предположительно спорадических. Мутации в TARDBP вызывают 5–10 % наследственных форм БАС, мутации в FUS — 5 %, а мутации в ANG — примерно 1 %. Оставшиеся 90 % людей, у которых был диагностирован БАС, считаются обладателями спорадического заболевания. Исследования семейного анамнеза таких пациентов указывают на некоторую связь между БАС и другими нейродегенеративными заболеваниями. Это может быть связано с наличием «генов восприимчивости», которые могут увеличивать суммарный риск деградации нервных клеток у членов одной семьи. Однако попытки упорядочить сложный генетический базис спорадического БАС при помощи идентификации этих «генов восприимчивости» не имели большого успеха. Результаты исследований генов-кандидатов позволили идентифицировать некоторые «гены восприимчивости», но относительный вклад каждого потенциально опасного гена редко превышал отношение шансов 2 к 1, а механизм увеличения риска так и остался невыясненным. Несмотря на разочаровывающие результаты нескольких недавних попыток полногеномного анализа ассоциаций, в ходе этих исследований были идентифицированы некоторые гены, предположительно ответственные за развитие спорадического БАС. Главной проблемой данных исследований явилась их низкая мощность вследствие небольших размеров образцов, к тому же полученный результат не удалось реплицировать на второй популяции. Недавнее исследование, проведенное совместно двумя группами ученых, позволило открыть два восприимчивых гена; это демонстрирует, что данные гены и пути их репликации можно идентифицировать более эффективно, если исследовательские группы станут сотрудничать между собой. Скромные достижения полногеномного анализа ассоциаций привели к переосмыслению гипотезы «одна болезнь — один вариант» в пользу гипотезы «одна болезнь — множество разных редких вариантов».
Клиническая картина и прогноз
Знание различных разновидностей БАС важно для понимания возможных путей прогрессии заболевания. Идентификация специфических признаков БАС имеет важное значение не только для пациента с точки зрения прогнозирования его выживаемости, но и для проведения клинических испытаний. Основные варианты БАС включают:
- БАС с первичным поражением конечностей с признаками дегенерации верхних и нижних мотонейронов;
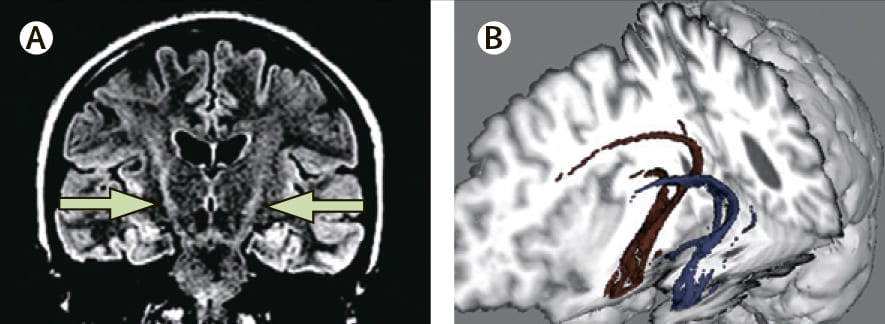
- первичный бульбарный БАС, представленный затруднениями речи и глотания, далее переходящий на конечности (рис. 1);
- менее распространенный первичный боковой склероз с наличием признаков поражения исключительно верхних мотонейронов;
- прогрессирующая мышечная атрофия с поражением исключительно нижних мотонейронов.
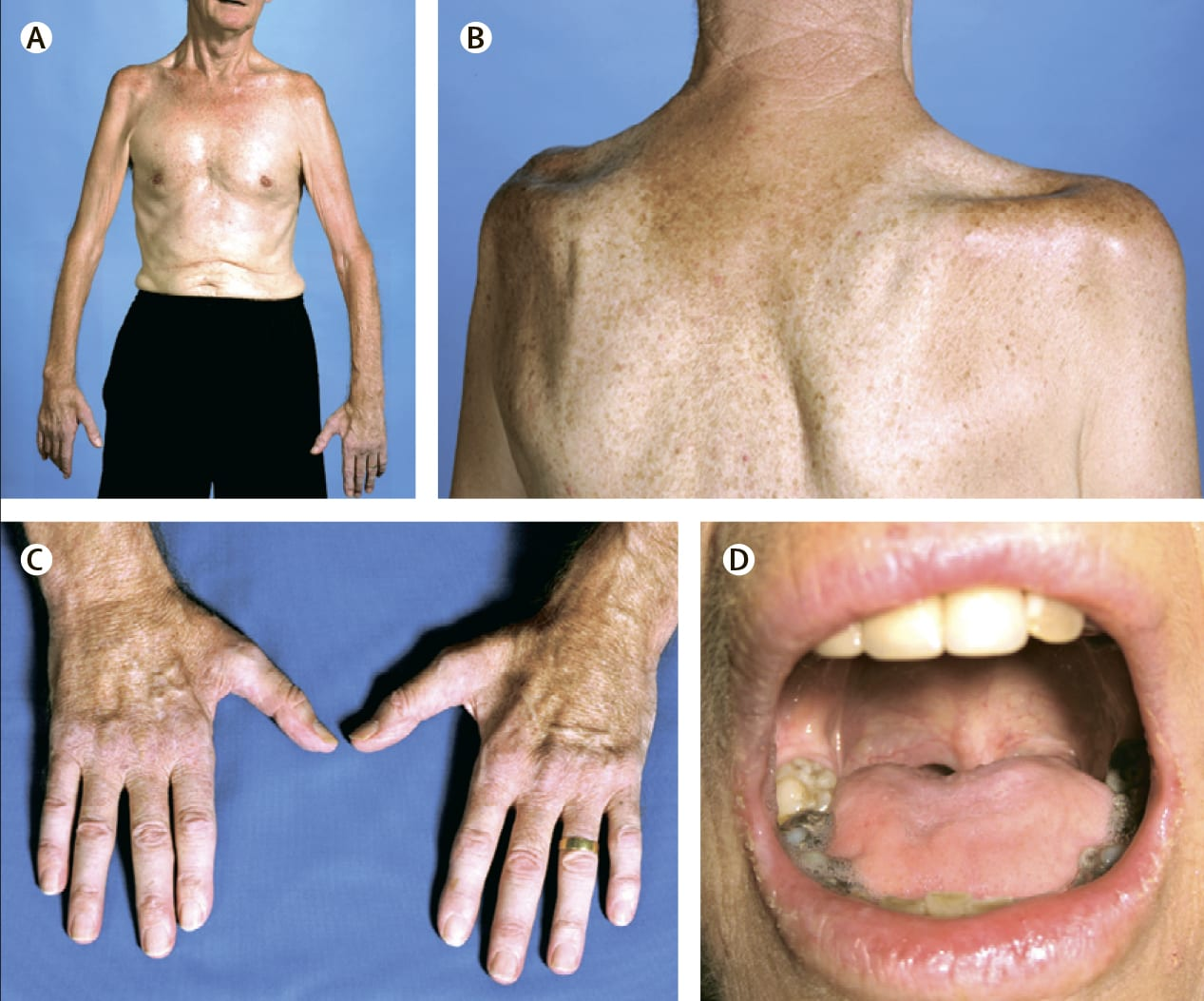
Клинически БАС проявляется в виде поражений верхних и нижних мотонейронов, которые наблюдаются в стволе мозга и во множестве участков спинного мозга. Примерно 25 % пациентов могут иметь первичную патологию продолговатого мозга, 70 % — первичную патологию, отражающуюся на конечностях, 5 % — патологию с вовлечением тела/дыхательной системы, которая впоследствии распространяется на другие области организма. Атипичные признаки могут включать потерю веса, которая является неблагоприятным прогностическим признаком, а также судороги, фасцикуляции (непроизвольные сокращения пучков мышечных волокон) без ослабления мышц, эмоциональную лабильность и фронтальную когнитивную дисфункцию долевого типа. Поражение верхних мотонейронов нарушает работу конечностей, что приводит к параличу, слабости, быстрым и резким сухожильным рефлексам. В свою очередь, признаки поражения нижних мотонейронов, связанных с конечностями, включают фасцикуляции, мышечную утомляемость и слабость. Бульбарная дисфункция верхних мотонейронов приводит к спастической дизартрии, которая характеризуется медленной, трудновыговариваемой, отрывистой речью и ринолалией. При открытии рта и смещении нижней челюсти могут возникать патологические отрывистые движения. Дисфункция нижних мотонейронов бульбарного отдела идентифицируется по утомляемости, слабости и фасцикуляции мышц языка, вялой дизартрии и последующей дисфагии. Вялая дизартрия приводит к ринолалии, вызванной слабостью мышц мягкого нёба, хрипотой и небольшим кашлем.
БАС прогрессирует безжалостно: 50 % пациентов умирают через 30 месяцев после появления первых симптомов, примерно 20 % выживают на протяжении 5–10 лет. С низкой выживаемостью связывают преклонный возраст на момент появления симптоматики, раннюю дисфункцию дыхательных мышц и манифестацию заболевания с поражения ствола мозга. Выживаемость повышают следующие независимые друг от друга факторы: болезнь, начавшаяся с нарушений в иннервации конечностей, начало заболевания в молодом возрасте и длительная задержка постановки диагноза.
Некоторые разновидности БАС предрасполагают к позитивному прогнозу. В частности, БАС «разболтанных рук» (flail-limb) (рис. 1А, 1Б) и прогрессирующая мышечная атрофия, преимущественно возникающие при поражениях нижних мотонейронов, прогрессируют медленнее, чем другие формы БАС. При изолированном бульбарном параличе, когда преобладают поражения верхних мотонейронов, а симптоматика ограничена мышцами рта и глотки, прогноз выживаемости колеблется от двух до четырех лет; эта форма чаще поражает женщин старше 65 лет. Кроме того, патология пациентов с первичным боковым склерозом прогрессирует медленнее, чем при классическом БАС. Дифференциальную диагностику первичного бокового склероза следует отложить хотя бы на четыре года с момента начала заболевания, так как возникновение поражения нижних мотонейронов может произойти даже в том случае, если первичные признаки заболевания напоминают спастический синдром.
Отличать разные клинические формы БАС важно для клинических исследований схем лечения, которые потенциально могут облегчить течение заболевания. Слабость и снижение толерантности к физической нагрузке — распространенные симптомы заболевания, которые вынуждают многих пациентов просить помощи в повседневных делах. У большинства больных БАС развивается дисфагия, что приводит к последующим недоеданию и потере веса, которые ассоциируются с плохим прогнозом. В большинстве случаев склероза развивается дыхательная недостаточность, приводя при физической нагрузке к диспноэ, ортопноэ, гиповентиляции и в результате к гиперкапнии, а также к головным болям по утрам. Смерть становится неизбежной, как только у пациента возникает диспноэ в состоянии покоя. Кроме того, прогрессирующая слабость дыхательных мышц приводит к респираторной недостаточности, часто осложняемой пневмонией.
Взаимосвязь с фронтотемпоральной деменцией
Практически у всех пациентов с БАС и более чем у 50 % пациентов с фронтотемпоральной деменцией (ФТД) недавно идентифицировали убиквитинированные TDP43-положительные цитоплазматические включения, что вновь подогревает интерес к сходству этих прогрессирующих нейродегенеративных синдромов. Несмотря на то, что явные когнитивные симптомы и «чистая» деменция упоминались в более ранних исследованиях, они не считались характерными признаками БАС. В то же время изредка у пациентов с ФТД развивается БАС. Известно о случаях наличия в семьях обоих расстройств одновременно. Гены, которые вызывают проявление БАС и ФТД в одной семье, пока еще неизвестны, но исследования выявили наличие общего для обеих болезней локуса девятой хромосомы. Проблемы с мышлением вначале могут быть неявными, и иногда их не замечают, но при грамотной когнитивной и нейрофизиологической оценке от 20 до 50 % пациентов с БАС соответствуют критериям предположительной или подтвержденной ФТД. Среди наиболее часто встречающихся проблем: гиперфункция речи или обострение личностных качеств с когнитивным профилем, который больше всего напоминает поведенческую ФТД. В рамках клинических наблюдений проблемы с вынесениями суждений, импульсивностью и общее ухудшение способности выполнять рутинные каждодневные задачи могут вылиться в серьезные проблемы с ведением таких пациентов. Нарушение словесной коммуникации, которое ярче выражено у пациентов с псевдобульбарной формой склероза, не позволяет им сообщить о своих самых простых нуждах. Когнитивная и особенно исполнительная дисфункции могут также влиять на согласие пациента на лечение, на его способность принимать самостоятельные решения, а также потенциально осложнить этические и юридические вопросы терапии.
Схожесть этих заболеваний подтверждается воксельной МРТ-морфометрией, с помощью которой выявляются сходные структурные аномалии в ЦНС пациентов с БАС и ФТД-БАС. Может развиваться билатеральная атрофия моторной и премоторной коры, однако пациенты с ФТД-БАС обычно обладают более выраженной фронтотемпоральной атрофией, чем пациенты, имеющие только БАС. Фронтотемпоральный гиперметаболизм был выявлен у пациентов с БАС и ФТД-БАС при помощи 2-18-флуоро-2-дезокси-D-глюкозной ПЭТ. Данная фронтотемпоральная атрофия, по-видимому, связана с потерей нейронов и кортикальным глиозом, обнаруживаемыми на аутопсии. Так же, как и для большинства пациентов со спорадическим склерозом, у 50 % пациентов с ФТД присутствуют TDP43-положительные внутринейронные включения. Недавно у пациентов с убиквитин-положительной, TDP43-отрицательной ФТД и пациентов с семейным БАС, вызванным мутациями в FUS, были обнаружены FUS-положительные включения. Это вновь акцентирует внимание на взаимосвязи БАС и ФТД.
Патофизиологические механизмы
Патофизиологические механизмы, лежащие в основе развития БАС, видимо, запускаются множеством разнообразных факторов (рис. 2). Появляется все больше и больше доказательств роли комплексного взаимодействия генетических и молекулярных механизмов в развитии этого заболевания. БАС может проявляться как порок развития опорно-двигательного аппарата в зрелом возрасте. В частности, согласно контрольным исследованиям шведских ученых, с повышенным риском развития БАС были сопряжены слишком раннее или позднее материнство, а также наличие у пациентов младших родных братьев и сестер. К тому же, развитие двигательной системы человека может потенциально быть нарушено в детстве при повышенной предрасположенности к инфекциям; как правило, это случается в семьях с маленькими детьми. Также были предложены различные факторы среды, влияющие на развитие склероза, включая интенсивную физическую нагрузку в течение жизни и активную военную службу. В ретроспективном исследовании футболистов профессиональных итальянских лиг стандартизированная смертность оказалась увеличена из-за развития БАС, особенно в виде рано дебютировавших форм. По неизвестным причинам футболисты, которые играли более пяти лет, в особенности на позиции атакующего полузащитника, имели наибольший риск развития БАС. Несколько случаев склероза также было зафиксировано среди футболистов, выступающих в Англии.
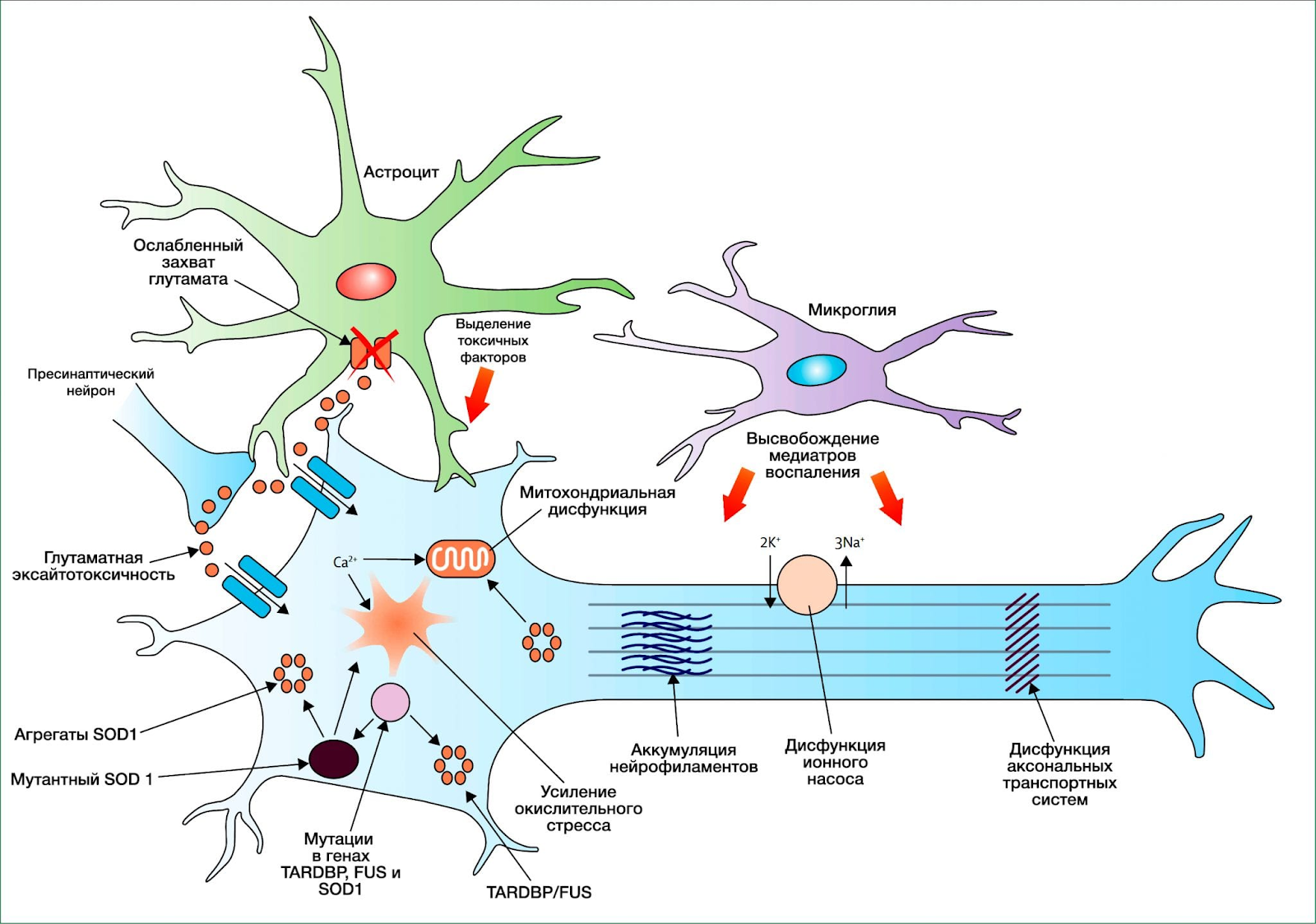
Курение в определенных дозах может оказывать эффект на последующее развитие БАС. Влияние нейротоксинов, включая β-метил-амино-L-аланин, на организм человека связывают с возникновением эпидемии заболевания БАС-Паркинсона на острове Гуам. Эта нейротоксичная аминокислота концентрировалась в мозге пациентов с болезнью БАС-Паркинсона и включалась в рацион Чаморро (коренные жители о. Гуам) из-за употребления аборигенами в пищу летучих мышей. Эти мыши, блюда из которых являются деликатесами для Чаморро, питаются семенами орхидей (Cymbidium), содержащими высокие концентрации β-метил-амино-L-аланина.
Не было установлено четкой связи между мутациями в SOD1 и ранней гибелью мотонейронов. Текущее представление объясняет возникновение генетических мутаций чрезмерной токсичной функцией фермента SOD1 и синтезом свободных радикалов, что в конечном счете приводит к повреждению и гибели клетки. К тому же, мутации SOD1 индуцируют конформационную нестабильность и неправильное сворачивание белка SOD1, способствуя формированию внутриклеточных включений, что ингибирует нормальную активность протеасомы, нарушая тем самым системы аксонального транспорта и другие жизненно важные функции клетки.
В схему патогенеза БАС также вовлечена эксайтотоксичность глутамата. Глутамат — основной возбуждающий нейромедиатор в ЦНС. Глутамат связывается с ионотропными N-метил-D-аспартатными (NMDA) рецепторами и рецепторами α-амино-3-гидрокси-5-метил-4-изоксазоолепропионовой кислоты (AMPA) на постсинаптической мембране. Чрезмерная активация данных рецепторов глутаматом может спровоцировать нейродегенерацию вследствие активации кальций-зависимых ферментативных путей. Индуцированный глутаматом токсический эффект может также привести к синтезу свободных радикалов, что может вызвать нейродегенерацию посредством разрушения внутриклеточных органелл и влияния на синтез провоспалительных медиаторов. Механизм, при помощи которого токсический эффект глутамата вызывает деградацию мотонейронов у людей, остается неясным (сноска 1, рис. 3). Был предложен так называемый механизм «смерти наперед». Согласно ему, верхние мотонейроны вызывают антероградную деградацию нижних мотонейронов при оказании глутаматом своего токсического эффекта.
Сноска 1 | Дилемма БАС: где именно начинается заболевание?
Несмотря на начальное наблюдение Шарко одновременных патологических изменений верхних и нижних мотонейронов при БАС, вопрос точной локализации начала заболевания остается открытым. Нахождение ответа на него могло бы прояснить патофизиологию БАС; это имеет большое диагностическое и терапевтическое значение. Гипотеза «смерти наперед» предполагает, что БАС — синдром, затрагивающий в основном кортикальные мотонейроны, которые напрямую соединяются с клетками передних рогов спинного мозга, вызывая их антероградную дегенерацию посредством эксайтотоксичного действия глутамата. Ниже представлены некоторые факты, подтверждающие гипотезу «смерти наперед».
Результаты исследований путем транскраниальной магнитной стимуляции, которые показывают, что кортикальное гипервозбуждение является ранним признаком наличия у пациентов спорадического БАС и предшествует первичным клиническим симптомам наследственной формы заболевания.
Клинические наблюдения: (1) мотонейроны без прямой связи с кортикальными нейронами, принадлежащие ядрам глазодвигательного (III) и отводящего (IV) нервов и ядру Онуфа, обычно сохраняются при БАС; (2) отсутствие случаев БАС среди животных в природных условиях объясняется недостаточным количеством у последних связей между кортикальными мотонейронами и клетками передних рогов; (3) чистые формы БАС нижних мотонейронов редки, в то время как бессимптомные поражения верхних мотонейронов без исключения обнаруживаются с помощью транскраниальной магнитной стимуляции.
Гипотеза «обратной смерти» предполагает, что БАС начинает свое развитие с мышечных клеток или нервно-мышечных синапсов. В частности, при этом наблюдается дефицит двигательного нейротрофического гормона. В норме этот гормон выделяется постсинаптическими клетками и ретроградно транспортируется по аксону пресинаптической клетки к ее телу, где оказывает определенный эффект. В число доказательств гипотезы «обратной смерти» входят следующие наблюдения:
• началу деградации мотонейронов предшествует денервация;
• денервация опосредуется аккумуляцией мутировавшего белка SOD1 в шванновских клетках.
В противовес гипотезам «смерти наперед» и «обратной смерти» существуют предположения некоторых исследователей о том, что процессы деградации верхних и нижних мотонейронов происходят независимо друг от друга.
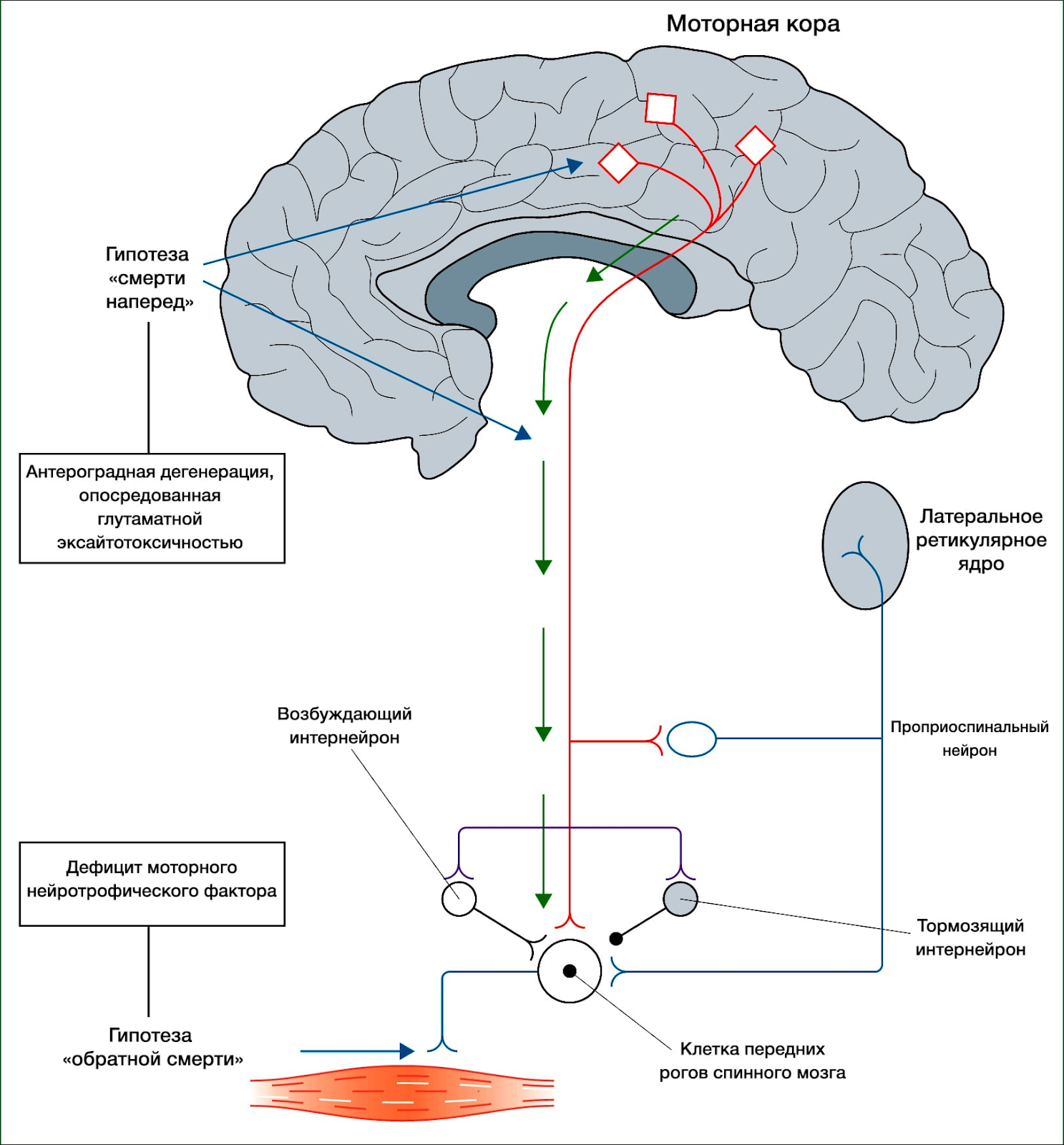
Рисунок 3 | Гипотезы «смерти наперед» и «обратной смерти»
Кроме вышеуказанной токсичности, в развитие патогенеза БАС вовлечены структурные аномалии митохондрий, дисфункция калий-натриевой помпы, аутофагоцитоз и нарушения аксонального транспорта. Не только нейроны, но и такие клетки, как астроциты и микроглиоциты, также могут вызывать нейродегенерацию путем недостаточной секреции нейротрофических факторов, секреции нейротоксичных медиаторов и модуляции экспрессии рецепторов глутамата (все это известно как нейродегенерация по вне-нейронным причинам). Следующим по важности в патофизиологии склероза является TDP43, который был определен как основной компонент убиквитинированных цитоплазматических белковых агрегатов у всех пациентов со спорадическим БАС, но расположенный вне ядра (в нормальных нейронах он находится именно там). Несмотря на то, что вопрос того, являются ли данные агрегаты причиной нейродегенерация при БАС, остается открытым, мутации в TARDBP были обнаружены всего лишь в 3 % случаях наследственной формы склероза и у 1,5 % пациентов со спорадическим БАС, позволяя предположить, что агрегаты TDP43 играют ключевую роль в инициации БАС. Доказательство патогенности мутации TARDBP было представлено, когда мутации, идентифицированные в крайне защищенных участках ДНК, не вызвали БАС в контрольных группах. Учитывая, что TDP43 связывается и с ДНК, и с РНК, мутации в TARDBP могли бы привести к нарушению регуляции процессинга РНК. Данную теорию поддерживает обнаружение мутаций гена FUS на 16-й хромосоме, которые связаны с наследственными формами БАС. Агрегаты FUS не были явно определены у пациентов с патологическими изменениями в TDP43 или SOD1, что указывает на наличие нового пути возникновения болезни. Несмотря на то, что обнаружение мутации в генах TARDBP и FUS, которая вызывала склероз, было наибольшим шагом в понимании его патогенеза, другие факторы также требуют внимания. Приводят ли мутации в данных ДНК/РНК-связывающих белках к гиперфункции, ведущей к токсическому эффекту и дисфункции? Чем именно вызывается нейротоксичность? Дефектом в свертывании белков, который нарушает систему внутриклеточной передачи сигналов? Или она опосредована уничтожением жизненно важных белков и генетического материала агрегатами TDP43 и FUS? Какова связь между недавно обнаруженными патофизиологическими механизмами и белками TDP43 и FUS? Ученым только предстоит найти ответы на эти вопросы.
Диагностика
В отсутствие диагностического теста на БАС клиницисты в большинстве случаев полагаются на идентификацию признаков дегенерации верхних и нижних мотонейронов в одной области организма с последующим наблюдением динамики распространения заболевания. Критерии El Escorial, опубликованные в 1997 году, используют совокупность признаков поражения верхних и нижних мотонейронов для проведения точной диагностики на надлежащем уровне. Исследователи в клинических испытаниях систематизировали пациентов с возможным или точно диагностированным БАС согласно критериям El Escorial, отмечая их универсальность; несмотря на это, использование данных диагностических признаков в качестве критериев для классификации пациентов может в некоторых случаях оказаться не самым лучшим вариантом. Дело в том, что данные критерии могут быть недостаточно показательными, особенно на ранних стадиях развития БАС, когда наиболее сильны эффекты терапевтических воздействий на пациентов. Благодаря критике, критерии модифицировали для упрощения ранней диагностики и более точной постановки диагноза, что важно в клинической практике.
Часто постановке четкого диагноза предшествует длительный период времени, отчасти из-за того, что первые симптомы обнаруживаются в среднем лишь через 14 месяцев после дебюта. Необычные клинические симптомы, не вызывающие у врача должных подозрений, неправильная интерпретация результатов нейрофизиологических и нейрорадиологических исследований — вот некоторые распространенные причины неясностей в процессе диагностики. К сожалению, задержка постановки диагноза может привести к применению ошибочных терапевтических стратегий, позднему назначению подходящей терапии, а также проблемам при взаимодействии с пациентом с точки зрения его психологического фона. Процесс диагностики БАС тяжело переносится пациентом и членами его семьи, следовательно, его необходимо строго контролировать. При бесчувственном оглашении диагноза пациенту и его родственникам эмоциональная нагрузка на них может оказаться чрезмерной; нерешительность врача при постановке диагноза в атипичных случаях может существенно осложнить процесс принятия пациентом своего заболевания и прогноза. Четкое следование расписанию визитов к врачу после постановки диагноза помогает получить ответы на вопросы, которые не были обсуждены во время первичной консультации, а также снабдит пациента ценной информацией о службах поддержки, которые хорошо организованы в большинстве развитых стран.
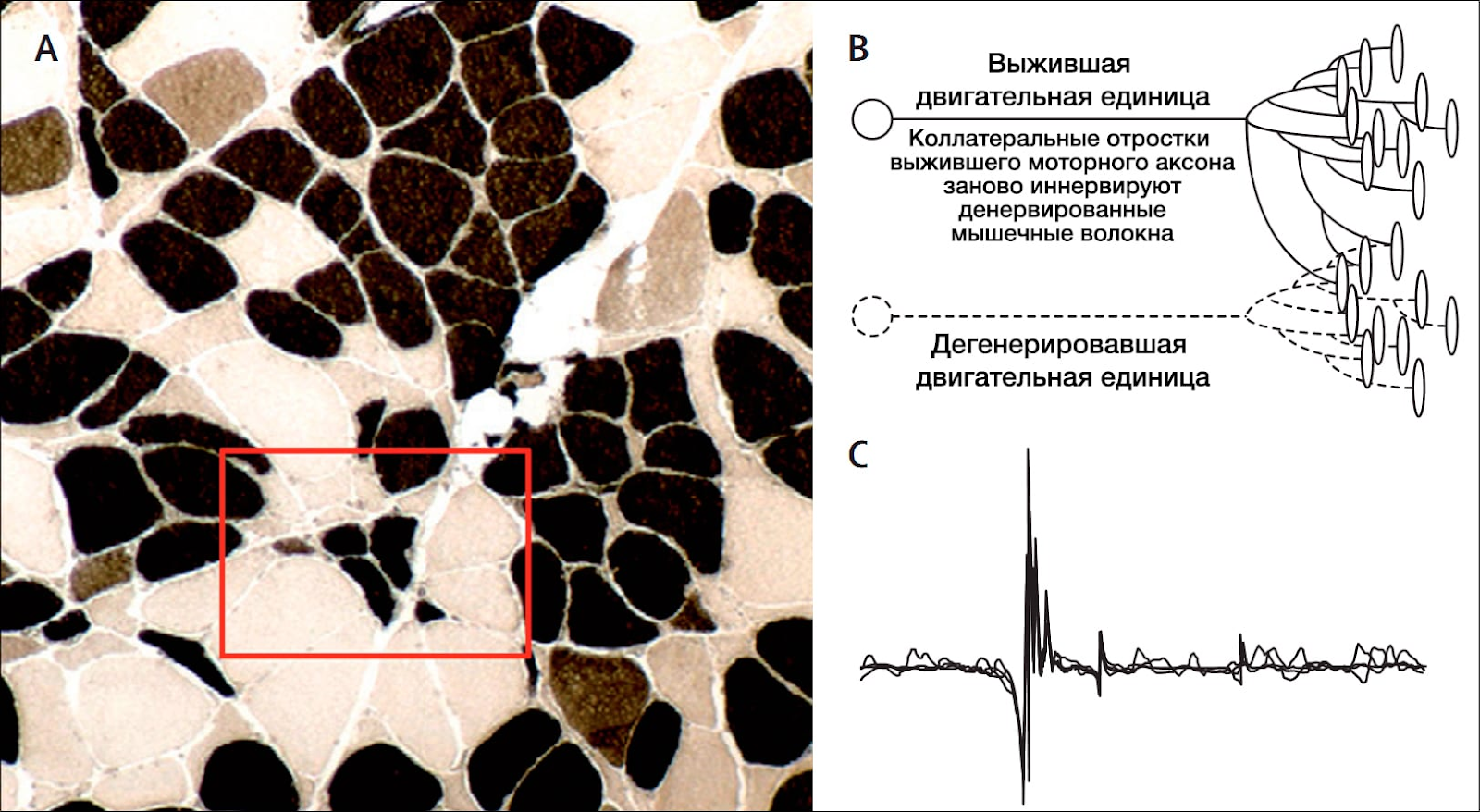
При дифференциальной диагностике следует помнить о том, что существует несколько расстройств, напоминающих БАС; для нахождения различий между ними обычно используют структурную визуализацию, нейрофизиологические и лабораторные исследования (сноска 2). В случаях наличия синдромов поражения исключительно нижних мотонейронов крайне важно провести генетическое тестирование на болезнь Кеннеди, сцепленную с Х-хромосомой бульбарную атрофию и спинальную мышечную атрофию. Образцы мышечной биопсии могут иметь диагностическую ценность для исключения нестандартных миопатий, таких как прогрессирующая миоклонус-эпилепсия (болезнь Лафора), или для подтверждения наличия БАС путем обнаружения атрофии волокон различных типов (рис. 4А).
Сноска 2 | Дифференциальная диагностика БАС и исследования, необходимые для его подтверждения
Расстройства мотонейронов:
• спинальная мышечная атрофия (анализ делеции гена SMN);
• сцепленная с Х-хромосомой спинобульбарная мышечная атрофия (болезнь Кеннеди; повышенное количество триплетов ЦАГ в ДНК из крови);
• полиомиелит или постполиомиелитный синдром (история болезни, электронейромиография [ЭНМГ]);
• дефицит гексозаминидазы А (тестирование ферментов лейкоцитов).
Расстройства двигательных нервов:
• мультифокальная двигательная нейропатия (ЭНМГ, антитела к ганглиозиду GM1);
• хроническая воспалительная демиелинизирующая нейропатия (ЭНМГ, люмбальная пункция);
• синдром спастической фасцикуляции (ЭНМГ);
• нейромиотония (антитела к потенциал-зависимым калиевым каналам);
• наследственная предрасположенность к спастическому парапарезу (тест на генетические мутации);
• наследственная двигательная нейропатия с пирамидальными характеристиками;
• радикулоплексопатия (ЭНМГ, МРТ);
• паранеопластический синдром (сывороточные маркеры, визуализация, образец биопсии костного мозга);
• отравление тяжелыми металлами (анализ мочи или крови);
• множественные мононевриты (ЭНМГ, скрининг сосудов, серологический анализ).
Расстройства нервно-мышечных соединений:
• миастения (антитела к рецепторам ацетилхолина, антитела к мышечно-специфицированной тирозинкиназе, повторная стимуляция нервных окончаний при ЭНМГ, электромиография одиночных волокон);
• миастенический синдром Ламберта-Итона (повторная стимуляция нервных окончаний при ЭНМГ).
Структурные поражения ЦНС и спинного мозга:
• сирингомиелия или сирингобульбия (МРТ);
• спинная сухотка (серологический анализ на сифилис);
• рассеянный склероз (МРТ, олигоклональные цепочки иммуноглобулинов, тесты на рассеянный склероз);
• мономелическая спинальная мышечная атрофия (болезнь Хираяма; электромиография, МРТ);
• болезнь Лайма (серологическое исследование на болезнь Лайма);
• человеческий Т-лимфотропный вирус I типа (анализ на ВИЧ).
Миопатия:
• миозит с включениями (электромиография, креатинфосфокиназа [КФК], образец биопсии мышцы);
• полиомиелит (электромиография, КФК, образец биопсии мышцы, аутоиммунный скрининг);
• дерматомиозит (электромиография, КФК, образцы биопсий кожи и мышц);
• прогрессирующая миоклонус-эпилепсия (Болезнь Лафора) (исследования проводимости нервов, электромиография, образец биопсии мышцы или нерва).
Эндокринная система:
• тиреотоксикоз (тест на функционирование щитовидной железы, электромиография, образец биопсии мышцы);
• гиперпаратиреоидизм (концентрация ионов кальция и исследование околощитовидных желез);
• подострая комбинированная дегенерация спинного мозга (болезнь Лихтгейма) (измерение концентрации витамина В12);
• целиакия (серологическая диагностика, образец биопсии кишечника).
Рутинные нейрофизиологические исследования пациентов с БАС включают в себя изучение синапсов, электромиографию и транскраниальную магнитную стимуляцию (реже). Исследование нервных соединений необходимо для исключения расстройств, которые напоминают БАС, в особенности демиелинизирующих двигательных нейропатий. На ранних стадиях развития склероза проводимость двигательных нервов не нарушена, но по мере прогрессирования болезни общая амплитуда потенциала действия в мышце снижается, демонстрируя денервацию. Проводимость чувствительных нервов у пациентов со склерозом обычно не нарушена, что отличает БАС от демиелинизирующих нейропатий. Заметные аномалии, обнаруженные в ходе изучения проводимости чувствительных нервов, должны вызывать подозрения клиницистов на предмет наличия альтернативных диагнозов. У пациентов с преимущественным поражением нижних мотонейронов возможно наличие излечимых расстройств, таких как мультифокальная двигательная нейропатия. Эту возможность нужно учитывать при наличии блокады проводимости хотя бы двух двигательных нервов вне типичных мест проявления БАС.
Электромиография в дополнение к исследованиям проводимости нервов также полезна для идентификации дисфункции нижних мотонейронов (рис. 4Б). Помимо дисфункции нижних мотонейронов, она также демонстрирует фибриллярные потенциалы, положительные остроконечные волны и хронические нейрогенетические изменения (рис. 4С). Данные электромиографические аномалии недавно были включены в обновленные критерии диагностики БАС El Escorial, дополняя признаки поражения нижних мотонейронов. Фибриллярные потенциалы и остроконечные волны могут наблюдаться в мышцах, которые внешне выглядят нормально. Следовательно, электромиография может помочь в ранней диагностике склероза, указывая на наличие субклинического вовлечения деградации нижних мотонейронов. Сохранившиеся двигательные единицы могут спонтанно деполяризовываться в виде потенциалов фасцикуляции, которые клинически проявляются в виде непроизвольных мышечных подергиваний — типичного признака БАС. В частности, высокоспецифичными для этого заболевания являются подергивания мышц языка.
Наличие фасцикуляций в отсутствие других электромиографических феноменов следует интерпретировать с осторожностью, ведь это может указывать на менее серьезные расстройства, особенно на «доброкачественный» синдром спастической фасцикуляции. С другой стороны, недавно исправленные и приведенные к консенсусу руководства (известные как критерии острова Аваджи) приравнивают фасцикуляции к фибриллярным потенциалам у пациентов с подозрением на БАС. К тому же, фасцикуляции в случае БАС являются комплексными («злокачественными»): они указывают на реиннервацию и наличие хронических нейрогенных изменений (рис. 4С).
В настоящее время активно обсуждается то, насколько успешно врачи диагностируют БАС, используя клинические критерии и данные лабораторных исследований. На этом акцентируется внимание из-за статистики по БАС в Шотландии, где доля ложноположительных результатов составила 8 %. Другая информация из популяционных исследований указывает на схожие ложноположительные цифры; количество же ложноотрицательных результатов достигло 44 %. Основными причинами пересмотра ложноположительных результатов были отсутствие прогрессирования симптоматики по данным исследований, возникновение атипичных признаков, а также противоречивые результаты сопутствующих нейрофизиологических и нейрорадиологических исследований. Наиболее часто по ошибке диагностируют как БАС такие заболевания, как мультифокальная двигательная нейропатия и болезнь Кеннеди.
Прогресс в нейровизуализации
Наибольший вклад нейровизуализации в диагностику БАС на данный момент внесла способность МРТ исключать альтернативные причины его возникновения. Однако данная сфера активно развивается, и результаты мультимодальной нейровизуализации подтвердили тот факт, что склероз является мультисистемным церебральным нейродегенеративным расстройством. Ключевые открытия в области изыскания биомаркеров заболевания, сделанные при помощи нейровизуализации, описываются в сноске 3.
Сноска 3 | Ключевые открытия в нейровизуализации БАС
Гиперинтенсивность кортикоспинального пути на МРТ. Гиперинтенсивность кортикоспинальных трактов, видимая на МРТ, может быть заметна при БАС, однако она не является специфичным признаком данной болезни (рис. 5А).
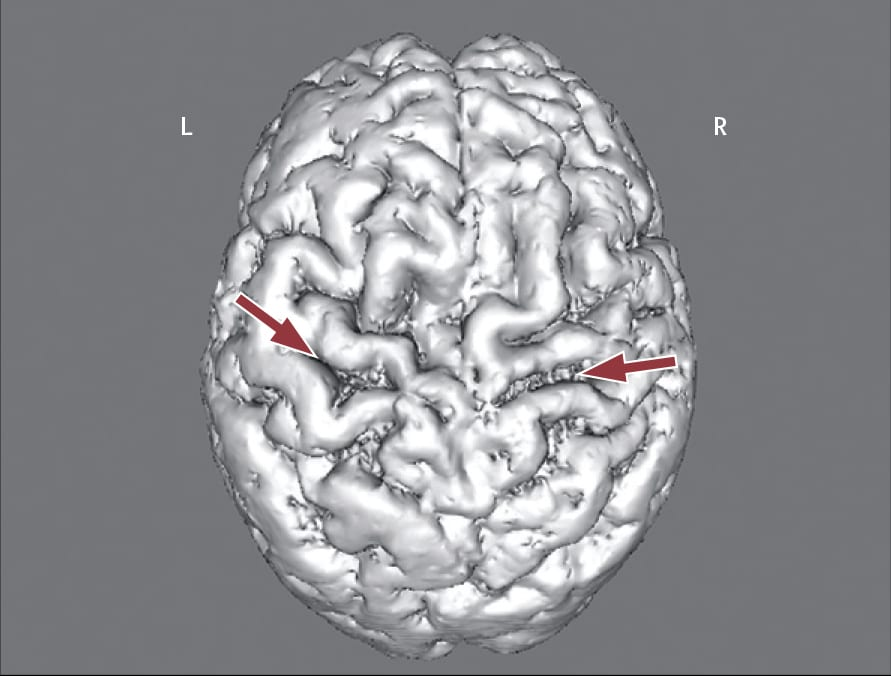
Церебральная атрофия, выявленная при помощи МРТ. Воксель-зависимая морфометрия (техника «картирования» мозга, определяющая разницу в объеме его структур) позволяет измерить количество серого и белого вещества с целью обнаружения церебральной атрофии, сопряженной с когнитивным расстройством у пациентов с БАС. При этом зоны максимальной атрофии различаются у пациентов с врожденным и спорадическим БАС. Пациенты с врожденным заболеванием обладают большей продолжительностью жизни. 3D-технологии изучения мозга при помощи МРТ также могут помочь в обнаружении фокальных аномалий (рис. 6).
Магнитно-резонансная спектроскопия. Измерение количества содержащих протоны метаболитов, таких как N-ацетиласпартат (количество рассчитывается относительно отношения к (фосфо)креатину или холину), стало маркером нейронедостаточности. У пациентов с БАС отношение N-ацетиласпартата к креатину по сравнению с контрольной группой было снижено в зонах первичной моторной коры. Магнитно-резонансная спектроскопия оказалась очень чувствительной именно при обнаружении дисфункции нижних мотонейронов, что позволило отличать пациентов с прогрессирующей мышечной атрофией от пациентов с БАС.
Диффузионная тензорная визуализация (диффузионная МРТ). Диффузионную МРТ можно использовать для идентификации степени диффузии воды, показатели которой считаются константными (анизотропными) внутри нетронутых болезнью проводящих путей и более диффузными (изотропными) в путях со сниженной интегративностью. Количественные единицы измерения, такие как частичная анизотропность и основной коэффициент диффузии, являются мощными суррогатными маркерами патологических изменений в нервной ткани. Внутренняя связь между нервными путями может быть картирована при помощи техники связующей трактографии (рис. 5Б). Использование диффузионной тензорной визуализации также может продемонстрировать сниженную частичную анизотропность кортикоспинальных путей у пациентов с БАС.
Функциональные исследования. Результаты позитронной эмиссионной томографии (ПЭТ) 2-18-флюоро-2-дезокси-D-глюкозой и H2O указали на широко распространенные экстрамоторные изменения у пациентов, страдающих склерозом с фронтальной недостаточностью. Последняя была сопряжена с нейропсихологическими повреждениями, демонстрируя проявляющийся в клинике перекрест БАС и ФТД. Неинвазивные исследования активации мозга с помощью функциональной МРТ используют разницу резонаторных свойств оксигемоглобина и дезоксигемоглобина (функциональная МРТ, зависимая от оксигенации крови). При помощи анализа BOLD (функционального МРТ) всего мозга в покое можно идентифицировать функционально связанные участки мозга. Результаты исследований пациентов с БАС показали и «стандартный режим» работы мозга, и изменения в ней при активации сенсомоторной сети. Эта техника имеет потенциал в дальнейшем более схематично представлять экстрамоторные церебральные патологические изменения у пациентов.
Молекулярная визуализация. Лиганд-рецепторная ПЭТ может быть использована для исследований молекулярных механизмов болезни. Результаты C-флумазениловой ПЭТ продемонстрировали сниженные ингибирующие ГАМКергические кортикальные эффекты у людей с БАС, учитывая гипотезу кортикальной гипервозбудимости как фундаментальный аспект его патогенеза. Использование рецепторного к бензодиазепину лиганда C-PK11195 при ПЭТ выявило обширную активацию микроглии при БАС, вместе с которой были обнаружены биомаркеры воспаления в спинномозговой жидкости. Установленное в лобнотеменных зонах снижение способности лиганда C-WAY100635 связывать рецептор 5-HT1A у пациентов с БАС и результаты исследований нейропатологических рецепторов, которые показывают схожие изменения при ФТД, позволяют предположить, что наличие серотонинергических механизмов оправдывает дальнейшие исследования патогенеза склероза. В конечном счете, парамагнетические свойства небольших частиц оксида железа, которые могут быть использованы как интравенозные контрастные агенты, могут указывать на начало эпохи молекулярной МРТ, что потенциально позволит не только понять механизмы воспаления, но и использовать стволовые клетки в терапевтических целях.
Определение пресимптоматических маркеров заболевания. Нечеткое представление группы риска в случае спорадического БАС препятствует нахождению раннего (пресимптоматического) биомаркера. Результаты исследований с помощью диффузной спектральной томографии пациентов пресимптоматической группы с ярко выраженной мутацией в гене SOD1 демонстрируют изменения в задней ножке внутренней капсулы, не отмеченные в контрольных группах здоровых людей. Возможно, это одно из первых изменений, которое можно обнаружить у пациентов. Респираторная функция и питание пациентов с БАС являются важными проблемами, ведь респираторная недостаточность является основной причиной смерти. Были разработаны экспертные рекомендации для решения ключевых вопросов, ассоциированных с БАС, среди них проблемы с дыхательной системой, питанием и уходом за пациентами. При следовании рекомендациям необходимо делать акцент на наиболее благоприятных потенциальных вариантах развития болезни.
Ведение и предотвращение заболевания
Средством специфической нейропротективной терапии пациентов с БАС является рилузол — ингибитор высвобождения глутамата (сноска 4). В двух крупных независимых друг от друга исследованиях этот препарат увеличил продолжительность жизни пациентов на 3–6 месяцев. Его преимущества лучше проявлялись при назначении в специализированных многопрофильных клиниках для больных БАС, чем в других учреждениях. Рилузол приносил наибольшую пользу пациентам с умеренными функциональными повреждениями нервной системы.
Симптоматическая терапия остается краеугольным камнем в ведении пациентов с БАС (сноска 5). Для некоторых пациентов эти методы не только смягчают симптоматику, но и повышают продолжительность и качество жизни. Оптимальный уход за пациентами с БАС предоставляется в условиях многопрофильной среды, где физиотерапевты, реабилитологи, логопеды, пульмонологи, гастроэнтерологи и социальные работники сотрудничают между собой и обеспечивают пациентам симптоматическое лечение. Подобные многопрофильные подходы снизили риск смерти в течение 5 лет болезни на 45 %, что делает их потенциальным средством повышения выживаемости. По сравнению с пациентами, которые содержались в клинике общей неврологии, находящиеся в специализированной клинике жили более качественной жизнью, что, возможно, связано с более эффективным использованием ресурсов, которое начинает приносить пациентам пользу уже после первого визита к врачу.
Сноска 4 | Полемика вокруг БАС — клинические исследования
Несмотря на то, что клинические исследования БАС проводятся с 1980-х годов, рилузол неизменно остается единственным лекарством с доказанной эффективностью против данного расстройства. Неудовлетворительные результаты клинических исследований БАС, которые так и не привели к каким-либо конкретным результатам, были объяснены наличием проблем в структуре исследований на доклиническом и клиническом уровнях.
Проблемы на доклиническом уровне
Неудовлетворительные результаты имитации заболевания на мышах. До недавнего времени SOD1-модель на мышах являлась стандартом тестирования нейропротекторов, используемых при БАС. Однако, так как мутации SOD1 составляют примерно 2 % случаев склероза, имитация на мышах не может быть сопоставима со спорадической болезнью человека. К тому же, в процессе имитации происходят стереотипные изменения, которые начинаются со слабости задних конечностей у мышей. Модель на последних с мутацией гена, кодирующего TDP43, — потенциальное продвижение в развитии терапии БАС. Оно предоставляет ученым обновленную и, возможно, более релевантную платформу для изучения новейших программ терапии.
Неправильно выбранное время назначения лекарств и проблемы с дозировкой. Некоторые исследователи изучили влияние пресимптоматического применения лекарств в начале развития заболевания. Несмотря на то, что это может внести свой вклад в наше понимание субклинических процессов, которые предшествуют дегенерации мотонейронов, по-видимому, оно имеет небольшое отношение к собственно лечению спорадического БАС. Многие доклинические исследования также проверили действие ультравысоких доз лекарств, которые, возможно, достигнут такой концентрации в плазме, что не будут переноситься пациентами. Некоторые исследователи рекомендуют не назначать пациентам максимально переносимую дозу в погоне за наилучшим эффектом.
Проблемы на клиническом уровне
Суть исследования. Существует растущая потребность в более эффективном скрининге фармакологических средств на протяжении второй фазы испытаний, так как после данного периода принимается решение: продолжить подтвержденное тестирование (т. е. начать третью фазу испытаний) либо отказаться от лекарства как от неэффективного. В связи с этим трудно провести грань между второй и третьей фазой исследования БАС, ведь предоставление предварительного доказательства эффективности лекарства во второй фазе затруднительно. Главной причиной этого является отсутствие эффективного биомаркера. Следовательно, следует либо использовать эффективные статистические стратегии для минимизирования продолжительности исследования и размера выборок, либо увеличить шанс успеха на третьей фазе испытаний (что приведет к повышению количества ложноположительных результатов), либо проводить третью фазу испытаний, используя методику второй фазы (что приведет к повышению количества ложноотрицательных результатов). Последний подход, возможно, один из тех, что сейчас используются редко в силу недавнего прогресса в дизайне статистических исследований. Ученые также продолжают работать с третьей фазой клинических испытаний, даже в отсутствие предварительных доказательств их эффективности препаратов у человека.
Выбор первичной конечной точки. Изменения первичной конечной точки производятся в зависимости от успешности испытания. Выбор правильной первичной конечной точки при клинических испытаниях БАС является дискутабельным вопросом. Преобладают испытания, которые используют функциональные линейки и силовые показатели как первичные конечные точки. Испытания, целью которых было изыскание средств, увеличивающих выживаемость, до недавнего времени были редкими. Смысл и преимущества последних включают меньший размер выборок, меньшую продолжительность испытаний и клинически значимый эффект от лечения. Тем не менее, измерение числа выживших может проводиться только при доказанной эффективности лечения, ведь с начала первичных симптомов потери мотонейронов слишком велики. Примером средства, увеличивающего выживаемость, является рилузол. Он оказывает небольшие, но значимые эффекты, которые можно обнаружить уже при работе с пробами, размер которых меньшего необходимого для повышения выживаемости.
Респираторная недостаточность указывает на одновременную деградацию нейронов центральных дыхательных центров и мотонейронов, отдающих аксоны в диафрагмальный нерв. В клинической картине пациентов с БАС часто присутствуют респираторные нарушения. Ночная гипоксия и ассоциированные с ней симптомы летаргии, потеря концентрации, головные боли по утрам и неудовлетворительный сон — последствия дисфункции ЦНС. Слабость диафрагмы и постепенное снижение жизненной емкости легких (ЖЕЛ) можно диагностировать методом спирометрии. Показатели силы мышц, совершающих вдох, такие как максимальное давление на вдохе и давление при вдыхании носом, являются более точными маркерами дыхательной дисфункции, чем ЖЕЛ; в случае пациентов со стабильной слабостью лицевой мускулатуры (т. е. тех, кто не может держать рот в широко открытом состоянии) они могут быть более информативными.
Сноска 5 | Симптоматический уход при БАС
Слабость и утомляемость:
• биопротезирование (протезы стопы, шейные воротники);
• физиотерапия;
• адаптивные элементы поддержки (ходунки, инвалидное кресло).
Дисфагия:
• наблюдение у речевого терапевта и диетолога;
• техники безопасного глотания и модифицированная диета;
• введение гастростомической трубки.
Диспноэ и слабый кашель:
• вентиляционная поддержка;
• морфин или бензодиазепины;
• физиотерапия области груди;
• отсасывание мокроты;
• помощь при откашливании.
Боль (мышечная и костная; судороги, фасцикуляции и паралич, боль при надавливании на кожу, вызванная ее неподвижностью):
• физиотерапия, нестероидные противовоспалительные препараты (НПВП);
• миорелаксанты (баклофен, ботулинический токсин);
• противосудорожные препараты (например, габапентин);
• помощь при изменении положения тела и уход за областями, которые подвергаются повышенному давлению, во избежание образования пролежней;
• опиоидные препараты;
• снижающие давление тела подушки и матрасы.
Дизартрия:
• наблюдение логопеда;
• вспомогательные средства общения;
• предоставление членам семьи и специалистам по уходу за пациентом всей необходимой информации.
Когнитивные изменения (дисфункция лобной доли или деменция):
• объяснение симптоматики специалистам по уходу за пациентами и членам их семей;
• терапия антидепрессантами.
Гиперсаливация:
• антихолинергические антидепрессанты (амитриптилин);
• антихолинергические препараты (гликопиррония бромид);
• инъекции ботулотоксина;
• облучение слюнных желез;
• продукты для ухода за полостью рта;
• отсасывание слюны.
Уплотнение слюны:
• натуральные лекарства (на основе папайи);
• достаточное потребление воды;
• соляные небулайзеры; небулизированный N-ацетилцистеин;
• отсасывание слюны из ротовой полости;
• уход за ротовой полостью.
Эмоциональная лабильность:
• предоставление необходимой информации членам семьи и специалистам по уходу за пациентом;
• амитриптилин;
• бензодиазепины;
• декстрометорфана гидробромид/хинидин сульфат.
Депрессия и беспокойство:
• консультация специалиста;
• бензодиазепины;
• антидепрессанты.
Расстройства сна:
• решение исходной проблемы;
• осмотр дыхательной системы, неинвазивная вентиляция;
• бензодиазепины, трициклические антидепрессанты.
Запоры:
• модификация диеты (повышение потребления воды и грубой волокнистой пищи);
• использование в приготовлении пищи отрубей и волокнистых ингредиентов;
• регулярный прием оральных слабительных (мовикол или суппозитории).
Несмотря на то, что проведение полисомнографии может быть оптимальным подходом для идентификации приступов ночной гипоксии, для пациентов с БАС, как правило, лучше подходит ночная пульсоксиметрия. Неинвазивная вентиляция улучшает качество жизни пациентов и повышает выживаемость. К данному методу рекомендуется прибегать при наличии следующих признаков: симптомы слабости дыхательной мускулатуры (диспноэ и ортопноэ), низкая концентрация кислорода в крови согласно ночной оксиметрии, повышенное парциальное давление углекислого газа (PCO2) менее 65 мм Hg и сниженная ЖЕЛ (менее 80 %), давление вдыхания носом менее 40 см H2O. Пациенты с травмой продолговатого мозга и гиперсаливацией могут не перенести неинвазивную вентиляцию, поэтому в их случае важен соответствующий уход за дыхательными путями и выведение избыточного секрета. У пациентов с БАС, которые не переносят этот тип вентиляции, или в случае, когда его недостаточно в силу развивающейся слабости респираторных мышц, одним из вариантов является инвазивная вентиляция трахеостомией. Несмотря на то, что этот метод продлевает жизнь, данный подход редко используется в большинстве стран из-за последующих практических проблем, большой стоимости и сильной потере качества жизни. Важно заметить, что в рамках симптоматической терапии значительное облегчение пациентам, страдающим диспноэ в покое, предоставляет подкожное введение морфина.
Недоедание — ключевой фактор в определении прогноза заболевания. Развитие недоедания при БАС имеет множество причин, включая сниженное количество употребляемой пищи вследствие дисфагии и гиперметаболизма. Примерно 50–60 % пациентов с БАС пребывают в состоянии гиперметаболизма, которое персистирует на протяжении заболевания и зависит от возраста, пола и массы тела без учета жировой ткани. Повышение в показателях метаболизма, измеренное подсчетом высвобожденной в покое энергии, ассоциировано со сниженной выживаемостью. Несмотря на то, что механизмы, провоцирующие гиперметаболическое состояние, остаются неясными, известно, что дисфункция митохондрий миоцитов вносит вклад в этот аспект патогенеза БАС. Перкутанное введение гастростомической трубки обеспечивает достаточное потребление калорий и жидкости и должно производиться пациентам со значительной потерей веса, в том числе и в отсутствие дисфагии. Целесообразность проведения гастростомии следует обсудить на ранних этапах заболевания, поскольку смертность повышается, когда жизненная емкость не превышает 50 % от нормы. Внимание ко многим симптомам, которые могут развиться на протяжении заболевания, важно для повышения качества жизни пациентов с БАС (сноска 5). Терминальная стадия заболевания может сопровождаться беспокойством, тревогой, болью и диспноэ, поэтому пациентам необходимо предоставить хорошо организованный мультидисциплинарный уход. В конечном счете пациенты могут также искать альтернативные стратегии лечения (сноска 6), часто стоящие больших денег и не обладающие доказанной эффективностью в борьбе с болезнью.
Сноска 6 | Дебаты вокруг БАС — альтернативные и недокументированные способы лечения
Тот факт, что пациенты все чаще хотят экспериментировать с научно не доказанными методами терапии, неудивителен, учитывая то, что диагноз БАС является терминальным. Популярные альтернативные и недокументированные стратегии лечения включают: инсулиноподобный фактор роста 1 (ILGF1), карбонат лития, миноциклин и терапию стволовыми клетками. Пациентам следует соблюдать осторожность, обращаясь к таким вариантам лечения. Согласно некоторым клиническим исследованиям, многие из них могут ускорить процессы ослабления мышц и негативно сказаться на выживаемости. Недавно был создан интернет-ресурс ALSUntangled для информирования сообщества пациентов с БАС об альтернативных и недокументированных способах лечения заболевания. ALSUntangled позволяет пациентам и клиницистам обмениваться информацией о подобных способах лечения склероза. Пациенты с БАС поддерживают обмен новыми гипотетическими альтернативами и методами лечения, так как цель данного проекта — именно суммировать и распространить информацию о цене, научных и этических основах этих методов, а также о потенциальных преимуществах и рисках каждого нового варианта лечения.
Заключение
«Давайте же несмотря ни на что продолжим поиски! Это, вне сомнений, лучший способ открыть новое, и, возможно, именно благодаря этим нашим попыткам вердикт, который мы вынесем пациенту завтра, уже не будет таким, каким мы его выносим сегодня» — Жан-Мари Шарко, 1889
В отличие от незначительного прогресса в течение прошлого века, недавние продвижения в понимании генетики, клинических проявлений и патофизиологии БАС поддерживают реалистичную надежду, что в будущем появятся абсолютно новые подходы к его лечению.
