Открытие вируса гепатита С: научные основы

Нобелевская премия по физиологии и медицине 2020 года присуждена Харви Дж. Альтеру, Майклу Хоутону и Чарльзу М. Райсу за открытие вируса гепатита С (HCV). Термин «гепатит», название которого образовано от греческих слов «печень» и «воспаление», обозначает заболевание, характеризующееся потерей аппетита, рвотой, повышенной утомляемостью и желтухой (желтым окрашиванием кожи и склер). Хронический гепатит приводит к повреждению печени, которое может трансформироваться в цирроз и гепатоцеллюлярный рак. Вирусная инфекция является основной причиной гепатита, при этом некоторые его формы протекают бессимптомно в течение многих лет, прежде чем возникнут опасные для жизни осложнения. До 1960-х годов контакт с кровью инфицированных людей представлял серьезную опасность для здоровья, при этом вероятность развития хронического гепатита после операции или многократных переливаний крови достигала 30 %. Этот риск был лишь частично снижен благодаря открытию вируса гепатита B (HBV) и последующей минимизации возможности переливания зараженной крови путем ее тестирования на HBV. Оставалась наиболее коварная форма гепатита, характеризующаяся практически незаметными симптомами в острой фазе и высоким риском развития хронического повреждения печени и гепатоцеллюлярного рака. В своей работе Альтер, Хоутон и Райс охарактеризовали эту форму гепатита как отдельную нозологическую единицу, вызываемую РНК-вирусом семейства Flaviviridae, ныне известным как HCV. Новаторская работа этих ученых проложила путь к разработке методов скрининга, которые резко снизили риск парентерального заражения HCV, а также привела к разработке эффективных противовирусных препаратов, которые улучшили качество жизни миллионов людей.
Гепатит — серьезная угроза здоровью человека
Первое описание гепатита, датируемое примерно 400 годом до н.э., приписывается греческому врачу Гиппократу, общепризнанному родоначальнику западной медицины. Он описал уникальное течение болезни, которую назвал «эпидемической желтухой», и написал: «Желчь, содержащаяся в печени, полна флегмы, крови и стремится к извержению. После этого извержения такой больной вскоре начинает бредить, раздражается, говорит ерунду и лает подобно псу» [1].
Сегодня мы понимаем, что гепатит может быть вызван различными причинами, влияющими на функцию и морфологию печени. На основании этиологических факторов заболевание можно классифицировать на инфекционный, метаболический, ишемический, аутоиммунный, наследственный и токсический гепатит, причем последний зачастую связан со злоупотреблением алкоголем. Инфекционный гепатит может быть вызван пятью различными типами РНК- или ДНК-вирусов, которые являются наиболее частой причиной возникновения гепатита во всем мире.
В 1947 году, задолго до открытия возбудителей болезни, британский гепатолог классифицировал инфекционный гепатит на два подтипа: гепатит А и гепатит В, основываясь на различиях в их клинических проявлениях и путях передачи [2]. Как известно в настоящее время, инфекционный (или эпидемический) гепатит вызывается РНК-вирусами семейств Picornaviridae (вирус гепатита A, HAV) или Hepeviridae (вирус гепатита E, HEV). Инфекционный агент в основном передается через зараженную пищу и воду; болезнь имеет короткий инкубационный период и проявляется острой симптоматикой, которая обычно разрешается и приводит к формированию пожизненного иммунитета.
Сывороточный гепатит может быть вызван ДНК-вирусом семейства Hepadnaviridae (HBV), с ассоциированным РНК-вирусом семейства Deltaviridae (вирус гепатита D, HDV) или без него, или РНК-вирусом семейства Flaviviridae (HCV) (рис. 1). Эта форма гепатита распространяется с кровью или другими биологическими жидкостями и имеет длительный инкубационный период, в течение которого клинически практически здоровый человек является источником инфекции. У значительной части заболевших инфекция становится хронической, что может привести к печеночной недостаточности и развитию гепатоцеллюлярного рака. Различные типы вирусных гепатитов вносят существенный вклад в глобальное бремя болезней печени. Согласно последнему отчету ВОЗ о гепатите в мире, инфекция HAV вызвала 114 млн случаев острого гепатита в 2015 году, при этом 257 млн человек жили с хронической инфекцией HBV и 72 млн — с хронической инфекцией HCV в год, когда был составлен отчет. В связи со способностью вызывать хронические инфекции HBV и HCV являются основными причинами заболеваемости и смертности: в 2015 году было зарегистрировано 1,34 млн летальных случаев, что на 63 % больше, чем в 1990 году, в основном вследствие инфицирования HCV. Количество смертей сопоставимо с туберкулезом (1,5 млн случаев в 2018 году) и даже выше, чем в случае СПИДа (690 000 смертей в 2019 году) [3].
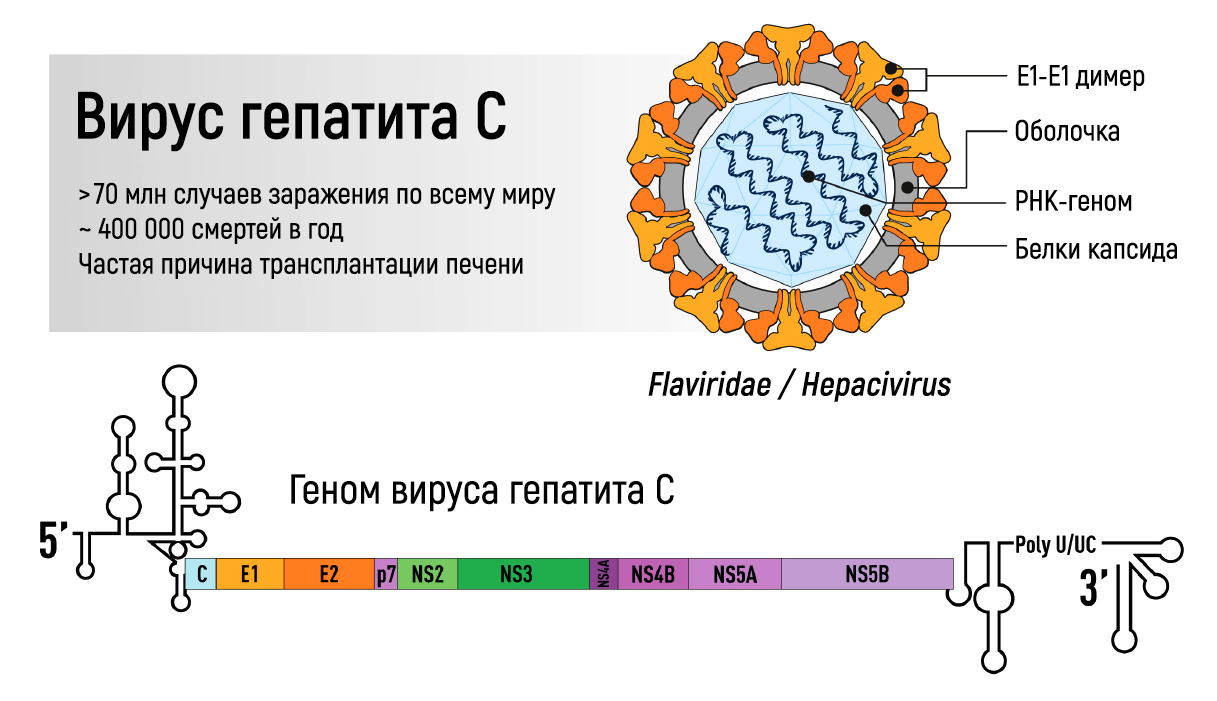
Рисунок 1 | Геном вируса гепатита С.
Открытие вирусов, вызывающих гепатит, — это одно из самых значимых научных открытий 20-го века. Их идентификация представляет собой важнейшее достижение, которое произвело революцию в медицине и существенно улучшило здоровье людей. Благодаря развитию новых технологий, стали широко доступны вакцины против HAV и HBV. Открытие HBV и HCV, а также внедрение эффективных процедур скрининга практически устранили риск трансмиссивной передачи во многих частях света. Благодаря разработке высокоэффективных препаратов против HCV сейчас впервые в истории человечества стало возможным представить будущее, в котором угроза этой вирусной инфекции будет значительно снижена и, надеемся, вообще устранена.
Открытие вируса гепатита В
Изучая восприимчивость людей к заболеваниям в различных популяциях, Барух Блумберг, генетик, работавший в Национальном институте здоровья (NIH) в Бетесде, заметил необычную реакцию между сывороткой больного гемофилией, перенесшего многократные гемотрансфузии, и сывороткой австралийского аборигена; ученый было подумал, что открыл новый липопротеин [4]. Вскоре после этого Блумберг смог доказать, что в сыворотке пациента после многократных переливаний крови обнаружен новый антиген, который был назван «австралийским антигеном» (Au) [5]. В 1967 году интуиция лаборанта, разработавшего антитела к Au-антигену после эпизода желтухи, побудила Блумберга предположить, что Au-антиген может быть связан с вирусным гепатитом. Впоследствии он выяснил, что Au-антиген, обнаруженный в сыворотке крови людей, перенесших так называемый «посттрансфузионный гепатит», является фрагментом вирусной частицы [6]. Это позволило разработать иммунологические тесты для скрининга на данный вирус и создать первую вакцину против HBV. Клонирование вируса Пьером Тиолле, работавшим в институте Пастера в Париже [7], проложило путь к использованию методов генной инженерии для производства первой высокоэффективной рекомбинантной вакцины на основе белка. До открытия HBV сывороточный гепатит представлял серьезную угрозу для здоровья с риском передачи выше 30 % для пациентов, перенесших операцию или получивших инфицированную кровь [8]. Разработка серологических тестов, позволяющих выявить практически здоровых носителей HBV и минимизировать возможность переливания инфицированной крови, привела к значительному снижению частоты возникновения сывороточного гепатита. За открытие HBV и разработку первой вакцины против него Барух Блумберг был удостоен Нобелевской премии по физиологии и медицине 1976 года. Однако, несмотря на это, у значительного числа людей после переливания крови все же развивался хронический гепатит, что представляло собой серьезную проблему.
Обнаружение «гепатита ни А, ни В»
Будучи молодым врачом, Харви Дж. Альтер работал с Барухом Блумбергом и внес важный вклад в открытие Au-антигена. Затем Альтер работал в центре переливания крови Национального института здоровья, где продолжал исследовать посттрансфузионный гепатит на протяжении всей своей карьеры. В начале 1970-х годов несколько исследовательских групп, вдохновленные открытием HBV, приступили к изучению взаимосвязи между HBV-инфекцией у доноров крови и развитием посттрансфузионного гепатита [9–13]. Вскоре было продемонстрировано, что исключение доноров крови с антителами к HBV предотвращает только 20 % посттрансфузионных гепатитов. Таким образом, оставшиеся 80 % случаев оказались не связаны с инфекцией HBV. Эта новая форма гепатита «не-B» становилась все более распространенной и отличалась вариабельностью клинических проявлений. В то время как HBV-ассоциированный гепатит имел длительный инкубационный период и часто проявлялся тяжелыми острыми симптомами, сывороточный гепатит «не-B» имел более короткий инкубационный период и более легкие симптомы во время острой фазы [9, 10]. Среди пациентов, обследованных Альтером, у одного человека сначала развилась легкая форма заболевания, а затем возник хронический HBV-ассоциированный гепатит [9]. Ученый пришел к выводу, что по крайней мере два разных вируса могут быть причиной развития посттрансфузионного гепатита.
Первоначальное предположение о том, что возбудитель гепатита А может при определенных условиях вызывать и сывороточный гепатит, было отвергнуто вскоре после открытия HAV. В 1973 году двое ученых Национального института здоровья, Стивен Фейнстоун и Роберт Х. Парселл, которые только что разработали метод иммуно-электронной микроскопии, обнаружили новый пикорнавирус в фекалиях мартышек и пациентов, перенесших острые формы гепатита А [14]. Вирус можно было выращивать в культуре клеток, что позволило быстро разработать иммунологические тесты для обнаружения HAV-специфичных антител у инфицированных пациентов и вскоре после этого создать вакцину. Теперь Альтер воспользовался своей обширной коллекцией образцов сыворотки от пациентов с гепатитом, не связанным с B, и в сотрудничестве с Фейнстоуном, Парселлом и другими сообщил в 1975 году, что значительная часть случаев гепатита, не связанного с B, не была вызвана HAV или каким-либо другим известным науке вирусом [15, 16]. Дальнейшие эпидемиологические данные свидетельствуют о том, что предполагаемый агент, ответственный за необъяснимые случаи гепатита, напоминал HBV с точки зрения путей передачи, но чаще приводил к развитию хронической инфекции [17]. В обиход ученых вошло определение «гепатит ни А, ни В» (NANBH) [15], и предполагалось, что это рабочее название будет недолговечным и не уйдет в широкие массы. Стало ясно, что агент, вызывающий NANBH, был ответственен за растущее количество случаев посттрансфузионного гепатита, и ситуация была пугающей, потому что у большинства инфицированных носителей не было клинической симптоматики.
В последующие годы исследователям так и не удалось добиться значительного прогресса в идентификации возбудителя, ответственного за возникновение NANBH. В условиях отсутствия методов исследования крови и инструментария на предмет выявления возбудителя болезнь продолжала оставаться серьезной опасностью для нуждающихся в гемотрансфузии пациентов, медицинских работников и лиц, употребляющих инъекционные наркотики. Альтер и его коллеги частично преуспели в преодолении этих трудностей в конце 1970-х годов за счет создания модели инфекции на приматах. Результаты экспериментов показали, что сыворотка от пациентов с острым или хроническим NANBH может передавать болезнь шимпанзе [18–20] — единственному восприимчивому к данной инфекции виду, помимо человека (рис. 2). Наличие модели заболевания на животных предоставило возможности для выявления морфологических изменений, связанных с инфицированием гепатоцитов, и дало шанс охарактеризовать инфекционный агент с помощью классических методов вирусологии. Тестируя пулы плазмы, содержащей вирус, и подвергая аликвоты различным обработкам, Альтер вместе с Парселлом установили, что предполагаемый вирус NANBH содержит незаменимые липиды [21] (свойство, присущее всем оболочечным вирусам) и в диаметре составляет примерно от 30 до 60 нм [22]. Новаторские исследования Альтера определили отчетливую клиническую форму посттрансфузионного гепатита, передаваемого неизвестным вирусом.
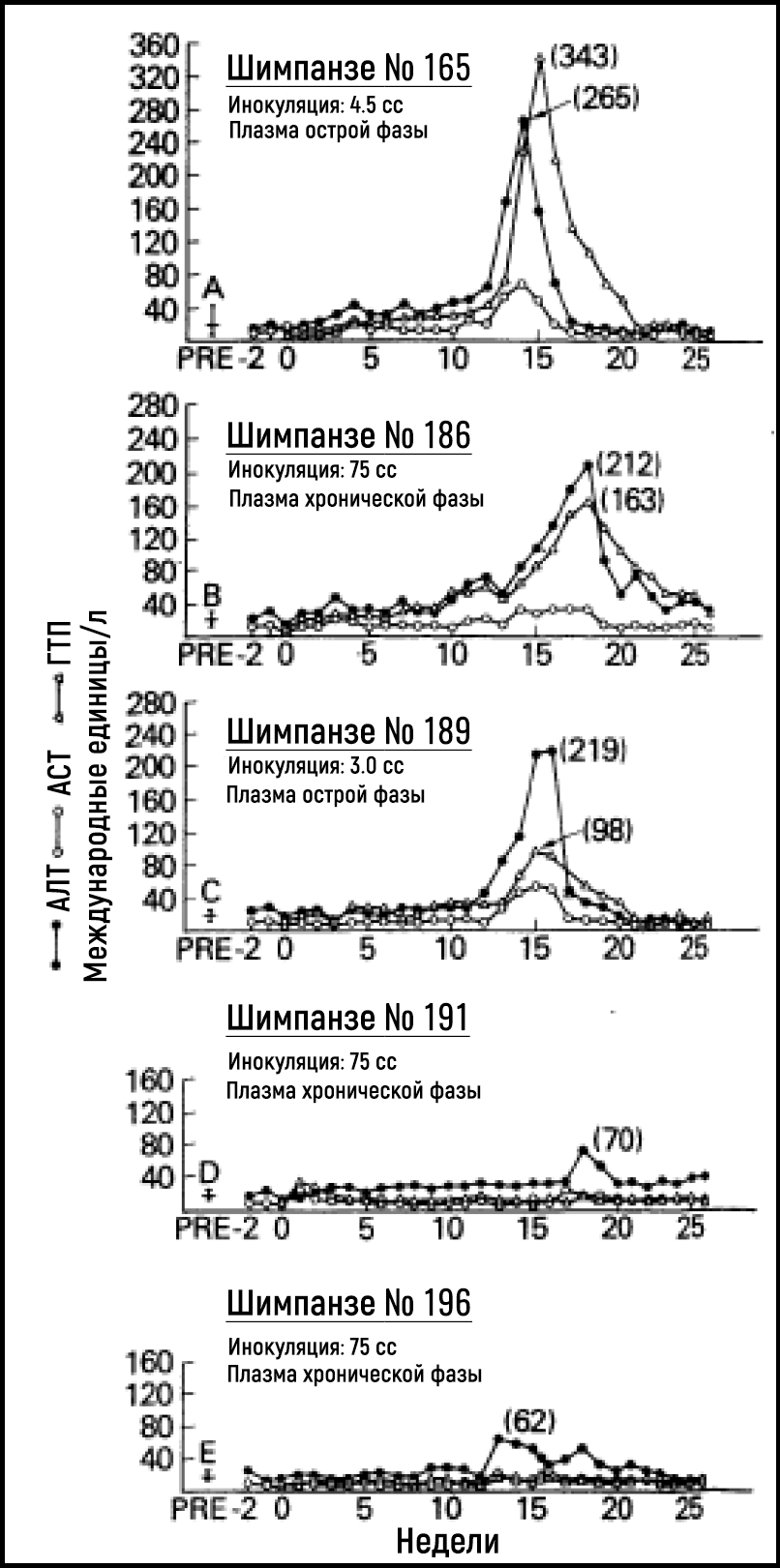
Источник: Alter et al. Lancet 1978.
Новый вирус
Несмотря на значительный прогресс, характеристика вируса(ов), ответственного за NANBH, оставалась удручающе неясной. Ряд неудавшихся исследований с использованием всех традиционных методов, позволивших в свое время обнаружить и охарактеризовать HAV и HBV, будет продолжаться еще более 10 лет. Майкл Хоутон, работавший в Chiron Corporation, начал свою охоту за вирусом NANBH в 1982 году, используя молекулярный метод, основанный на скрининге фрагментов ДНК, также называемых библиотекой комплементарной ДНК (кДНК), выделенных от инфицированных шимпанзе. Первоначальный скрининг идентифицировал только генетический материал хозяина. Попытки отобрать последовательности, характерные именно для вируса, за счет устранения последовательностей хозяина, которые также были обнаружены в неинфицированной контрольной печени, также оказались безуспешными. Хоутон, тогда работавший с Куай-Лим Чу и Джорджем Куо, решил испробовать новый подход к иммунному скринингу. Библиотеку кДНК получали из РНК, выделенной из плазмы шимпанзе, инфицированных NANBH, и переносили ее в бактерии с использованием высокоэффективной системы λ-бактериофагов. Затем была исследована экспрессия вирусных антигенов с использованием сыворотки пациента с молниеносным течением NANBH, которая, как предполагалось, содержала антитела против неизвестного вируса. Скрининг миллиона бактериальных колоний с использованием этого метода привел к идентификации одной колонии, которая не содержала последовательностей ДНК шимпанзе или человека. Это был именно тот вирусный сигнал, который и искали ученые [23]. Последовательность, названная клоном 5-1-1, гибридизуется с РНК, состоящей примерно из 10 000 нуклеотидов. РНК кодировала большую открытую рамку считывания (ОРС) и демонстрировала отдаленную гомологию с геномами известных РНК-вирусов. Белки могли транслироваться с самой молекулы РНК, что указывало на позитивную полярность РНК генома вируса. Это позволило классифицировать агент, который был назван HCV, как нового члена семейства Flaviviridae. Дальнейшие эксперименты показали, что новая вирусная последовательность кодирует белок, который реагирует с сывороткой шимпанзе, инфицированного NANBH, но не с сывороткой от контрольных животных, инфицированных HAV и HBV (рис. 3).
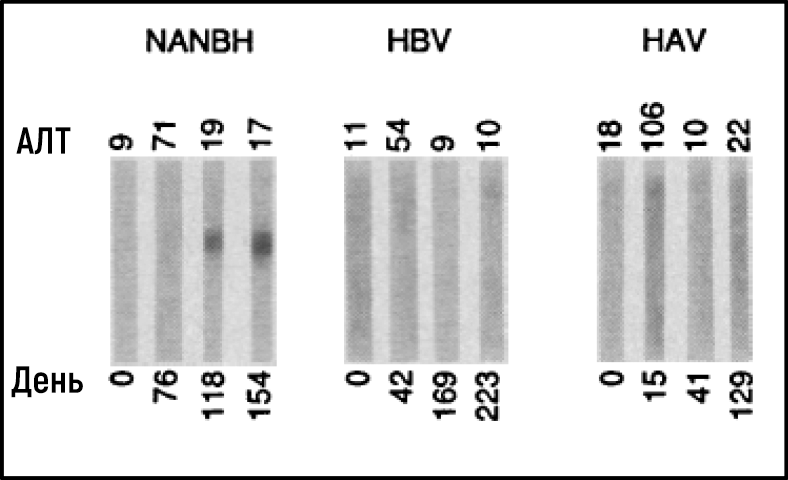
Источник: Choo et al. Science 1989.
После идентификации вируса команда Хоутона оперативно разработала метод иммуноанализа для обнаружения специфических антител к HCV и продемонстрировала наличие таких антител у донора крови, который передал болезнь десяти разным реципиентам, а также у пациентов с NANBH из Италии, Японии и США [24]. Эти результаты продемонстрировали прочную взаимосвязь между инфицированием недавно обнаруженным HCV и возникновением NANBH во всем мире.
Окончательное доказательство
Работа Алтера и Хоутона установила важнейшую связь между NANBH и инфицированием HCV, однако это не являлось окончательным доказательством причинно-следственной связи, потому что нельзя было исключить участие сопутствующих факторов при передаче вируса путем трансфузии инфицированной крови. Чтобы окончательно продемонстрировать причинно-следственную связь, требовалось выделение вируса, способного воспроизводить клинические признаки заболевания, включая хроническое повреждение печени, а также сохранение контагиозного вируса в крови инфицированного макроорганизма. Первый шаг к достижению этой цели был сделан, когда группы Кунитада Симотохно из Национального исследовательского института онкологического центра в Токио и Чарльза Райса из Вашингтонского университета в Сент-Луисе успешно определили консервативный некодирующий фрагмент РНК HCV, который, как они предположили, может играть важную роль в репликации вируса [25–28]. Райс сконструировал геномы вирусной РНК, содержащие консервативный некодирующий 3’-фрагмент, ввел их в печень шимпанзе и стал дожидаться доказательств репликации HCV, но не смог обнаружить вновь продуцируемый вирус в крови. Затем ученый сделал еще один решительный шаг. Зная, что репликация РНК-вируса часто сопряжена с ошибками и что многие вирусные последовательности несут инактивирующие мутации, он сконструировал набор геномов РНК, которые включали как консервативный некодирующий фрагмент, так и консенсусную последовательность, чтобы исключить потенциальные инактивирующие мутации. Ученый ввел модифицированную РНК в печень шимпанзе, и на этот раз эксперимент оказался успешным: было установлено наличие продуктивной инфекции, у животных развились клинические признаки гепатита, в их крови в течение нескольких месяцев обнаруживался контагиозный вирус [29] (рис. 4). Вскоре после этого лаборатория Йенса Буха [30] сообщила об аналогичной сконструированной РНК HCV; это еще раз доказало, что можно достичь продуктивного инфицирования. Работа Чарльза Райса предоставила убедительные доказательства того, что один только HCV может самостоятельно вызывать гепатит, персистировать в течение длительного времени и стимулировать специфический антительный ответ — все это особенности человеческой инфекции.
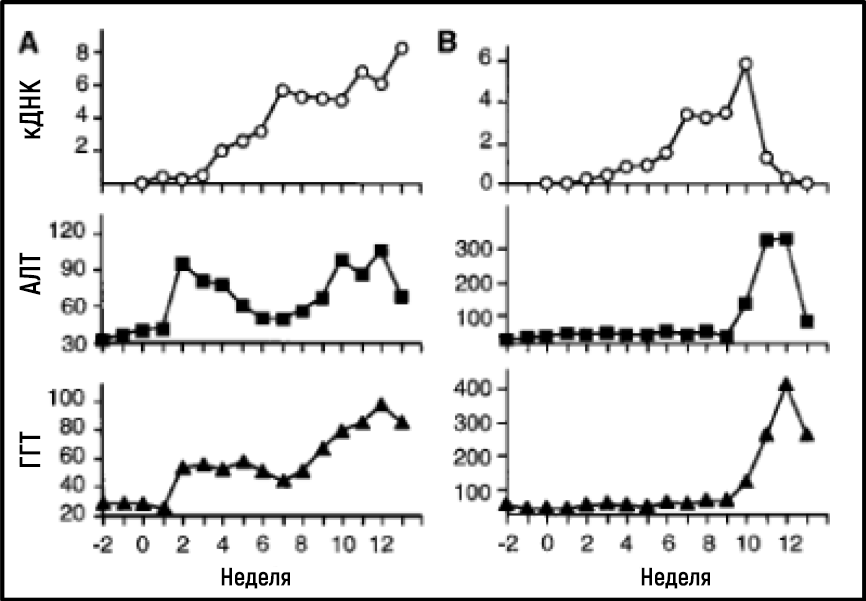
Источник: Kolykhalov et al. Science 1997
Новые противовирусные препараты
Открытие Нобелевскими лауреатами этого года HCV проложило путь к разработке эффективных противовирусных препаратов. Вызывая заболевание у приматов, полноразмерные клоны, созданные Райсом, проявляли плохую репликативную способность в клеточных линиях, что затрудняло исследования жизненного цикла вируса in vitro и тестирование противовирусных препаратов. Это препятствие было преодолено благодаря работе Ральфа Бартеншлагера из Гейдельбергского университета в Германии, который сконструировал первые субгеномные клоны HCV, которые реплицировались с высокой эффективностью в трансфицированных клеточных линиях гепатомы [31]. Дальнейшее совершенствование технологии и идентификация вирусных изолятов, которые могли реплицироваться в клеточных линиях без адаптивных мутаций, привели к производству субгеномных репликонов, которые при трансфекции в клетки гепатомы приводили к секреции контагиозных вирусных частиц [32]. Второе препятствие являлось следствием ограниченного спектра хозяев HCV (вирус поражает только людей и шимпанзе) и, как следствие, отсутствия небольших животных моделей для точной оценки патологического и иммунологического профилей заболевания и для доклинических испытаний кандидатов в препараты для специфического лечения. Прогресс был достигнут, когда мышам с тяжелым комбинированным иммунодефицитом (SCID) с недостатком Т- и В-клеток стало возможно трансплантировать человеческие гепатоциты [33]; были также разработаны другие модели (см. обзор [34]).
Доступность систем репликации in vitro и разработка моделей заболевания на мелких животных in vivo способствовали разработке высокоэффективных противовирусных препаратов, которые произвели революцию в лечении HCV. Более ранние терапевтические схемы, включавшие рекомбинантный интерферон I типа (IFN) и аналог нуклеозидов рибавирин, были неэффективными и ассоциировались со значительными побочными эффектами. Некоторый прогресс наступил в конце 1990-х годов с введением пегилированного IFN, а дальнейшие улучшения были достигнуты с введением ингибиторов протеазы NS3/NS4A, таких как бецепревир, телепревир и симепревир. Разработка препаратов, которые специфически нацелены на вирусную РНК-зависимую РНК-полимеразу NS5B, таких как софосбувир [35], и регуляторного белка репликона NS5A ледипасвира [36] стала крупным прорывом в лечении HCV. Комбинация препаратов, нацеленных на важнейшие вирусные функции, известных под общим названием «противовирусные препараты прямого действия» (DAA), оказалась высокоэффективной, вызывала лишь незначительные побочные эффекты и значительно снизила риск появления устойчивых к лекарствам вариантов вируса [37].
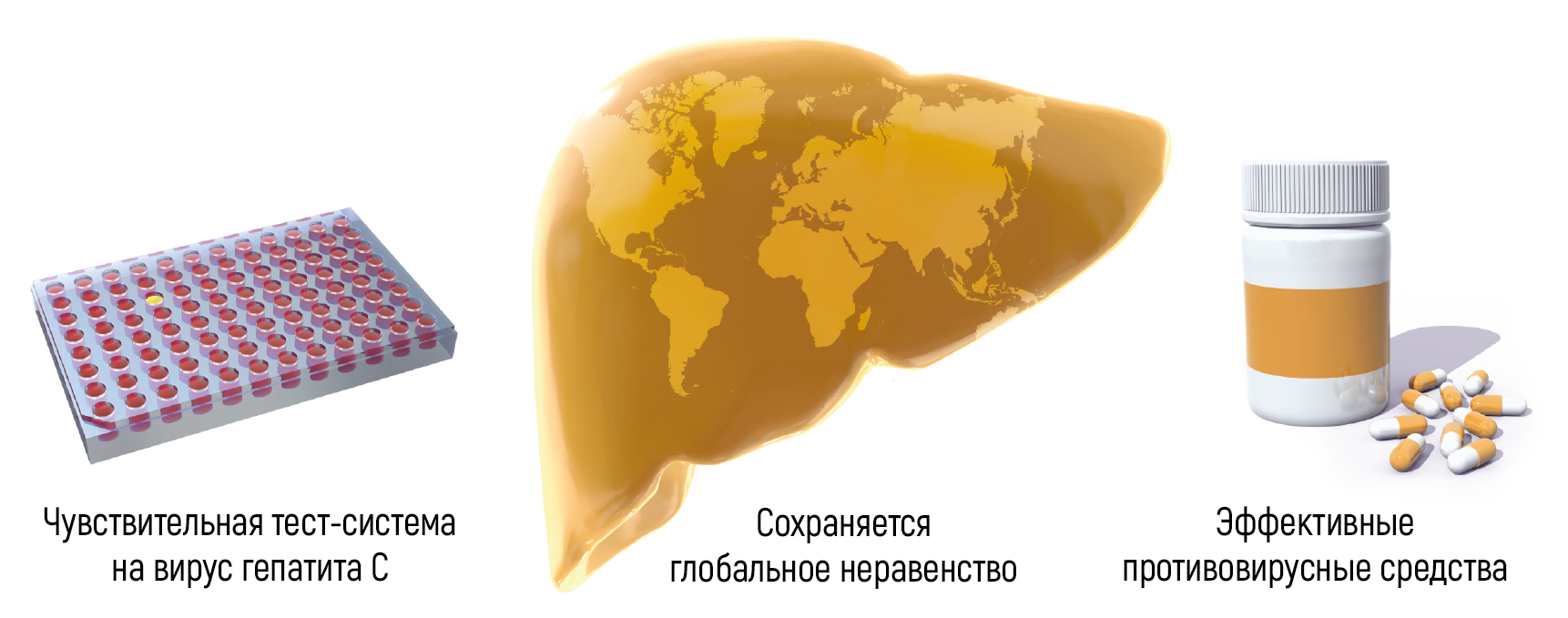
Рисунок 5 | Открытие вируса гепатита С привело к разработке высокочувствительных анализов крови и противовирусных препаратов, которые спасли миллионы жизней. Программы расширенного скрининга крови становятся все более доступны в глобальном масштабе, что, безусловно, является всемирным достижением.
Выводы
Благодаря новаторским исследованиям Альтера, Хоутона, Райса и многих коллег, которые работали по данным научным направлениям, надежные тесты, которые выявляют носителей HCV и позволяют исключить трансфузию инфицированной крови и ее компонентов, сейчас широко доступны во всем мире, а эффективные лекарства изменили судьбы пациентов, инфицированных HCV. В настоящее время гепатит, индуцированный данным вирусом, во многих случаях является излечимым заболеванием, а поражения, связанные с инфекционным процессом, часто обратимы. Клинические исследования показали, что краткосрочное противовирусное лечение излечивает более 95 % пациентов, включая запущенные случаи, которые не отвечали на предыдущие терапевтические методы. Это выдающееся достижение уже принесло пользу миллионам людей по всему миру. По-прежнему имеющиеся препятствия на пути к искоренению вирусного гепатита в настоящее время в основном связаны с отсутствием широких скрининговых кампаний (согласно Глобальным отчетам ВОЗ о гепатитах 2017 г., менее 20 % людей с HCV- и HBV-ассоциированным гепатитом имеют адекватный диагноз) и с высокой стоимостью наиболее эффективных методов лечения (рис. 5).
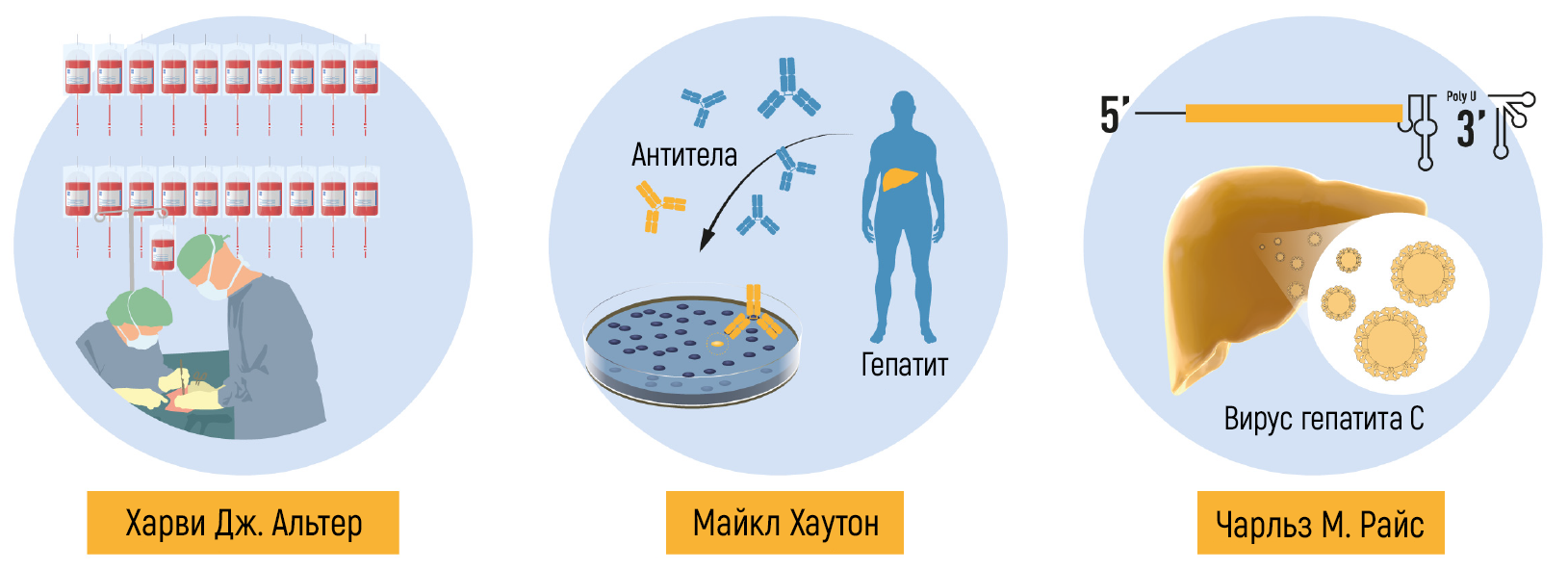
Рисунок 6 | Новаторские открытия Нобелевских лауреатов.
