Связь никотина с раковыми опухолями

Аннотация | В этой статье рассмотрены новые данные, свидетельствующие о прямом влиянии никотина на возникновение и развитие раковых опухолей. Список видов опухолей, которые связаны с никотином, постоянно пополняется, и на данный момент уже содержит такие виды рака, как мелко- и немелкоклеточный рак легкого, а также раковые опухоли тканей головы и шеи, желудка, поджелудочной железы, желчного пузыря, печени, толстой кишки, молочной железы, шейки матки, мочевого пузыря и почек. Мутагенные и проопухолевые эффекты никотина могут возникать из-за его способности повреждать геном, нарушать процессы клеточного метаболизма и способствовать росту и распространению перерожденных клеток. Никотиновые ацетилхолиновые рецепторы (nAChR, н-ХР), активируемые никотином, могут, в свою очередь, активировать некоторые потенциально проопухолевые сигнальные пути внутри клетки. Возможно, воздействие на эти рецепторы может быть использовано в профилактике или лечении раковых опухолей. Кроме того, появляется все больше свидетельств о влиянии индивидуальных генетических особенностей организма (например, полиморфизма генов, кодирующих н-ХР) на восприимчивость того или иного человека к патологическим эффектам никотина. Необходимо учитывать новые научные данные о механизмах канцерогенного влияния никотина при разработке правил, регулирующих производство, распространение и рекламу изделий, содержащих никотин.
Введение
Одновременно с увеличением потребления табачных изделий и продуктов, содержащих никотин, пришло и осознание того факта, что никотин сам по себе может обладать генотоксичностью и проопухолевыми эффектами. Канцерогенез — продолжительный процесс, который, согласно современным представлениям, начинается с возникновения мутации благодаря какому-либо фактору и продолжается при содействии других факторов, стимулирующих рост мутировавшей клетки. В табачном дыме содержится около 5000 химических веществ, и более шестидесяти из них являются канцерогенными. Помимо никотина, канцерогенным эффектом обладает его метаболит, образующийся в тканях: котинин, а также два табак-специфичных нитрозамина: N’-нитрозонорникотин (NNN) и 4-(метилнитрозамино)-1-(3-пиридил)-1-бутанон (NNK). Канцерогенный эффект этих веществ объясняется их способностью связываться с н-ХР на клетках не нервного происхождения. В тканях млекопитающих NNN синтезируется в реакции нитрозирования никотина с участием содержащихся в табаке алкалоидов. Как было показано в классических исследованиях, NNK, в отличие от NNN, не образуется в тканевом метаболизме никотина.
Алкалоид никотин был впервые выделен из табачного растения Nicotiana tabacum (семейство Пасленовые) немецкими химиками Поссельтом и Риманом в 1828 году. Сегодня продукты с содержанием никотина используются в медицинских (вставка 1) и рекреационных целях. Одним из ключевых направлений развития отрасли является создание новых изделий, использующих современные технологии для доставки никотина в организм без сжигания табака. Электронные сигареты (ЭС) быстро получили широкое признание в качестве устройств, помогающих людям полностью или частично отказаться от курения, облегчающих симптомы временного отказа от курения (например, в случаях, когда курить обычные сигареты запрещено) и позволяющих людям продолжать «курить», но с нанесением меньшего вреда здоровью. Однако правовой статус ЭС до сих пор остается неясным. Необходимо провести больше исследований, чтобы окончательно определить их пользу и вред. Так как в ЭС не происходит горения табака, пользователь вдыхает и выдыхает не дым, а аэрозоль никотина («пар»). Сейчас не существует стандартов относительно ЭС, что позволяет разным производителям включать в состав жидкости разнообразные компоненты. Общее содержание никотина во вдыхаемом аэрозоле в анализе 20 серий из 15 затяжек может находиться в диапазоне от 0,5 мг до 15,4 мг. Кроме того, данные о возможных токсических эффектах веществ неникотинового происхождения в составе ЭС значительно ограничены. ЭС могут содержать NNN и NNK, вещества с доказанной канцерогенностью. Данные, полученные в ходе недавних исследований, являются достаточным основанием для того, чтобы задуматься о безопасности никотина, будь то в составе табачных изделий, ЭС или лекарственных средств. Именно этот вопрос и поднимается в настоящей статье. ЭС вызывают наибольшие опасения, так как в них никотин может нагреваться с разнообразными (иногда недокументированными) веществами, что увеличивает вероятность образования канцерогенов.
Ацетилхолин (АХ) — вездесущее химическое соединение, присутствующее во всех живых организмах. Изначально АХ оказался довольно известен в основном благодаря его роли в синаптической передаче сигналов. Со временем, однако, ученые выяснили, что АХ выполняет более разнообразные функции, и некоторые из этих функций все еще исследуются. Появились доказательства того, что локально секретируемый клетками неневрального происхождения АХ может регулировать тканевой гомеостаз по аутокринному и паракринному механизму и оказывать множество биологических эффектов на разные типы клеток. В данный момент быстро увеличивается количество информации о роли мускариновых и никотиновых АХ-рецепторов, находящихся за пределами нервной системы, в реализации неневральных влияний АХ. После обнаружения н-ХР на эпителиальных клетках, выстилающих области перехода слизистых оболочек в кожу, ЖКТ и воздухоносные пути, стало очевидно, что на пути в центры «удовольствия» в ЦНС никотин сталкивается со множеством неневральных мишеней, которые он потенциально может повредить (вставка 1). Активация н-ХР неневральных клеток может влиять на рост и пролиферацию клеток, а также на механизмы, регулирующие апоптоз. АХ может независимо активировать специфические подтипы н-ХР, встречающиеся только у определенных типов клеток или у одних и тех же клеток на разных стадиях дифференцировки. Такая независимая активация рецепторов может как стимулировать, так и подавлять рост клеток. В целом клеточный ответ на стимуляцию АХ зависит от хрупкого равновесия между стимулирующими и подавляющими сигналами. После злокачественного перерождения клеток меняется доминирующий подтип экспрессируемых ими н-ХР. Это означает, что аутокринное и паракринное влияние АХ на здоровые и раковые клетки может быть различным, даже если эти клетки находятся друг рядом с другом в одной и той же ткани. То же самое можно сказать и о фармакологическом действии никотина. Никотин имеет более высокое сродство к н-ХР и, таким образом, может блокировать связывание АХ с ними. Множество патологических эффектов никотина осуществляются именно благодаря его вмешательству в АХ-сигнализацию в неневральных тканях, и некоторые из этих эффектов могут являться факторами, способствующими развитию раковых опухолей. Например, было показано, что никотин избирательно накапливается в тканях злокачественных опухолей желчного пузыря, что позволяет предполагать связь никотина с опухолями этого органа. Список видов опухолей, которые связаны с никотином, постоянно пополняется, и на данный момент уже содержит такие виды рака, как мелко- и немелкоклеточный рак легкого, а также раковые опухоли тканей головы и шеи, желудка, поджелудочной железы, желчного пузыря, печени, толстой кишки, молочной железы, шейки матки, мочевого пузыря и почек. Более того, согласно новейшим данным, однонуклеотидные полиморфизмы (ОНП) в генах, кодирующих субъединицы н-ХР, могут влиять на вероятность развития у индивида рака легкого, пищевода, желудка и шейки матки (вставка 3).
В этой статье рассмотрены множественные механизмы, с помощью которых осуществляется влияние никотина на возникновение и развитие раковых опухолей. Согласно собранным в научной литературе данным, никотин способен повреждать геном, нарушать процессы клеточного метаболизма, увеличивать активность онкогенов, инактивировать гены, подавляющие развитие опухоли и создавать микроокружение, способствующее возникновению рака. Необходимо пояснить, что, несмотря на то, что в одном метаанализе исследователи не обнаружили увеличенного риска развития опухолей ротовой полости и глотки у лиц, использующих снюс (табачное изделие, относящееся к бездымному табаку, табак при его употреблении не нагревается и не сжигается), в значительно большем количестве исследований говорится об увеличенном риске. Лица, использующие снюс, также подвержены большему риску возникновения опухолей пищевода, желудка и поджелудочной железы.
Мутагенные эффекты никотина
Канцерогенные тканевые метаболиты никотина
Никотин метаболизируется в печени ферментами CYP2A6 и CYP2B6 семейства цитохромов P450. 70–80 % никотина, который всасывается из желудочно-кишечного тракта, преобразуется в котинин. Котинин обладает проопухолевым эффектом, о чем свидетельствует аномальная клеточная пролиферация, реактивация теломеразы, подавление апоптоза в его присутствии. Экспериментально проопухолевые эффекты котинина были подтверждены в опытах на мышиной модели карциномы легкого Льюиса (котинин способствовал росту опухоли) и на мышах линии A/J (воздействие котинина ускорило развитие индуцированной NNK аденомы легких). Другими первичными метаболитами никотина являются N’-оксид никотина, норникотин, ион никотин-изометония, 2-гидроксиникотин и глюкоуронид никотина, которые, судя по всему, не являются канцерогенами. NNN является сильным канцерогеном, который может вызвать системные опухолевые процессы и локальные опухоли.
Он увеличивает пролиферативный потенциал клеток, обладает антиапоптотическим эффектом, а также способствует «безъякорному» росту и образованию опухолей у голых мышей. Эти эффекты не проявляются в присутствии антагонистов н-ХР, что указывает на способность NNN связываться с н-ХР.
Никотин-индуцированный мутагенез
Долгое время оставалось неясным, может ли никотин сам по себе вызывать рак. Тем не менее, по результатам последних исследований, демонстрирующих генотоксический эффект никотина на культивируемые эпителиальные клетки и его онкогенное действие на мышей линии A/J, можно сделать вывод о том, что никотин все-таки способен инициировать развитие опухолей. Генотоксические эффекты физиологических доз никотина были задокументированы с помощью теста на хромосомные аберрации и анализа обмена между сестринскими хроматидами на изолированных эпителиальных клетках и лимфоцитах человека. В этих исследованиях генотоксические эффекты были опосредованы активацией поверхностных н-ХР, что привело к повышению уровня активных форм кислорода (АФК). Никотин не только активирует поверхностные н-ХР, но и свободно проникает в эпителиальные клетки, активируя внутриклеточные сигнальные пути, приводящие к образованию АФК и повреждению ДНК. Однако, в отличие от нитрозаминов в табаке, которые вызывают мутацию KRAS и TP53, мишени генотоксичности никотина до сих пор не установлены.
Несмотря на большое количество исследований in vitro, онкогенный потенциал при долгосрочного системном введении никотина не был полноценно изучен. В ходе первоначального исследования, которое проводилось с целью подтверждения концепции, мы вводили мышам линии A/J 3 мг/кг никотина (LD50) подкожно 5 раз в неделю в течение 24 месяцев, при этом средняя доза составила 2,1 мг/кг в день. Эта доза примерно равна дозе никотина, потребляемой обычным пользователем скандинавского снюса, который, как правило, получает от 60 до 150 мг никотина в день. Следует отметить, что картридж для ЭС, наполненный жидкостью высокой крепости, содержит 48 мг никотина (в среднем пользователи ЭС потребляют по картриджу в день). LD50 никотина для человека — 6,5–13 мг на кг. В ходе этого исследования мы наблюдали образование лейомиосаркомы или рабдомиосаркомы у 78,6 % использованных в эксперименте мышей линии A/J, при этом в контрольной группе опухоли не образовались. У мышей линии A/J возможно спонтанное развитие рабдомиосаркомы, однако лейомиосаркома у них спонтанно не развивается, что, в свою очередь, указывает на то, что лейомиосаркомы образовались именно в результате воздействия никотина в ходе эксперимента. Это может быть результатом н-ХР опосредованного и/или нерецепторного действия никотина и его эндогенных метаболитов. Поскольку эти на мышей не воздействовали табаком, а вводили им чистый никотин, предполагается, что NNK в ходе эксперимента образоваться не мог. Хотя NNN может быть получен в ходе тканевого метаболизма никотина, его участие в развитии лейомиосаркомы кажется маловероятным, поскольку у мышей, получавших никотин, не было обнаружено никаких злокачественных опухолей в легких, а встречаемость опухолей легких у мышей, которые получают NNN, составляет 80 %, что было документально подтверждено. Таким образом, можно сделать вывод о том, что ни NNN, ни NNK является причиной саркомы у А/J мышей, которые получали никотин, и что никотин сам по себе обладает туморогенным действием. Возможно, у мышей A/J опухоли развивались в мягких тканях, а не в самих легких из-за того, что никотин вводили подкожно и благодаря своему быстрому метаболизму он не успел достигнуть эпителия дыхательных путей. Несмотря на то, что рекреационные никотинсодержащие продукты не используют подкожно, вышеуказанные результаты достаточно важны, поскольку это первое свидетельство канцерогенного потенциала никотина in vivo. Благодаря своему генотоксическому действию, никотин может вызвать злокачественную трансформацию, а затем способствовать росту трансформированных клеток из-за своих проопухолевых эффектов. Эти начальные исследования, демонстрирующие никотин-зависимые хромосомные аберрации in vitro и развитие лейомиосаркомы у мышей линии A/J, оправдывают дальнейшие исследования прямых мутагенных и онкогенных действий никотина.
Опосредованные н-ХР эффекты никотина н-ХР
Никотиновые ацетилхолиновые рецепторы
Никотиновые ацетилхолиновые рецепторы являются классическими представителями суперсемейства лиганд-зависимых ионных каналов. Канал открывается при связывании АХ или агонистов никотиновой группы, например, никотина. Содержащие никотин изделия усиливают сигнализацию от н-ХР, так как никотин имеет большее сродство к этим рецепторам, нежели АХ. Кроме того, увеличение экспрессии н-ХР на поверхности клетки в присутствии никотина может усиливать ответ клетки на аутокринную или паракринную стимуляцию физиологическими концентрациями АХ. Учитывая тот факт, что раковые клетки, с одной стороны, выделяют АХ, а с другой — экспрессируют н-ХР, можно сделать вывод о том, что эти рецепторы могут играть определенную роль в образовании опухолей даже в отсутствие стимуляции никотином. АХ-зависимые каналы в общем — пентамеры, состоящие из различных комбинаций субъединиц α1-α10, β1-β4, γ, δ и ε (рис. 1a), при этом субъединицы обладают структурным сходством и каждая из них имеет по 4 трансмембранных домена (рис. 1b). н-ХР, в частности, состоят из АХ-связывающих α-субъединиц и «структурных» субъединиц. Субъединицы α7, α8 (отсутствующая у человека), α9 могут формировать гомомерные н-ХР (впоследствии мы будем говорить о подтипах н-ХР, которые содержат эти субъединицы, как о «α7 н-ХР» и «α9 н-ХР»). На рисунке 1a показано, как из различных комбинаций субъединиц α1-α6 и β1-β4 составляются разные гетеромерные пентамерные каналы, например, может быть сформирован канал, содержащий субъединицы α3(β2/β4)±α5/α9 и α10. н-ХР в развивающейся мышце содержат две субъединицы α1, по одной β1, γ и δ. В зрелой мышце субъединица γ заменяется субъединицей ε. Есть и другие подтипы н-ХР, которые называют «нервными», так как после их открытия считалось, что они экспрессируются исключительно нейронами. Различия в составе субъединиц определяют функциональные и фармакологические особенности полученных каналов. Например, добавление субъединицы α5 (вспомогательной субъединицы, которая функционирует только в присутствии одновременно других α- и β-субъединиц) к двум субъединицам α3 и либо β2, либо β4, изменяет фармакологические и биофизические свойства н-ХР и увеличивает проницаемость канала для ионов Ca2+. Неневральные клетки способны экспрессировать практически все известные субъединицы и формировать из них функционирующие н-ХР. Котинин, как и никотин, может связываться с н-ХР, содержащими субъединицы α4 и β2, α3 и β2, α6 и β2.
Нормальные и злокачественные клетки экспрессируют различные подтипы рецепторов, кроме того, различаются и сигнальные пути, активируемые этими рецепторами. Состояние рецепторного аппарата зависит от типа клетки, текущей стадии клеточного цикла и влияния среды (например, от присутствия табачного дыма). Например, каждая клеточная линия немелкоклеточного рака легкого несет уникальный по качественному составу набор н-ХР на своей поверхности; некоторые клеточные линии аденокарцином и плоскоклеточных карцином экспрессируют н-ХР мышечного типа, содержащие субъединицы α1, β1, δ и ε, в то время как другие клеточные линии экспрессируют н-ХР нервного типа, содержащие субъединицы α3, α7 и α9. Хроническое воздействие чистого никотина или экстракта табака на культуры человеческих кератиноцитов кожи и полости рта изменяет экспрессию н-ХР, при этом зачастую клетки начинают экспрессировать н-ХР, характерные для раковых клеток. Не менее важную роль играет и количество н-ХР. Была показана связь гиперэкспрессии н-ХР с развитием раковой опухоли. В частности, никотин увеличивает экспрессию субъединицы α7, что приводит к экспрессии большего количества α7 н-ХР; известно, что этот тип рецепторов опосредует многие патологические эффекты никотина и табак-специфичных нитрозаминов. У некоторых типов раковых клеток избирательно увеличена экспрессия определенных подтипов н-ХР, независимо от того, курит ли человек, от которого был получен тот или иной образец (например, в клетках опухолей легких повышена экспрессия α7 н-ХР, а в клетках опухолей молочной железы — α9 н-ХР). В то же время, подавление экспрессии определенных субъединиц н-ХР (например, α9) ослабляет индуцированную воздействием никотина или табачных нитрозаминов пролиферацию клеток in vitro и in vivo.
Ионные сигнальные процессы, активирующиеся при открытии канала н-ХР
Через лиганд-зависимые каналы н-ХР при их открытии происходит пассивный транспорт ионов Na+ и Ca2+ внутрь клетки и транспорт ионов K+ из клетки. В нейронах активация н-ХР приводит к деполяризации мембраны и открытию потенциал-зависимых кальциевых каналов, через которые поток ионов Ca2+ направляется внутрь клетки. Несмотря на то, что потенциал-зависимые кальциевые каналы встречаются и у неневральных клеток, например, у кератиноцитов, вход кальция в клетку после стимуляции никотином осуществляется в основном через ионные каналы н-ХР, при этом величина потока у разных подтипов рецепторов различна. Гомомерные каналы, содержащие субъединицы α7 и α9, а также гетеромерные каналы, содержащие субъединицы α9 и α10, наиболее проницаемы для ионов Ca2+. В результате входа ионов Ca2+ внутрь клетки внутриклеточная концентрация несвязанного кальция возрастает. Однако в экспериментах на нескольких типах неневральных клеток было продемонстрировано, что проявления никотинергических эффектов можно добиться и в отсутствие внутриклеточного потока ионов Ca2+ и Na+. Таким образом, становится очевидно, что сигнализация от н-ХР нененевральных клеток должна осуществляться с участием как ионных, так и не-ионных сигнальных путей. Оба типа сигнализации могут играть ключевую роль в возникновении определенных биологических ответов при стимуляции клеточной никотинергической сигнальной системы.
Не-ионные сигнальные процессы, активирующиеся с участием н-ХР-зависимых протеинкиназ
Активация н-ХР неневральных клеток активирует и ряд не-ионных сигнальных процессов, которые осуществляют регуляцию фосфорилирования и дефосфорилирования белков. Эта функция н-ХР невозбудимых клеток была открыта сравнительно недавно. Экспериментально были выявлены незначительные различия ферментных каскадов, которые активируются при связывании никотина с н-ХР неневральных клеток. Тип взаимодействия н-ХР с сигнальными молекулами зависит в равной степени от типа неневральных клетки, на которую воздействует никотин, и от типа участвующей в этом взаимодействии субъединицы н-ХР. н-ХР-зависимые протеинкиназы могут быть активированы (с помощью фосфорилирования или дефосфорилирования) благодаря конформационным изменениям субъединиц н-ХР и/или связанных с ними белков (рис. 1c). Сигнализация от н-ХР может активировать фосфолипазу C (PLC), изоформы протеинкиназы C (PKC), PI3K, AKT, JUN-N-терминальную киназу (JNK), SRC, Янус-киназу 2 (JAK2), RAC, RHO, p38 MAPK и сигнальный путь RAS-RAF-MEK-ERK. Ca2+/кальмодулин-зависимая протеинкиназа II (CaMKII) может активироваться как с помощью ионных (поток ионов Ca2+, направленный внутрь клетки), так и не-ионных (освобождение внутриклеточного кальция) сигнальных процессов. Например, активация α3-содержащих н-ХР кератиноцитов может привести к активации PKC; активация н-ХР, содержащих одновременно субъединицы α3 и α5 приводит к активации CaMKII и p38 MAPK; активация α7 н-ХР может привести к активации p38 MAPK, AKT, RAS-RAF-MEK-ERK и JAK2; наконец, активация α9 н-ХР приводит к активации PLC, SRC, рецепторов эпидермального фактора роста (EGFR), PKC, RAC и RHO. В сущности, все эти сигнальные молекулы участвуют в передаче сигналов от других поверхностных клеточных рецепторов, например, EGFR, поэтому их активация может опосредовать внутриклеточное перекрестное взаимодействие сигналов.
Составляющие н-ХР белки могут быть структурно связаны как с протеинкиназами, так и с протеин-тирозинфосфатазами в составе больших мультимерных комплексов. Например, при стимуляции н-ХР никотином JAK2 связывается с субъединицей α7, что приводит к фосфорилированию и активации JAK2 с последующей активацией PI3K. Субъединица α7 также может быть структурно и функционально связана с киназами семейства SRC, а субъединицы α3, α4, α5 и β2 взаимодействуют с субъединицами G0α и Gβγ G-белков. Связанные с н-ХР белки могут модулировать никотинергическую сигнализацию (рис. 1c). Киназы семейства SRC и предположительно связанные с ними фосфотирозинфосфатазы (PPTP) регулируют активность АцХР, при этом SRC усиливают сигнализацию, поступающую от н-ХР, а PPTP оказывают противоположный эффект. Особенно интересно следующее наблюдение: никотинергическая активация митогенеза посредством α7 н-ХР осуществляется с помощью опосредованной β‑аррестином активации сигнальных путей SRC и RB-RAF1. В то же время фармакологическая активация α7 н-ХР стимулирует тирозин-фосфатазу, которая может инактивировать SRC, тем самым осуществляя отрицательную регуляцию. н-ХР-зависимые сигнальные каскады имеют множество других мишеней, в том числе факторы транскрипции, управляющие экспрессией генов (пример на рис. 1d), компоненты метаболических путей и структурные компоненты цитоскелета. Однако точные механизмы сигнализации в каждой конкретной ситуации еще предстоит установить.
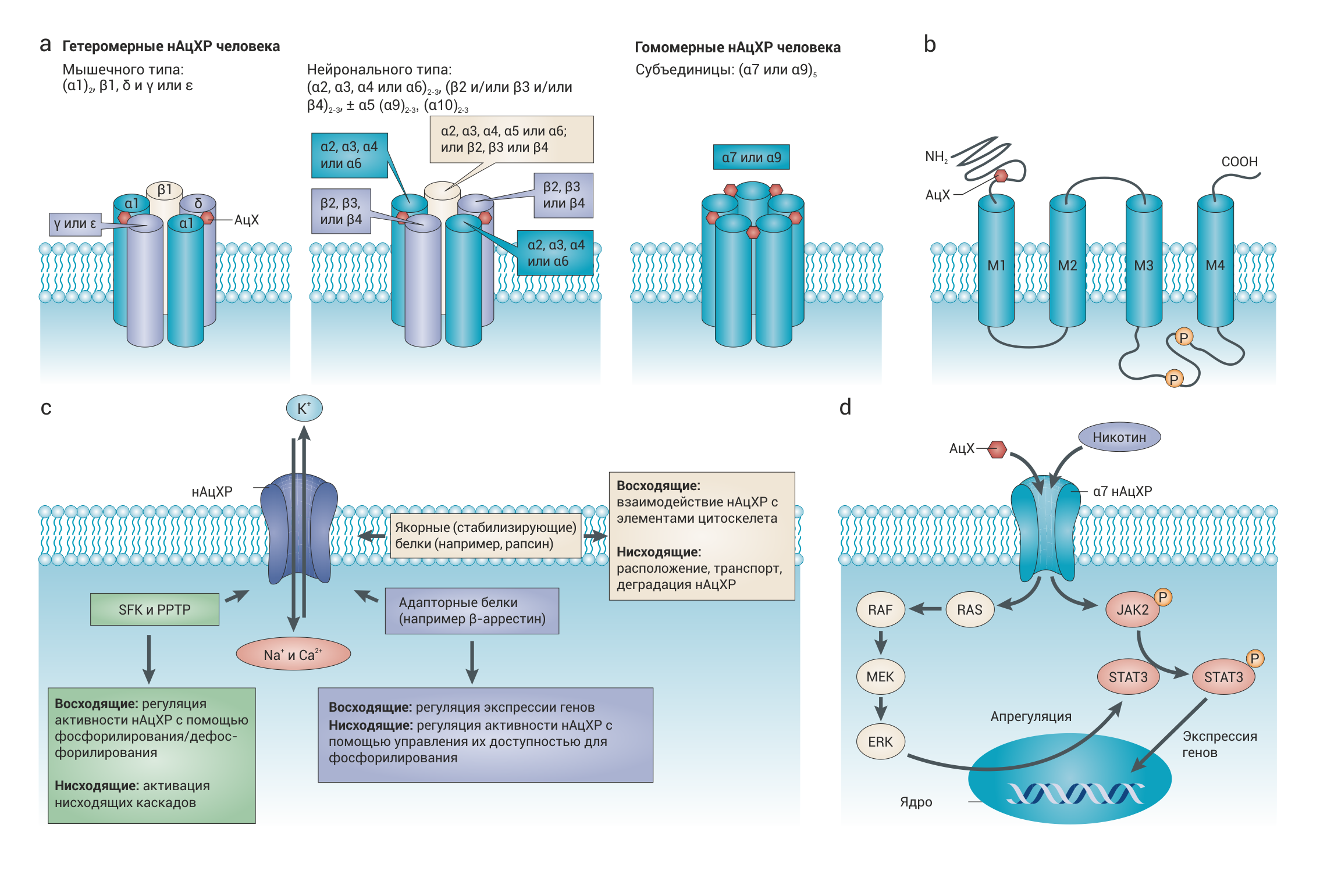
b | Топология расположения лиганд-связывающей α субъединицы н-ХР в мембране. Четыре гидрофобных трансмембранных домена обозначены как M1-M4. Лиганд-связывающий участок расположен на NH2-конце белковой цепи. Участки фосфорилирования киназ семейства SRC (SFK) отмечены как «P».
c | Возможные н-ХР-зависимые белки и их биологические эффекты. В ходе современных исследований были получены данные о связи н-ХР с заякоривающими (стабилизирующими) и адапторными белками (белками скаффолда), а также с протеинкиназами и фосфатазами. Нисходящая сигнализация, управляющая фосфорилированием сигнальных и структурных белков и изменяющая экспрессию генов, запускается конформационными изменениями субъединиц н-ХР, которые происходят при связывании рецептора с лигандом, например, АХ, никотином или его производным. Восходящая сигнализация, с помощью которой регулируется соотношение, количество, топология и функция мембранных н-ХР, осуществляется посредством вышеупомянутых н-ХР-зависимых белков в ответ на различные внутренние сигналы. Эти системы могут опосредовать перекрестное взаимодействие н-ХР с другими типами поверхностных клеточных рецепторов.
d | Совместное действие сигнальных путей RAS–RAF–MEK–ERK, JAK2 и STAT3 после активации α7 н-ХР. Стимуляция α7 н-ХР АХ или никотином приводит к изменению экспрессии генов благодаря активации STAT3, которая происходит посредством двух взаимодополняющих сигнальных путей. Активация RAS–RAF–MEK–ERK увеличивает количество STAT3 благодаря увеличению экспрессии его гена, а активация JAK2 приводит к фосфорилированию STAT3, после чего становится возможным перемещение димеров STAT3 в ядро и изменение экспрессии других генов и PPTP.
В исследовании никотинергической регуляции экспрессии α2 интегрина в кератиноцитах была установлена новая парадигма α7 н-ХР-опосредованной координации ионных и не-ионных сигнальных процессов. В эксперименте никотин оказался способен одновременно воздействовать на экспрессию генов и вызывать изменения цитоскелета, которые были необходимы для осуществления одного конкретного этапа клеточной миграции. Увеличивающий активность α2 интегрина каскад RAF-MEK-ERK был активирован благодаря одновременному влиянию двух механизмов: Ca2+-зависимой активации CaMKII и PKC, а также Ca2+-независимой активации RAS. В свою очередь, опосредованная PI3K активация RHO-зависимой протеинкиназы (ROCK) осуществлялась благодаря как Ca2+-зависимой активации CaMKII, так и Ca2+-независимой активации JAK2. Таким образом, разные сигналы, поступающие от α7 н-ХР могут активировать общие эффекторные молекулы и иметь общие мишени. Кооперативная сигнализация от α7 н-ХР, которая одновременно увеличивает активность α2 интегрина и активирует ROCK, имеет огромное биологическое значение, так как работа обеих этих эффекторных систем необходима для инициации клеточной миграции — процесса, который может играть важную роль в инвазии соседних тканей раковыми клетками и образовании метастазов.
Роль н-ХР в регуляции экспрессии генов
Как ионные, так и не-ионные сигнальные каскады, запущенные при участии н-ХР, могут приводить к изменениям в экспрессии генов. В классических исследованиях, проведенных на культуре нейроноподобных клеток клеточной линии SH-SY5Y, было продемонстрировано, что активация н-ХР модулирует экспрессию разнообразных генов, продукты которых можно распределить по четырем группам: факторы транскрипции, факторы процессинга белков, РНК-связывающие белки и белки, связанные с плазматической мембраной. Последующие исследования неневральных клеток подтвердили эти наблюдения. Было установлено, что регуляция экспрессии генов является общебиологической функцией н-ХР. Например, в исследовании на макрофагоподобных клетках клеточной линии U937 воздействие никотина увеличило экспрессию 118 генов и подавило экспрессию 97 генов. У кератиноцитов активация н-ХР изменила экспрессию генов, которые кодируют белки, отвечающие за трансдукцию сигналов, регуляцию клеточного цикла, апоптоз, межклеточную и клеточно-субстратную адгезию. При активации α3-содержащих н-ХР была увеличена экспрессия в числе прочих гена, кодирующего преобразователь сигнала и активатор транскрипции 1 (STAT1), при этом активация α7 н-ХР приводила к увеличению экспрессии генов, кодирующих STAT3 и GATA2. Воздействие никотина также увеличивало экспрессию маркера клеточного цикла и клеточной дифференцировки Ki67, ядерного антигена пролиферирующих клеток (PCNA), p21, циклина D1, p53, филаггрина и лорикрина. Эти белки могут сдвинуть динамическое равновесие между процессами роста и созревания клеток в сторону раннего и чрезмерного ороговения.
Недавний анализ воздействия никотина на транскриптом здоровых эпителиальных клеток молочной железы выявил изменения в экспрессии большого количества генов, вовлеченных в клеточные и метаболические процессы, в числе которых было немало генов, связанных с раковыми опухолями. В исследованиях на человеческих злокачественных клетках молочной железы линии MDA-MB-231 было показано положительное влияние никотина на экспрессию BCL-2 (обладающего анти-апоптотическим эффектом) и увеличение долговременной выживаемости клеток благодаря сигнализации через сигнальный путь SRC-AKT. Благодаря этим наблюдениям была выявлена регуляторная сеть, основным звеном которой является взаимодействие никотина с н-ХР, которое интегрирует митогенные сигналы, необходимые для развития опухоли молочной железы. На крысиной модели рака мочевого пузыря продемонстрировано увеличение экспрессии мутантного p53, потерявшего свои противоопухолевые свойства, при воздействии никотина. В клетках опухолей толстой и прямой кишок человека линий Caco-2 и HCT-8 никотин увеличил активность фосфорилирования AKT и экспрессию PI3K, PKC, ERK1, ERK2, сурвивина и BCL-2. Эти эффекты были опосредованы активацией α7 н-ХР и были ассоциированы с увеличением клеточной пролиферации и уменьшением апоптоза. Интраперитонеальное введение никотина мышам линии A/J с предварительно индуцированным воздействием NNK раком легких снизило вероятность выживания и подавило экспрессию сиртуина 1 (обладающего противоопухолевым эффектом) в легких.
С учетом проопухолевого потенциала аутокринного и паракринного АХ, вызванные никотином геномные процессы, приводящие к увеличению экспресии компонентов никотинергических сигнальных путей, представляют особенный интерес. В клетках человеческой бронхоальвеолярной карциномы никотин увеличил экспрессию холинацетилтрансферазы и везикулярного транспортера ацетилхолина, увеличив, таким образом, синтез и секрецию АХ. Эти геномные эффекты никотина были опосредованы активацией α7-, α3- и β2-, и β3‑содержащих н-ХР. В клетках плоскоклеточной карциномы легких и носоглотки человека никотин увеличивал экспрессию субъединицы α7 н-ХР. Эти новые наблюдения соответствуют более ранним сообщениям о никотин-зависимой модуляции экспрессии н-ХР в эпителиальных клетках, при которой α3-содержащие н-ХР заменялись α7 н-ХР. Несмотря на то, что экспрессия большинства клеточных рецепторов снижается в присутствии их агонистов, в случае никотина происходит обратное: хроническая стимуляция н-ХР приводит к парадоксальному увеличению экспрессии α7 н-ХР, а также н-ХР, содержащих одновременно субъединицы α5, α3 и β2. В кератиноцитах смена α3 и β2/β4-содержащих н-ХР на другой подтип, который также содержит субъединицу α5, происходит в основном с участием PKC; дальнейшая смена α3, β2/β4 и α5-содержащих рецепторов на α7 н-ХР опосредуется CaMKII и p38 MAPK; в положительную саморегуляцию экспрессии α7 н-ХР вовлечены JAK2 и сигнальный путь p38 MAPK-AKT. Фактор транскрипции GATA2 играет ключевую роль в увеличении экспрессии субъединицы α7 по механизму положительной обратной связи. Смена доминирующего подтипа н-ХР прогрессивно увеличивает поток поступающего в клетку кальция, а этот процесс ассоциирован с изменениями экспрессии генов, продукты которых управляют клеточным циклом и функциями клеток. Таким образом, никотин-зависимое изменение качественного состава н-ХР может стать новым патофизиологическим механизмом, объясняющим токсическое воздействие никотина на неневральные клетки.
Синергетическое взаимодействие никотинергической сигнализации и сигнализации от гормонов и факторов роста
Достоверно известно, что никотин способен ускорять заживление ран благодаря его синергетическому действию совместно с различными факторами роста. Воздействие никотина приводит к увеличению экспрессии фактора роста фибробластов 1 (FGF1) и его рецептора, FGF2 и фактора роста эндотелия сосудов (VEGF). Изучение этих эффектов никотина может помочь объяснить некоторые аспекты его проопухолевого воздействия. У быков активация н-ХР увеличивает экспрессию FGF2 посредством индукции фосфорилирования тирозина в некоторых белках, в том числе в связывающихся с промотором факторах транскрипции. Соответственно, ингибирование н-ХР подавляет экспрессию FGF2. В свою очередь, FGF2 и инсулиноподобный фактор роста I (IGF-I) могут влиять на экспрессию и расположение н-ХР на мембране, что может изменять биологические эффекты никотина. Было показано, что никотин ингибирует синтез и секрецию трансформирующего фактора роста-β (TGFβ), благодаря чему раковые клетки могут избежать анти-пролиферативного влияния этого фактора роста; однако, такой эффект наблюдается не во всех типах клеток. В клетках карциномы носоглотки человека никотин увеличил экспрессию VEGF, однако при этом подавил экспрессию пигментного фактора эпителиального происхождения (PEDF) — многофункционального секретируемого белка, который несет анти-ангиогенные, анти-пролиферативные и нейротрофические функции — и это привело к значительному соотношения VEGF/PEDF. В нескольких исследованиях было продемонстрировано, что сигнализация от н-ХР при стимуляции никотином в том числе повлияла на фосфорилирование и активацию EGFR; считается, что этот сигнальный путь может быть вовлечен в развитие рака молочной железы. Сигнализация от факторов роста может изменять состав и экспрессию н-ХР на поверхности клетки. Например, сигнализация от FGF2, инсулина и IGF-I, а также от рецепторов к эстрогенам изменяет экспрессию н-ХР и их расположение на мембране, изменяя, таким образом, биологические эффекты аутокринного и паракринного АХ, а также никотина. Никотин также увеличивает синтез адреналина, который может стимулировать рост раковых клеток, воздействуя на адренорецепторы, связанные с G-белками. Все вместе эти наблюдения являются вескими доказательствами наличия синергетического взаимодействия между рецепторами к факторам роста и н-ХР. Это взаимодействие может оказаться необходимым условием для проявления биологических и проопухолевых эффектов никотина и его метаболитов после их связывания с н-ХР.
Развитие и распространение опухоли
Выживание раковых клеток и их защита от апоптоза
Было показано, что воздействие никотина увеличивает выживаемость раковых клеток. Этот эффект может возникать из-за пониженной активности p53 в этих клетках. Кроме того, никотин увеличивает активность теломеразы посредством сигнального пути PI3K–AKT, подавляя, таким образом, процессы, управляющие старением и гибелью клетки. Установлено, что никотин благодаря своему влиянию на процессы апоптоза уменьшает чувствительность опухолевых клеток к радио- и химиотерапии.
В ходе недавно проведенных исследований было установлено, что никотинергическая регуляция жизни и гибели клеток значительно сложнее, чем считалось ранее. При воздействии никотина на механизмы, осуществляющие эту регуляцию, проявляются анти-апоптотические эффекты никотина, которые позволяют клеткам неограниченно размножаться. На внешней мембране митохондрий неневральных клеток экспрессируются функционирующие н-ХР, которые могут содержать субъединицу α7 или не содержать ее. Активация митохондриальных α7 н-ХР предотвращает высвобождение цитохрома c, блокируя, таким образом, начальный этап внутриклеточного пути активации апоптоза. Недавно полученные данные об ингибировании открытия митохондриальных мегапор (mitochondrial permeability transition pores, MPTP) при активации внутриклеточных н-ХР согласуются с более ранними сообщениями об анти-апоптотическом воздействии никотина на митохондрии. Внутриклеточная ацетилхолинэстераза, функция которой состоит в гидролизе растворенного в цитозоле АХ, неспособна гидролизовать никотин, поэтому тот может активировать митохондриальные н-ХР, которые опосредуют анти-апоптотический эффект. Для того, чтобы пролить свет на механизмы, облегчающие выживание раковых клеток в присутствии никотина, необходимо изучить все молекулярные процессы, происходящие после активации митохондриальных н-ХР.
Пролиферация
Было зафиксировано, что н-ХР, в особенности их подтип α7, могут опосредовать никотинзависимое увеличение экспрессии генов, продукты которых регулируют пролиферацию и выживание клеток. Эти гены играют значительную роль в росте и развитии клеток опухолей легких как in vitro, так и in vivo. Даже кратковременное воздействие никотина активирует митогенные сигнальные пути, в которых участвуют PKC, ERK и AKT. В исследованиях, использовавших хориоаллантоисную мембрану куриного эмбриона с имплантированными раковыми клетками в качестве модели, воздействие никотина удвоило скорость роста опухолей молочной железы, толстой кишки и легких. Воздействие никотина также увеличило количество и размеры опухолей легких (предварительно индуцированных табачными нитрозаминами) в экспериментах на мышах линии A/J. Интересно, что воздействие NNK увеличивает экспрессию α7 н-ХР в клетках легких у мышей линии A/J, которые подвержены развитию рака, однако не вызывает такого эффекта у мышей линии C3H, которые устойчивы к развитию NNK-индуцированных опухолей. Увеличение числа н-ХР может дать злокачественным клеткам возможность связывать большее количество аутокринного или паракринного АХ (или никотина), чем в норме, что может облегчить их и без того быстрый рост.
Метастазирование
Фармакологическая стимуляция н-ХР коррелирует с метастатической диссеминацией опухолевых клеток. В частности, в эксперименте на мышах с тяжелым комбинированным иммунодефицитом (SCID) никотин способствовал метастазированию ортотопически трансплантированных клеток аденокарциномы поджелудочной железы человека в печень. Такой же эффект никотина наблюдался при подкожной инъекции голым мышам клеток двух линий плоскоклеточных карцином головы и шеи. У мышей линии A/J никотин усиливал рост и метастазирование NNK-индуцированных опухолей легких, что означает, что он может играть определенную роль в развитии рака, так его воздействие облегчает рост клеток с поврежденным геномом. Стабилизация и активация индуцируемого гипоксией фактора 1α (HIF1α — кислород-чувствительного активатора транскрипции) и синергетическая кооперация сигнальных путей AKT и MAPK могут быть необходимыми условиями проявления про-инвазивных эффектов никотина. Необходимо отметить, что в тех исследованиях in vivo на мышах с ортотопически имплантированными клетками рака поджелудочной железы, подвергавшихся воздействию табачного дыма, в которых было обнаружено значительное увеличение метастазирования в различные удаленные органы по сравнению с контрольными тестами, была также обнаружена гиперэкспрессия α7 н-ХР в метастатических клетках. Из этих наблюдений можно сделать вывод о том, что никотинзависимой миграцией клеток рака поджелудочной железы in vitro можно управлять с помощью воздействия на α7 н-ХР.
Про-метастатическое влияние никотина на раковые клетки может быть основано на его способности вызывать эпителиально-мезенхимальный переход (EMT — механизм, с помощью которого клетки могут утратить свои эпителиальные свойства и приобрести некоторые свойства мезенхимальных клеток, способствующие миграции) и стимулировать миграцию и инфильтрацию опухолевых клеток. Никотин вызывает изменения экспрессии генов, связанных с EMT в человеческих раковых клетках различных линий, например, происходит снижение количества E-кадгерина и плотных контактов 1 типа (zona occludens 1 — ZO1), которые являются маркерами эпителиальных клеток, и соответствующее увеличение количества мезенхимальных протеинов виментина и фибронектина. In vitro никотин усиливал миграцию клеток рака толстой кишки линий DLD-1 и SW480, при это выраженность эффекта зависела от дозы никотина. В целом, про-инвазивное виляние никотина на раковые клетки согласуется с его достоверно установленной способностью стимулировать миграцию клеток и стадию эпителиализации при заживлении ран. Все эти данные позволяют предложить модель, объясняющую участие н-ХР в метастазировании.
Процесс миграции клетки начинается с ее отсоединения от соседних клеток (скеттеринга), после которого происходит направленная (хемотаксис) или случайная миграция. В экспериментах на эпидермальных кератиноцитах было показано, что физиологический контроль над определенными фазами клеточной миграции осуществляется в основном посредством специфических подтипов н-ХР. Сигнализация от α9-содержащих н-ХР жизненно необходима для инициации клеточной миграции. Стимуляция α9-содержащих н-ХР стимулирует фосфорилирование белков фокальной адгезии: паксиллина и киназы фокальных контактов, — а также фосфорилирование белков межклеточных контактов: β-катенина и десмоглеина-3. В результате этих процессов разрушаются структуры, соединяющие клетки между собой. В то же время ингибирование α9 н-ХР подавляет фосфорилирование белков адгезии и цитоскелета и препятствует скеттерингу колонии. В исследованиях миграции клеток in vitro было обнаружено, что стимуляция α9 н-ХР связана с активацией PLC, SRC, EGFR, PKC, RAC и RHO, в то время как ингибирование этих рецепторов приводило к подавлению фосфорилирования белков адгезии и цитоскелета. В свою очередь, α7 н-ХР направляют хемотаксис клетки по градиенту концентрации своего агониста, будь то АХ или никотин; этот процесс связан с гиперэкспрессией α2-интегрина. В составе активирующегося при α7-зависимом хемотаксисе сигнального пути находятся следующие звенья: внутриклеточный кальций, CaMKII, классические изоформы PKC, PI3K, RAC и CDC42. α3β2-содержащие н-ХР управляют случайной клеточной миграцией посредством PKCδ- и RHOA-зависимых сигнальных каскадов.
Способствующая развитию опухоли среда
Ангиогенез (неоваскуляризация)
Появились веские доказательства того, что воздействие никотина инициирует патологический ангиогенез и способствует, тем самым, выживанию и распространению опухоли. В исследованиях, проведенных на мышиной модели карциномы легкого Льюиса (LLC) и на мышах с ксенотрансплантатами клеток рака толстой кишки было обнаружено, что никотин способствовал росту опухоли в связи с усилением ее васкуляризации. Более того, MG624 — антагонист α7 н-ХР — ингибировал ангиогенез в мелкоклеточной опухоли легкого человека в двух исследованиях in vivo, в одном из которых в качестве модели использовалась хориоаллантоисная мембрана куриного эмбриона, а в другом — голая мышь. В исследовании на хориоаллантоисной мембране воздействие никотина вызвало формирование трубок сосудов эндотелиальными клетками. Этот эффект блокировался при введении ингибиторов ERK1 и ERK2 и антител к αVβ3-интегрину. Все эти наблюдения указывают на то, что никотин способствует пролиферации и миграции эндотелиальных клеток, имитируя, таким образом, эффекты традиционных ангиогенных факторов роста (например, VEGF). Блокада аутокринных или паракринных никотинергческих сигнальных путей предположительно может быть использована для остановки избыточного ангиогенеза в опухолях.
Ремоделирование стромы тканей
Никотин может играть определенную роль в создании благоприятной среды для развития опухоли, так как он способствует реорганизации и/или деградации межклеточного матрикса и секреции белков, составляющих этот матрикс. Фибробласты являются основным клеточным компонентом соединительной ткани и, судя по всему, основной мишенью никотина. Никотин способствует возникновению про-опухолевой среды в основном благодаря его влиянию на фибробласты. Фибробласты, обработанные табаком, выделяют факторы, которые увеличивают пролиферацию и инфильтрацию обессмерченных (но еще не злокачественных) эпителиальных клеток. Эти эффекты могут быть частично опосредованы активацией фибробластных н-ХР никотином или его метаболитами. Эти выводы были сделаны на основании того наблюдения, что воздействие мекамиламина — антагонист н-ХР — устранило никотинзависимое увеличение экспрессии металлопротеиназы 1 и белков дермального матрикса: коллагена типа Iα1 и эластина, — в фибробластах. Обобщив результаты экспериментов, в которых клетки подвергались воздействию как цельного табака, так и чистого никотина, можно предположить, что никотин не только инициирует про-опухолевые изменения в эпителиальных клетках, но и способствует росту и инфильтрации мутировавших клеток, создавая благоприятную для роста опухоли среду.
Защита раковых клеток от иммунного контроля
Воздействие никотина дает раковым клеткам возможность избежать наблюдения со стороны иммунной системы, которая в норме предотвращает развитие рака, уничтожая трансформированные клетки. Существуют различные механизмы, благодаря которым никотин способен подавлять противоопухолевый иммунитет. Сообщают, что никотин неблагоприятно воздействует на дендритные клетки, которые играют важную роль в осуществлении противоопухолевого иммунитета. Это эффект позволяет ослабить ответ реципиента на чужеродный объект при пересадке. Общее иммуноподавляющее действие никотина проявляющееся в виде снижения продукции IL-2 было продемонстрировано в эксперименте на человеческих митоген-стимулированных мононуклеарных клетках периферической крови (PBMC). Воздействие никотина также увеличивает количество Treg лимфоцитов, уменьшает количество TH 17 лимфоцитов и подавляет синтез IL-17 у мышей; эти изменения могут повлиять на эффективность противоопухолевого иммунитета. Однако наиболее важным эффектом никотина является снижение цитотоксической активности NK-лимфоцитов — эффекторов врожденного иммунитета, которые напрямую осуществляют противоопухолевый иммунитет. Например, введение никотина в смешанную культуру NK-лимфоцитов и клеток лимфомы линии Yac-1 подавило NK-зависимый лизис раковых клеток. При этом ингибирующий эффект никотина не проявляется при дефиците β2-содержащих н-ХР.
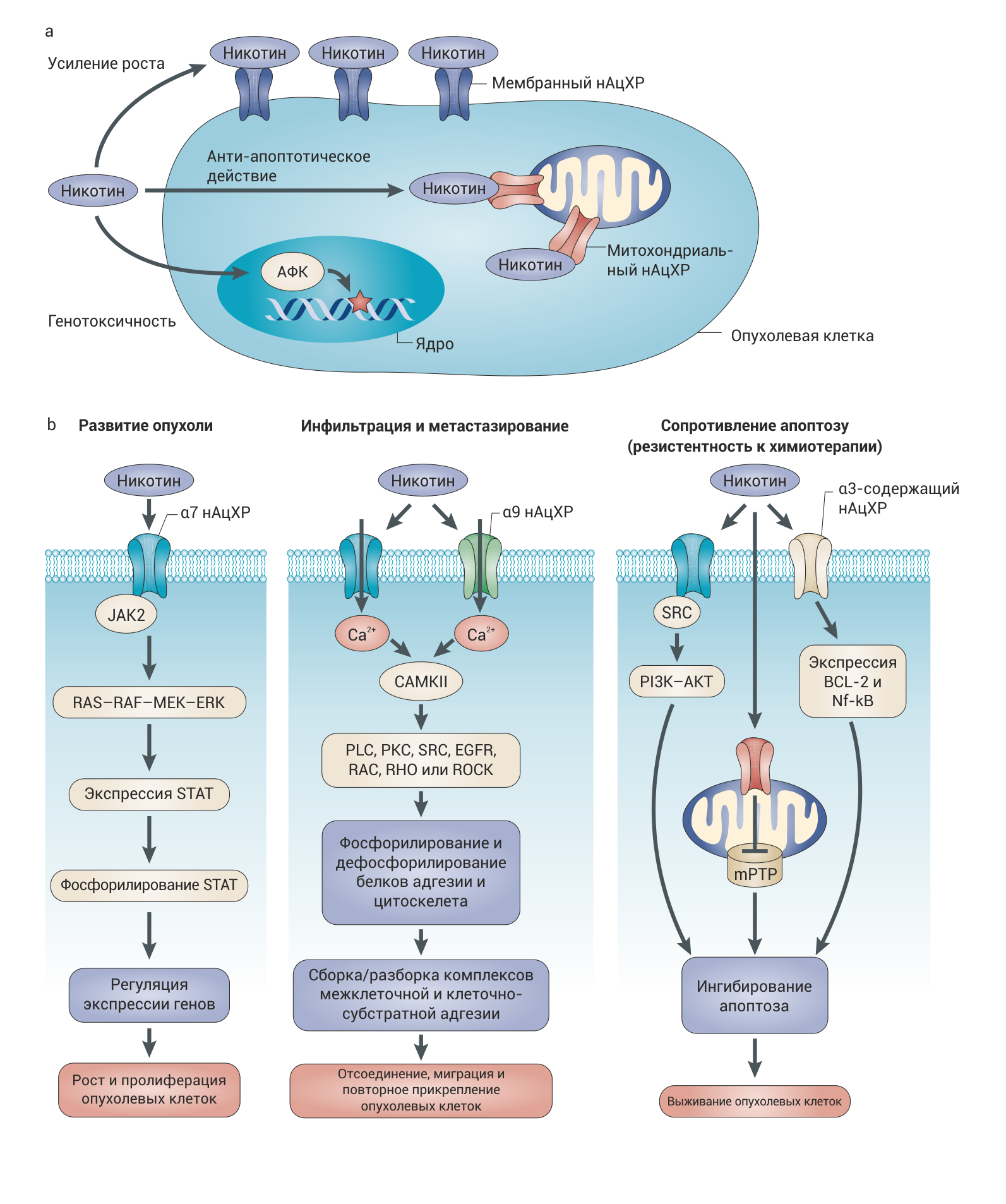
b | Основные нисходящие сигнальные пути от наиболее часто встречающихся подтипов н-ХР, которые могут опосредовать патологические эффекты никотина. Несмотря на то, что состав и последовательность компонентов в этих сигнальных каскадах были открыты в ходе сугубо механистических исследований на человеческих кератиноцитах, те же самые сигнальные пути участвуют в формировании опухолей, связанных с употреблением табака или никотина. CaMKII — Ca2+/кальмодулин-зависимая протеинкиназа II; EGFR — рецептор эпидермального фактора роста; JAK2 — Янус-киназа 2; mPTP — митохондриальные мегапоры (поры, обуславливающие изменение проницаемости митохондриальной мембраны); NF-κB — ядерный фактор-κB; PKC — протеинкиназа C ; PLC — фосфолипаза C; ROCK — RHO-зависимая протеинкиназа; STAT — преобразователь сигналов и активатор транскрипции.
Вывод
Никотин может играть определенную роль в возникновении и развитии раковых опухолей благодаря различным эффектам. Это вещество генотоксично, способствует выживанию, росту, метастазированию раковых клеток, обеспечивает их устойчивость к химио- и радиотерапии, и, кроме того, создает про-опухолевую среду, которая может облегчить развитие опухолей, индуцированных другими факторами. Множественные механизмы, обеспечивающие канцерогенность никотина, могут быть связаны как с его рецептор-опосредованным так и с нерецепторным воздействием. Способствующие развитию опухолей эффекты, судя по всему, опосредованы н-ХР на мембранах клетки и митохондрий, тогда как генотоксичность возникает из-за увеличения концентрации активных форм кислорода (АФК) (рис. 2a). Рецептор-опосредованные эффекты никотина проявляются при синергетическом взаимодействии ионных и не-ионных сигнальных процессов (рис. 2b). Генотоксичные эффекты никотина синергетически взаимодействуют с эффектами других табачных канцерогенов. Определенные гормоны и факторы роста также взаимодействуют с никотином, что приводит к проявлению других проопухолевых эффектов. В будущих исследованиях необходимо обратить внимание на относительный вклад разных мутагенных и проопухолевых никотинзависимых сигнальных путей в развитие разных типов рака. н-ХР могут стать потенциальной мишенью в терапии раковых опухолей, так как такая терапия может восстановить физиологические функции и запустить процессы апоптоза в злокачественных клетках. Определение активируемых у конкретного ракового больного никотинергических путей может быть полезно в клинике, так как станет возможным использовать фармакологические ингибиторы сигнальных путей, характерных для конкретного пациента. Подавление экспрессии субъединиц н-ХР и воздействие антагонистов н-ХР подавляют канцерогенез in vitro и in vivo, что является одним из оснований для использования ингибиторов никотинергической сигнализации в лечении рака. Таким образом, исследователи уверены, что н-ХР могут стать мишенью лекарств нового поколения, нацеленных на предотвращение и лечение опухолей. На самом деле важность исследований канцерогенности никотина не ограничивается только их практической применимостью к вопросу лечения и предотвращения опухолей, связанных с употреблением табака, так как н-ХР активируются, в том числе, аутокринным и паракринным АХ, и, таким образом, регулируют хрупкое равновесие между процессами пролиферации и гибели клеток, которое отделяет нормальное состояние от неоплазии. Фармакологическая модуляция активности н-ХР может влиять как на качественный и количественный состав потока ионов, возникающего при открытии канала, так и на активацию различных киназ или сигнальных путей.
Люди, несущие определенные подтипы н-ХР, более подвержены риску развития раковых опухолей. Разные подтипы н-ХР могут оказывать противоположное влияние на рост клеток и устойчивость к злокачественной трансформации (вставка 3). Определенные ОНП в генах н-ХР могут изменять реакцию индивида на никотин. Мутантные рецепторы постоянно стимулируются физиологическими концентрациями аутокринно или паракринно секретируемого АХ, но никотин и другие химические вещества, в том числе табачный канцероген NNK, могут увеличивать сигнализацию от этих рецепторов, способствуя, таким образом, неопластической трансформации клеток. Таким образом, воздействие никотина может стать одним из факторов, увеличивающих риск выживания и распространения перерожденных клеток. Здоровым людям, несущим определенные ОНП в генах н-ХР, следует избегать воздействия никотинсодержащих продуктов, то же самое можно сказать и о людях, проходящих курс химио- и радиотерапии, а также уже излечившихся от рака. Определение специфических механизмов, посредством которых определенные генетические варианты н-ХР изменяют предрасположенность к развитию рака, позволит применять персонализированный подход к профилактике рака.
Необходимо учитывать новые научные данные о механизмах канцерогенного влияния никотина при разработке правил, регулирующих производство, распространение и рекламу изделий, содержащих никотин. В будущих исследованиях необходимо обратить внимание на возможную зависимость канцерогенности никотина от дозы, времени воздействия и от способа введения (будь то чрезкожное введение с помощью кожного пластыря, ингаляция, оральное введение или введение с помощью клизмы). Необходимо разработать чувствительные тесты для определения мутагенной и про-опухолевой активности никотина in vitro и in vivo для разработки стандартов оценки канцерогенности никотина в составе различных изделий.
