Воспаление приводит к формированию фиброзных рубцов в ЦНС

Фиброзные рубцы, развивающиеся вследствие воспаления, — хорошо известное явление в периферических тканях, но роль его в ЦНС остается малоизученной. Результаты нового исследования, проведенного на модели рассеянного склероза (РС), свидетельствуют, что локальная пролиферация фибробластов в ЦНС в ответ на инфильтрацию циркулирующими воспалительными клетками приводит к образованию фиброзных рубцов, что может ограничивать восстановление нервной ткани.
Все больше растет понимание того, что инфильтрация периферических иммунных клеток в паренхиму ЦНС может иметь пагубные последствия при аутоиммунных заболеваниях, а также при таких патологиях, как ишемический инсульт, травматические повреждения и нейродегенеративные заболевания [1, 2].
Важным и общеизвестным следствием такого воспаления в других органах по всему телу является пролиферация стромальных клеток фибробластного происхождения, что приводит к образованию рубцов и фиброзу вследствие накопления белков внеклеточного матрикса, таких как коллагены [3, 4]. Механизмы, лежащие в основе фиброзного рубцевания, и его последствия хорошо изучены на примере многих тканей (не в ЦНС), и уже превратились в терапевтические цели при заболеваниях легких, сердца и суставов [5, 6]. Несмотря на то, что известно, что фиброзные рубцы образуются в эпицентре повреждений, вызванных травмой спинного мозга и инсультом [2, 7], существует относительно немного сведений о рубцевании стромальными клетками и последствиях этого процесса для ЦНС или о том, как взаимосвязаны воспаление и фиброз при патологиях ЦНС. При аутоиммунных заболеваниях, таких как РС, и в модели РС у грызунов, экспериментальном аутоиммунном энцефаломиелите (ЭАЭ), удалось различить фиброзные процессы (в форме отложения коллагена и других молекул внеклеточного матрикса), сопутствующие воспалению [8], но онтогенетическое происхождение и эффекты этого фиброза изучены недостаточно.
В новом исследовании, опубликованном в «Nature Neuroscience», проведенном Dorrier с соавт., ученые определили в качестве основного источника коллагена при фиброзировании резидентные для ЦНС локальные фибробласты при поражении ЭАЭ спинного мозга [9]. Генетически ориентированная профилактика этого фиброза, опосредованного фибробластами, привела к увеличению количества клеток-предшественников олигодендроцитов (КПО, обладают потенциальными репаративными свойствами) в областях воспаления и демиелинизации в нервной паренхиме [9].
В здоровой ЦНС клетки, вырабатывающие коллаген, и сам белок коллаген находятся только вдоль кровеносных сосудов и в мозговых оболочках и не обнаруживаются в нервной паренхиме. Dorrier с соавт. удалось показать, что при ЭАЭ, индуцированном у мышей иммунизацией гликопротеином миелина олигодендроцитов (ГМО), инфильтрация иммунных клеток из кровотока приводит к выраженному пролиферативному распространению клеток, вырабатывающих коллаген, и его отложению в нервной паренхиме, что связано именно с воспалительным процессом при ЭАЭ (рис. 1а). Такого распространения клеток, вырабатывающих коллаген, и фиброза не наблюдалось, когда инфильтрацию ЦНС циркулирующими иммунными клетками у мышей с ЭАЭ предотвращали путем воздействия финголимода, который останавливает выделение иммунных клеток из лимфатических узлов и используется для лечения РС. Кроме того, ученые обнаружили, что демиелинизация, опосредованная купризоном, которая не вызывает инфильтрации периферическими иммунными клетками, не связана с фиброзом, тогда как демиелинизация, опосредованная лизолецитином, вызывает и инфильтрацию периферическими иммунными клетками, и фиброз. Эти результаты представляют собой убедительные доказательства того, что фиброзные рубцы являются следствием, а не причиной инфильтрации иммунными клетками.
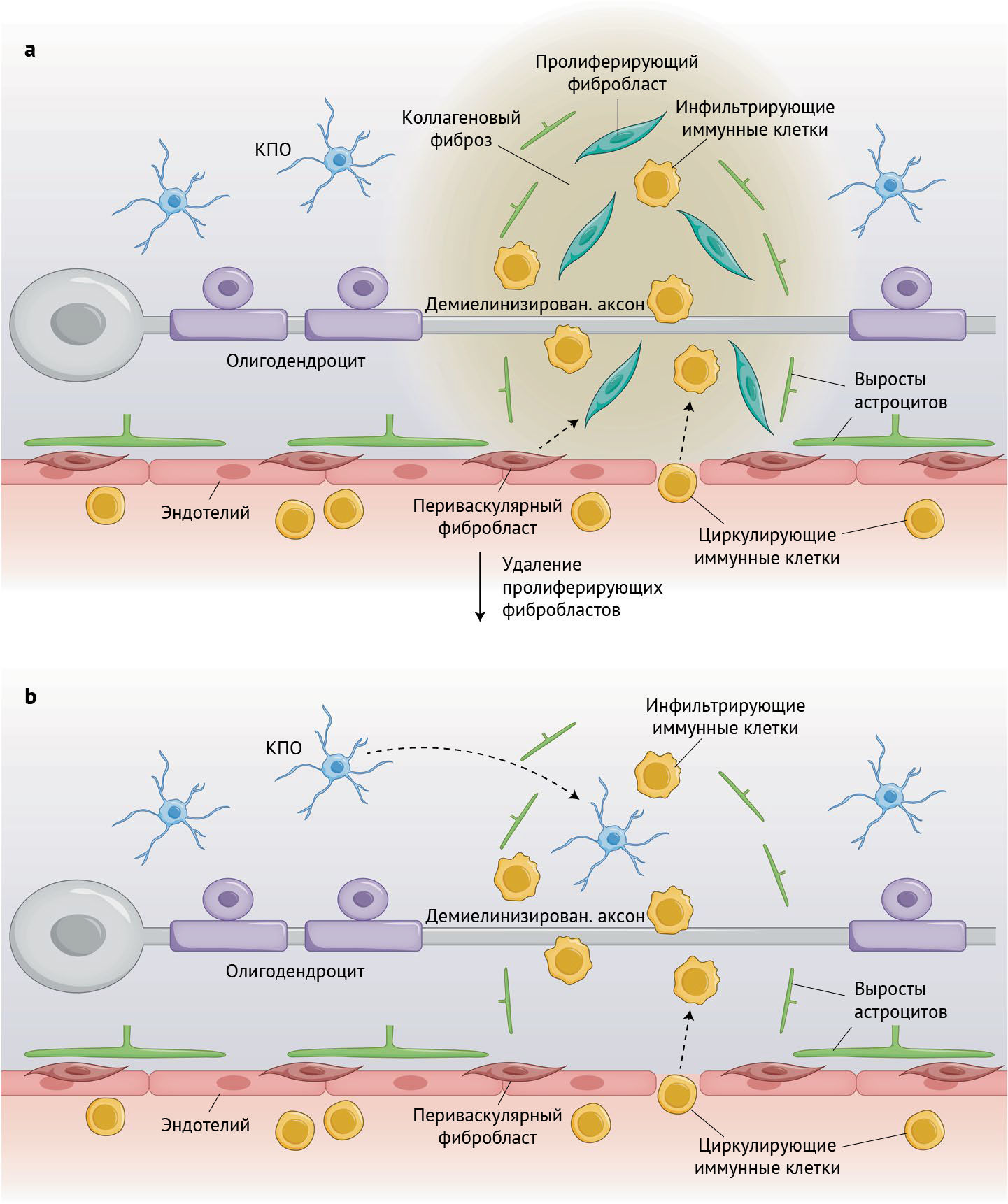
b — трансгенно нацеленное удаление пролиферирующих фибробластов при ЭАЭ значительно ослабляет фиброзный процесс и повышает количество КПО в воспаленных участках нервной паренхимы, несмотря на иммунокомпетентные клетки.
Чтобы найти клетки, стимулирующие фиброзирование вследствие воспаления, Dorrier с соавт. использовали стратегию отслеживания клонов клеток, в которой репортерный белок нацелен на определенный тип клеток с использованием трансгена, регулируемого тамоксифеном. Тамоксифен, временно вводимый взрослым мышам, активирует экспрессию репортерного гена в клетках, экспрессирующих трансген, который становится независимым от тамоксифена и передается всему поколению этих клеток. Используя эту экспериментальную модель, Dorrier с соавт. показали, что распространение клеток, выделяющих коллаген, в места поражения паренхимы при ЭАЭ происходит в подавляющем большинстве случаев из-за пролиферации местных фибробластов-резидентов ЦНС, которые экспрессируют коллаген уже в здоровой ЦНС, что согласуется с данными о повреждениях спинного мозга [10]. Напротив, совсем мало оказалось сведений от отслеживания клеточных линий клонов по пролиферации, индуцированной ЭАЭ. Также оказалось слишком мало доказательств для принятия факта (de novo) синтеза коллагена перицитами, экспрессирующими NG-2 [7], или гладкомышечными муральными клетками, экспрессирующими актин. Дополнительные эксперименты по трансплантации костного мозга подтвердили тот факт, что фиброзные клетки ЦНС происходят из клеток-резидентов ЦНС, а не из фиброцитов костного мозга или других циркулирующих иммунных клеток.
Чтобы изучить молекулярные характеристики клеток, вызывающих фиброз, Dorrier с соавт. провели РНК-секвенирование клеток, экспрессирующих коллаген, в здоровой ткани спинного мозга и после появления симптомов ЭАЭ. Выводы, полученные в ходе этого, соответствовали результатам теста отслеживания клеточной линии клонов. Исследователи обнаружили, что за синтез коллагена, выделяемого в большом количестве при ЭАЭ, отвечают те клетки, которые производят его еще в здоровой ткани, а также экспрессируют классические гены фибробластов. Те же клетки, которые экспрессировали коллаген, также экспрессировали гены, соответствующие пролиферации и повышенной экспрессии других генов внеклеточного матрикса при ЭАЭ. Напротив, менее 2 % синтезировавших коллаген клеток экспрессировали маркеры перицитов или гладкомышечных клеток, что указывает на то, что эти клетки незначительно влияют на фиброзное рубцевание при ЭАЭ.
Чтобы изучить потенциальное влияние фиброзного рубцевания, вызванного воспалением, на симптоматику ЭАЭ и внутриклеточную патологию, Dorrier с соавт. провели эксперимент по потере функции, в котором были удалены пролиферирующие фибробласты с помощью трансгенно нацеленной тимидинкиназы вируса простого герпеса в сочетании с ганцикловиром. Это экспериментальное лечение привело к значительному снижению отложения коллагена в очагах ЭАЭ, но с сохранением коллагена вокруг кровеносных сосудов. Начало проявления двигательных симптомов никак не изменилось, однако на стадии хронизации заболевания наблюдалось значительное уменьшение дегенерации двигательных функций задних конечностей. На клеточном уровне не удалось обнаружить никаких эффектов инфильтрации иммунных клеток, реактивного глиоза или иммунореактивности миелина. Однако исследователи выявили значительное увеличение Olig2-положительных КПО в областях поражения, что позволяет предположить, что фиброз может способствовать ограничению доступа КПО к воспаленной и демиелинизированной нервной паренхиме (рис. 1b). В соответствии с этим представлением эксперименты на клеточных культурах показали, что коллаген не влияет на пролиферацию или дифференцировку КПО, но значительно снижает их способность мигрировать сквозь сосудистую стенку.
Наконец, Dorrier с соавт. представляют доказательства того, что сигнализация посредством интерферона γ (IFN-γ) способствует фиброзному рубцеванию, вызванному инфильтрацией иммунных клеток. Транскриптомный анализ полногеномного РНК-секвенирования фиброзных клеток, экспрессирующих коллаген, после возникновения симптомов ЭАЭ свидетельствует об усилении воспалительных сигнальных путей (повысилась экспрессия рецепторов IFN-γ и индуцированных IFN-γ хемокинов и цитокинов). Селективная делеция рецепторов IFN-γ из фибробластов при ЭАЭ способствует значительному снижению образования фиброзных рубцов (но не до такой степени, как при абляции фибробластов). Тем не менее, самой по себе сверхэкспрессии IFN-γ, направленного на астроциты, во время демиелинизации купризоном было недостаточно для образования фиброзных рубцов. Эти данные свидетельствуют о том, что иммунные клетки взаимодействуют с фибробластами частично посредством сигнализации IFN-γ при фиброзе, вызванном ЭАЭ, но самого по себе IFN-γ недостаточно, чтобы вызвать фиброзное рубцевание.
Выводы Dorrier с соавт. углубляют понимание того, как взаимодействия между резидентными стромальными клетками ЦНС и инфильтрирующими иммунными клетками могут влиять на нарушения в ЦНС. Хорошо известно, что ремиелинизация неэффективна или недостаточна после демиелинизации, вызванной аутоиммунным заболеванием или некоторыми видами травматических повреждений. Механизмы, лежащие в основе этой патологии, включают недостаточную мобилизацию и дифференциацию КПО в демиелинизированных областях [11]. Выводы Dorrier с соавт. свидетельствуют о том, что фиброз, опосредованный фибробластами, в воспаленной нервной паренхиме может препятствовать мобилизации КПО в эти области. Тем не менее, иные недавние исследования предполагают, что фиброз может также влиять на нарушение дифференцировки КПО [12]. Интригующий вопрос: может ли снижение фиброзных процессов положительно повлиять на восстановление тканей и исход после воспаления в ЦНС.
Тем не менее, также важно помнить, что взаимодействия фибробластов с иммунными клетками могут иметь и адаптивный характер. Например, распространение фибробластов и отложение внеклеточного матрикса формирует важный тканевой «каркас», который как облегчает, так и контролирует инфильтрацию иммунных клеток во время образования вторичных лимфоидных фолликулов в ЦНС во время борьбы с вирусными инфекциями [13]. Такие наблюдения в сочетании с выводами Dorrier с соавт. подчеркивают важность более обширных исследований того, как стромальные клетки влияют на воспаление при различных заболеваниях ЦНС. Модуляция фиброза и взаимодействия стромальных клеток с иммунными клетками может задать новые цели терапии как в случае ЦНС, как и в иных жизненно важных органах.
