Физическая нагрузка стимулирует иммунные клетки костного мозга

В костном мозге был обнаружен особый тип предшественников остеоцитов, который, как выяснилось, помогает поддерживать образование иммунных клеток лимфоцитов в ответ на физические упражнения.
В костном мозге по-настоящему тесно от клеток. Бок о бок сосуществует много типов стволовых клеток [1, 2] и клеток-предшественников (например, предшественников иммунокомпетентных клеток). Их жизнедеятельность поддерживается за счет соседей, которые создают специальную защитную среду для стволовых клеток, называемую нишей. Взаимодействие между клетками ниши, также известными как стромальные клетки, и ранними предшественниками иммунных клеток в костном мозге изучено плохо. Понимание того, как координируется это взаимодействие, поможет лучше понять, как образуются предшественники иммунных клеток. В своей статье в «Nature» Shen с соавт. [3] решили часть этой загадки, определив роль физической нагрузки в процессе стимулирования связи между одним типом стромальных клеток и предшественниками иммунокомпетентных клеток у мышей, что в итоге помогло организму животных бороться с инфекцией.
В костном мозге разнообразные типы стволовых клеток и клеток-предшественников тесным образом связаны как физически, так и функционально. К примеру, мезенхимальные стволовые клетки и клетки-предшественники, дающие начало костям, скелетной ткани и жировым клеткам, являются ключевым звеном в стромальной нише для гемопоэтических стволовых клеток и клеток-предшественников гемопоэза (ГСКП). ГКСП, в свою очередь, ответственны за образование всех линий клеток крови, включая иммунные [4]. У мышей некоторые мезенхимальные клетки-предшественники вырабатывают сигнальный белок, называемый фактором стволовых клеток (ФСК), который имеет решающее значение для обеспечения функционирования ГКСП [5]. Эти клетки также экспрессируют поверхностный клеточный белок, называемый рецептором лептина (LepR) [5]. Клетки, экспрессирующие LepR (LepR+), располагаются в нескольких различных местах костного мозга, включая два типа кровеносных сосудов, артериолы и синусоиды. Однако популяция клеток LepR+ представляет собой комбинацию из разных типов мезенхимальных клеток клеток-предшественников [5]. Shen с соавт. в своем исследовании сосредоточились на группе клеток LepR+, способствующих жизнедеятельности ниши ГКСП.
Авторы исследования выполнили анализ экспрессии генов в клетках LepR+, по результатам которого выяснилось, что одна группа клеток также экспрессирует иной маркерный белок — остеолектин (Oln). Ученые вывели линию мышей, у которых эти клетки (Oln+) флуоресцируют, и обнаружили, что стромальные клетки Oln+ располагаются вокруг артериол, а не синусоидов. Затем исследователи показали, что эти клетки являются остеогенными клетками-предшественниками с малой продолжительностью жизни, из которых возникают остеобласты (основные костеобразующие клетки), играющие решающую роль в регенерации костей.
Затем Shen с соавт. вывели генетически мутантных мышей, у которых Oln+ клетки были лишены способности кодировать ФСК. Отсутствие этого фактора у Oln+ клеток в итоге не влияло на гемопоэтические стволовые клетки или большинство иных типов гемопоэтических клеток-предшественников в костном мозге. Тем не менее, это привело к значительному уменьшению численности одного специфического типа гемопоэтических клеток — клеток-предшественников лимфопоэза (КПЛ), из которых развиваются лимфоциты. В поддержку гипотезы о том, что Oln+ клетки способствуют образованию и поддержанию пула КПЛ, авторы исследования продемонстрировали, что Oln+ клетки и КПЛ располагаются близко друг к другу в костном мозге. Затем ученые заразили мутантных мышей болезнетворной бактерией Listeria monocytogenes, от которой обычно организм очищают лимфоциты. Уничтожение патогенов в организме животных-мутантов происходило гораздо менее эффективно, чем у животных из группы контроля. Вследствие снижения численности КПЛ в организме животных не производились в достаточном количестве лимфоциты.
Известно, что механическая стимуляция костей во время выполнения упражнений способствует их формированию [6]. В заключительной серии экспериментов Shen с соавт. поместили мышей в клетки с беговыми колесами и обнаружили, что бег приводит к увеличению количества как Oln+ клеток, так и КПЛ в костном мозге. Ученые выявили экспрессию белка механочувствительного ионного канала Piezo1 клетками Oln+ и обнаружили, что у генетической линии мышей, у которых отсутствует этот белок, количество КПЛ аномально низкое. Таким образом, ученые открыли ранее неизвестный путь, с помощью которого физическая нагрузка, воспринимаемая через механочувствительный белок Piezo1, запускает экспрессию ФСК в клетках-предшественниках остеогенеза для поддержки функционирования КПЛ. В конечном счете, так контролируется часть функций иммунной системы (рис. 1).
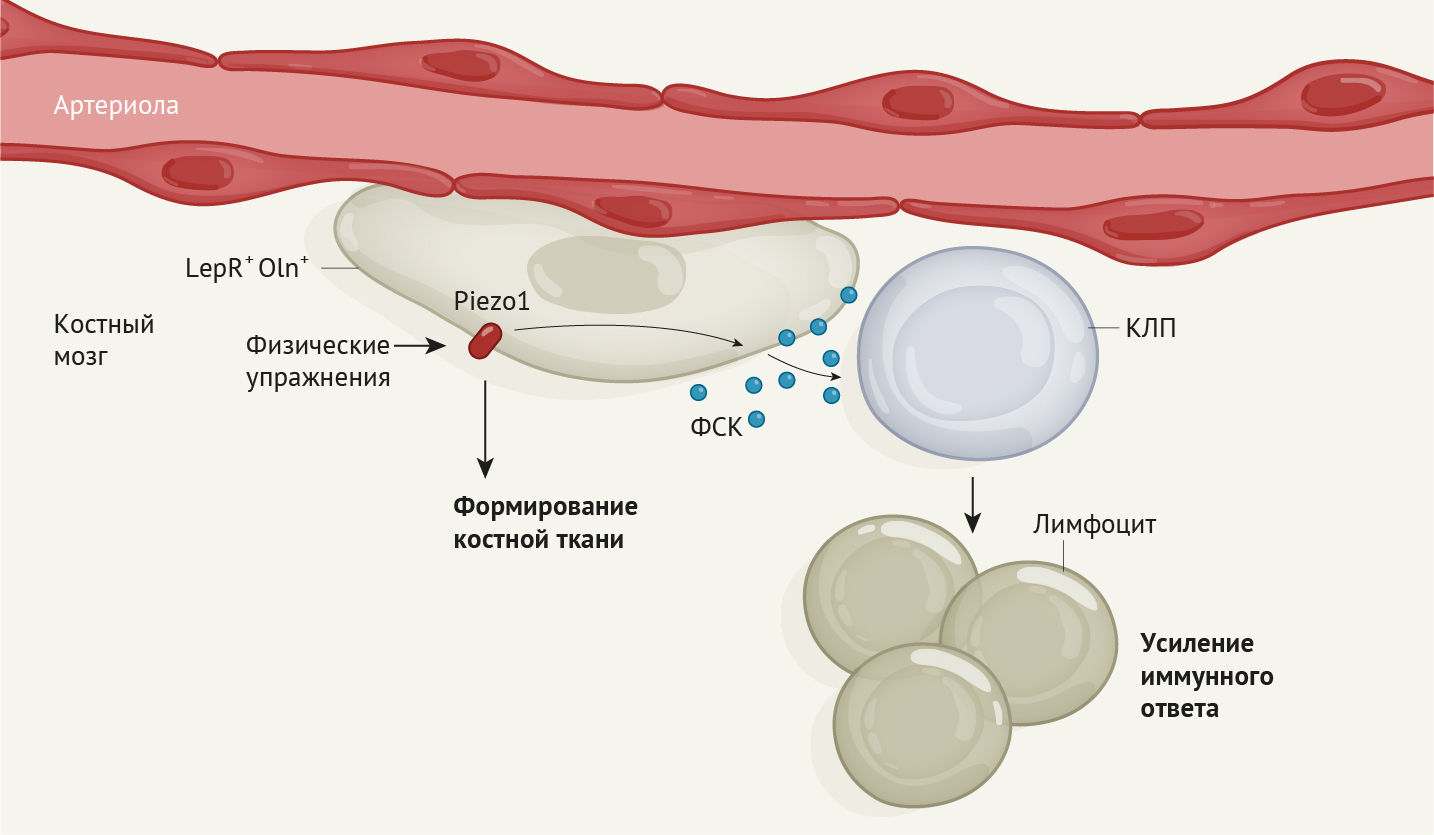
Открытие того, что механочувствительные клетки-предшественники остеогенеза участвуют в борьбе с бактериальными инфекциями, впечатляет. Известно, что физические нагрузки могут стимулировать иммунную систему [7], однако успех работы Shen с соавт. показывает, почему это так. У результатов данной работы есть прямое клиническое применение. К примеру, существование механизма, раскрытого учеными в текущем исследовании, может быть использовано для разработки более эффективных методов усиления иммунного клеточного ответа (его запуск с помощью физических упражнений). Логичным следующим шагом станет проверка, действительно ли бег может улучшить элиминацию бактериальных патогенов у мышей. Еще один ключевой вопрос, который необходимо разрешить, заключается в том, поможет ли увеличение количества Oln+ клеток и КПЛ в костном мозге обеспечить защиту от иных болезнетворных бактерий или даже вирусов, и может ли это усилить ответ на действие вакцинации.
Авторы также обнаружили, что количество ниш Oln+ и количество КПЛ ниже в костном мозге 18-месячных мышей, чем их 2-месячных собратьев. Пожилые животные также активны [8], поэтому на снижение количества ниш и КПЛ, связанное со старением, влияют другие факторы, помимо снижения двигательной активности.
Крайне важно исследовать, к примеру, изменяется ли способ, с помощью которого ниши Oln+ воспринимают механическую стимуляцию с течением времени. Или какие эпигенетические изменения (модификации ДНК, которые могут изменять экспрессию гена без изменения самой последовательности нуклеотидов ДНК) в старых Oln+ клетках способствуют снижению эффективности восприятия механической стимуляции для генерации сигнальных молекул, таких как ФСК.
Хорошо известно, что механочувствительность играет важную роль в физиологии костной ткани, но ключевое значение механических сигналов было также описано для иных типов клеток, например, клеток-предшественников ткани поджелудочной железы, стволовых клеток кишечника и эндотелиальных клеток, образующих выстилку кровеносных сосудов. Хотя о клеточных нишах, которые поддерживают функционирование стволовых клеток вне костного мозга, известно меньше, мелкие сосуды и, следовательно, эндотелиальные клетки являются главными кандидатами на роль структурных элементов таких ниш. Тогда, возможно, что механочувствительность в формирующих ниши эндотелиальных клетках может способствовать поддержанию других типов стволовых клеток и клеток-предшественников. В таком случае работа Shen с соавт. может иметь большое значение для биологии стволовых клеток.
