Эозинофилы используют ДНК-ловушки при аллергической бронхиальной астме

Основные молекулярные и клеточные механизмы астмы остаются не до конца ясны. Согласно результатам нового исследования, эозинофилы выделяют ДНК-ловушки, которые стимулируют опосредованное нейроэндокринными клетками легких усиление реакций при аллергической бронхиальной астме.
Как орган, активно взаимодействующий с окружающей средой, легкие постоянно подвергаются воздействию патогенов, аллергенов и токсинов. Эти факторы способствуют запуску воспалительных иммунных реакций, приводящих к устранению патогенных агентов и восстановлению гомеостаза. Однако невозможность своевременного разрешения воспалительных процессов может привести к таким заболеваниям, как бронхиальная астма. При нем увеличивается приток и активность иммунокомпетентных клеток 2-го типа, таких как тучные клетки, эозинофилы, базофилы и Т-лимфоциты 2-го типа. Эти воспалительные клетки опосредуют ремоделирование тканей, сужение мелких дыхательных путей и увеличение выработки слизи, вызывая затруднение прохождения воздуха и такие классические симптомы, как хрипы [1]. Широко известно, что астма — это сложное заболевание. У пациентов с бронхиальной астмой наблюдаются разнообразные клинические проявления, которые классифицируются на два эндотипа: с высоким содержанием эозинофилов (аллергическая астма 2-го типа) и низким содержанием эозинофилов (неаллергическая бронхиальная астма). Хотя современные методы лечения астмы включают кортикостероиды в качестве средства контроля воспаления, препараты нейтрализации цитокинов 2-го типа и бронходилататоры для расслабления дыхательных путей, более глубокое понимание природы воспалительных соединений и типов эффекторных клеток, которые провоцируют развитие астмы, может способствовать изменению подхода индивидуализированной терапии для пациентов, особенно для тех, которые которые не реагируют на методы лечения, применяемые в настоящее время [1]. В этом выпуске Nature Cell Biology Лу с соавт. [2] предоставляют доказательства того, что внеклеточные ДНК-ловушки эозинофилов усугубляют течение аллергической бронхиальной астмы и могут служить новой мишенью для лечения.
Эозинофилы — это гранулярные лейкоциты, которые участвуют в защите организма от паразитических гельминтов, бактерий и вирусов. Эозинофилы также задействованы в иммунных реакциях 2-го типа, а их проникновение в легкие является ключевым признаком аллергической бронхиальной астмы [1]. У мышей, у которых эозинофилы отсутствуют, после воздействия аллергенов наблюдается снижение гиперактивности дыхательных путей и метаплазия бокаловидных клеток, что демонстрирует роль этих иммунокомпетентных клеток в патофизиологии заболевания (т. е. астмы) [3, 4]. Введение антител, подавляющих эозинофилы, улучшало состояние здоровья у некоторых пациентов с астмой, что указывает на клиническую значимость лекарственного воздействия на эти клетки [5]. Механизмы, посредством которых эозинофилы вызывают хронизацию заболевания, включают производство гранулярных белков и липидных медиаторов, которые обеспечивают сокращение гладкомышечных клеток, повышенную проницаемость сосудов и выработку цитокинов для усиления инфильтрации иммунокомпетентных клеток [5]. В ходе хорошо изученного процесса, называемого нетозом, происходит выход ДНК из нейтрофилов [6], однако не известно, присуще ли такое явление другим гранулоцитам, таким как эозинофилы. Выход ДНК из нейтрофилов приводит к образованию молекулярных ловушек, усеянных гранулоцитарными и другими антимикробными молекулами для элиминации патогенов во внеклеточном пространстве. С точки зрения эволюционной консервативности, подобный выход ДНК из эозинофилов в результате цитолиза в условиях присутствия крупных внеклеточных патогенов — таких как, например, гельминты, — которые не могут быть легко фагоцитированы, может служить альтернативным способом сдерживания распространения последних и ускорения их уничтожения. В недавнем исследовании было продемонстрировано, что образование внеклеточных эозинофильных ловушек (ВЭЛ) снижает подвижность микрофилярий у мышей [7]. Однако эта адаптация может стать палкой о двух концах в случае использования ее против неинфекционных факторов, таких как аллергены. Сходство между исходами паразитарных инфекций и аллергических заболеваний, такими как повреждение структуры легочной ткани, высвобождение аларминов (таких как тимический стромальный лимфопоэтин), и секреция цитокинов 2-го типа (например, интерлейкина-5), способствующее привлечению эозинофилов, поднимает важные вопросы о мимикрии молекул паразитарного происхождения и химической структуры аллергенов, а также о запуске активации иммунных клеток и характере наносимых повреждений.
В своей новой работе Лу с соавт. [2] сообщают об обнаружении сетчатых структур ДНК, которые присутствуют вместе с катионным белком эозинофилов в образцах бронхоальвеолярного лаважа человека. Наличие этих внеклеточных эозинофильных ловушек (ВЭЛ) положительно коррелировало с тяжестью астмы. Используя модельный экспериментальный аллерген овальбумин (OVA), а также значимые для клинической практики антигены, такие как домашние пылевые клещи, авторы выявили ВЭЛ у мышей после воздействия аллергена.
В составе этих ВЭЛ были ядерная и митохондриальная ДНК с белками эозинофилов. Воздействие фермента ДНКазы после сенсибилизации к OVA и перед повторным введением OVA снижало тяжесть астмы, что подтвердилось уменьшением инфильтрации иммунокомпетентных клеток и падением продукции воспалительных цитокинов. Человеческая рекомбинантная ДНКаза в форме аэрозоля в клинических условиях у пациентов с бронхиальной астмой использовалась в качестве муколитического средства, в результате чего было достигнуто улучшение состояния у некоторых (но не у всех) пациентов [8, 9]. Эти данные говорят о том, что эффективность ДНКазы при лечении астмы индивидуально обусловлена, и подчеркивают необходимость дальнейших исследований.
Нейтрофилам для образования ДНК-ловушек необходим фермент пептидиларгининдеиминаза 4 (PAD4), который усиливает нетоз за счет деконденсации ДНК, модифицируя гистоны путем цитруллинирования [6, 10, 11]. Авторы обнаружили, что ингибирование фермента PAD4 в эозинофилах человека in vitro снижает цитруллинирование гистонов и образование ВЭЛ [2]. В условиях in vivo воздействие нескольких аллергенов на мышей, у которых фермент PAD4 отсутствовал, приводило к снижению образования ВЭЛ в образцах жидкости бронхоальвеолярного лаважа и уменьшению продукции воспалительных цитокинов и слизи. Данное состояние можно устранить путем адоптивного переноса эозинофилов (но не нейтрофилов) дикого типа мышам с отсутствием PAD4; это указывает на то, что обострение заболевания зависит от эозинофилов.
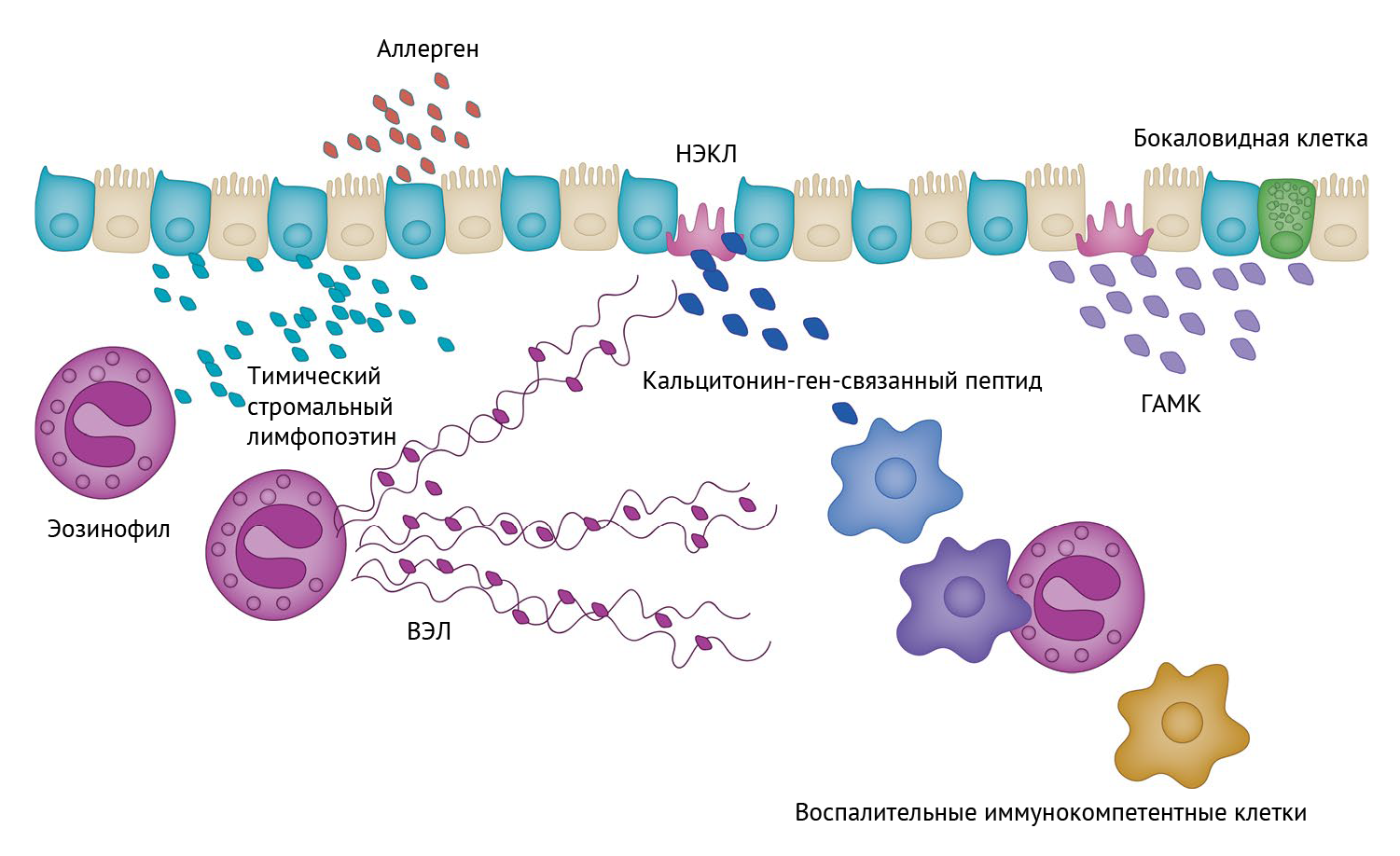
Примечательно, что у мышей, дефицитных по PAD4, также выявляется снижение экспрессии нейропептидов нейроэндокринными клетками легких (НЭКЛ). НЭКЛ — это в целом немногочисленные эпителиальные клетки дыхательных путей, которыми обогащены области разветвления бронхиального дерева, и которые служат своеобразными датчиками атак аллергенов [12, 13]. Они реагируют на аллергены продукцией нейропептидов, таких как кальцитонин-ген-связанный пептид (CGRP), для активации нативных лимфоцитов 2-го типа и нейромедиаторов — таких как ГАМК (γ-аминомасляная кислота), необходимых для выработки слизи [14] (рис. 1). Дефицит НЭКЛ приводит к выраженному уменьшению тяжести течения астмы, проявляющемуся в виде ослабления притока иммунных клеток, включая и эозинофилы; это указывает на то, что регуляция выброса последних предшествует иммунной инфильтрации. Мыши с дефицитом PAD4 характеризуются сниженным количеством НЭКЛ, что предполагает наличие потенциальной петли положительной обратной связи, в которой НЭКЛ-зависимое привлечение эозинофилов приводит к усилению активности НЭКЛ с помощью ВЭЛ. В качестве потенциального маркера детекции ВЭЛ НЭКЛ авторы предложили CCDC25 — рецептор окисленной ДНК. Точную роль CCDC25 в НЭКЛ только предстоит выяснить в дальнейшем (используя мышиные модели специфичного для НЭКЛ дефицита рецептора CCDC25). Дополнительные исследования требуются для определения механизмов, запускающих образование ВЭЛ и опосредованную ими активацию НЭКЛ. Другой вопрос, на который также нет ответа, заключается в том, подвергаются ли эозинофилы клеточной гибели в процессе образования ВЭЛ. Согласно полученным ранее данным, выход ДНК из нейтрофилов делает часть из этих клеток нежизнеспособными, в то время как другие выживают [6].
Исследования, посвященные чрезмерно активным иммунным реакциям на раздражители из окружающей среды и аллергены, выведут на новый уровень понимание процессов активации иммунных клеток и механизмов, посредством которых патология приобретает характер хронической. Данное исследование дополняет все возрастающий объем работ, посвященных выявлению патологических свойств эозинофилов и их влиянию на иммунокомпетентные и другие типы клеток. У пациентов с бронхиальной астмой эозинофилы ответственны за образование кристаллов Шарко — Лейдена (КШЛ), состоящих из белка галектина-10 [15]. Образование КШЛ у мышей приводит к развитию гиперреактивности дыхательных путей и секреции воспалительных цитокинов [15]. Примечательно, что в образцах биоптатов из слизистой оболочки носа пациентов КШЛ выявлялись в непосредственной близости от эозинофильных ловушек. Находки подобного рода поднимают интересный вопрос о том, как регулируется дегрануляция эозинофилов — или, скорее, в чем суть нарушений такой регуляции в условиях болезни. Выводы Лу с соавт. [2] подчеркивают необходимость дальнейшего изучения биологии клеток врожденного иммунитета — в частности, особенностей биологии гранулоцитов.
