Прямое связывание с рецепторами нейротрофина TRKB — один из механизмов действия антидепрессантов
Прямое связывание как классических, так и быстродействующих антидепрессантов (к классическим антидепрессантам относят трициклические антидепрессанты, ингибиторы МАО, СИОЗС, ингибиторы обратного захвата серотонина и норадреналина, к атипичным — миртазапин, бупропион, тразодон и т.д. - прим. перев.) с TRKB — рецептором нейротропного фактора мозга BDNF — свидетельствует об эффектах воздействия этих препаратов на уровне и клеточной биологии, и поведения. Данный механизм напрямую связан с влиянием антидепрессантов на нейрональную пластичность и может служить объяснением медленного действия классических антидепрессантов.
Ключевые моменты
- Некоторые антидепрессанты, включая СИОЗС и кетамин, напрямую связываются с TRKB.
- Димеризация TRKB в трансмембранных областях формирует участок связывания для флуоксетина.
- Связывание антидепрессантов с TRKB усиливает действие BDNF и пластичность.
- Точечные мутации в трансмембранном домене TRKB блокируют эффекты антидепрессантов.
До сих пор неизвестно, как связывание антидепрессантов с их молекулами-мишенями обеспечивает их лекарственнный эффект. Было обнаружено, что трансмембранный домен тирозинкиназного рецептора 2 типа (TRKB — тропомиозиновый тирозинкиназный рецептор, также называемый тирозинкиназным рецептором B), известный как рецептор нейротропного фактора мозга (BDNF — brain derived neurotrophic factor), обеспечивает нейрональную пластичность и антидепрессантный эффект и обладает функцией чувствительности к холестерину, опосредующему его влияние на синапсы. Помимо этого, ученые выявили, что как классические, так и атипичные антидепрессанты напрямую связываются с TRKB, что благоприятствует его синаптической локализации и активации при взаимодействии с BDNF. Обширные вычислительные методы, включая моделирование атомной и молекулярной динамики, помогли обнаружить сайт связывания в трансмембранных доменах димеров TRKB. Мутация участка связывания TRKB с антидепрессантом приводила к нарушению клеточных и поведенческих ответных реакций, а также формирования пластичности in vitro и in vivo. Авторы исследования полагают, что связывание с TRKB и аллостерическое облегчение передачи сигнала BDNF является общим механизмом антидепрессантного действия, который может объяснить, почему действие классических антидепрессантов развивается медленно, и как молекулярные эффекты антидепрессантов клинически выражаются в нормализации эмоционального фона.
Для антидепрессантных препаратов (АДП) определено несколько молекулярных мишеней, однако не вполне ясно, как связывание с этими мишенями выражается в клиническом эффекте. Классические АДП, такие как трициклические АДП (ТЦАДП), селективные ингибиторы обратного захвата серотонина (СИОЗС) и ингибиоторы моноаминооксидаз (ИМАО), повышают концетрации моноаминов в синаптической щели, ингибируя их обратный захват или метаболизм, однако неясно, почему клинические эффекты этих препаратов так отсрочены во времени, при том что эффект самих моноаминов развивается стремительно [1]. Быстрый антидепрессантный эффект кетамина связывают с ингибированием глутаматных NMDA-рецепторов [2]. Однако у метаболита кетамина с антидепрессантоподобным действием — 2R,6R-гидроксиноркетамина (R,R-HNK) — обнаружено низкое сродство к NMDA-рецепторам, что ставит под вопрос роль этого типа рецепторов в развитии эффекта кетамина [3]. По сути, все АДП, включая кетамин и R,R-HNK, повышают степень экспрессии и усиливают сигнальный путь нейротропного фактора мозга (BDNF) с помощью нейротропного тирозинкиназного рецептора 2 типа (TRKB) [4]. Cчитается, что эффекты СИОЗС и кетамина на BDNF-сигналинг опосредованы и осуществляются путем ингибирования транспортера серотонина (5HTT) и NMDA-рецепторов соответственно. BDNF имитирует эффекты АДП у грызунов, а ингибирование сигнального пути TRKB нивелирует поведенческие эффекты этих препаратов [5]. Активация TRKB — ключевой посредник для зависящей от активности синаптической пластичности [6], а индуцированный антидепрессантами TRKB-сигналинг восстанавливает у взрослого нейрональную пластичность, характерную для молодого организма.Предполагают, что это лежит в основе влияния АДП на настроение [7].
Cвязь между сигнальным путем TRKB и метаболизмом холестерина в ткани мозга является двусторонней. Так, BDNF способствует выработке холестерина в нейронах [8], а холестерин регулирует TRKB-сигналинг [9]. Холестерин необходим для созревания нейронов и правильной синаптической передачи [10], однако он не проходит гематоэнцефалический барьер и, таким образом, нейроны зависят от холестерина, вырабатываемого астроцитами и транспортируемого при помощи механизма с участием белка ApoE [11]. Концентрация холестерина в синаптической щели низкая в эмбриогенезе и раннем постнатальном периоде, однако у мышей она быстро повышается в течение третьей недели от момента рождения [9,12], что совпадает с услением экспрессии BDNF и возникновением эффекта АДП на TRKB [13]. Многие АДП взаимодействуют с фосфолипидами и накапливаются в богатых холестерином мембранных доменах, таких как липидные рафты [14].
Эти сведения побудили ученых исследовать возможные варианты взаимодействия между TRKB, холестерином и АДП. Было обнаружено, что трансмембранный домен (ТМД) TRKB воспринимает изменения концентрации холестерина в клеточной мембране, и авторы подробно рассмотрели данный механизм. Кроме того, исследователи обнаружили, что различные АДП напрямую связываются с участком, образованным димером трансмембранных доменов TRKB. Благодаря этому повышается концентрация TRKB на поверхности клетки и усиливается сигнальный путь BDNF. На основе полученных данных предполагают, что прямое связывание с TRKB и повышение пластичности, опосредованной BDNF, и является механизмом действия АДП.
Связывание антидепрессантов с TRKB
Сигнальный путь BDNF является ключевой мишенью действия всех АДП [14], однако, как полагают, такое воздействие опосредовано иными белками, такими как серотониновые или NMDA-рецепторы. В данном исследовании показано, что АДП связываются с ТМД димеров TRKB с терапевтически релевантной аффинностью [15], что приводит к стабилизации пространственной конформации трансмембранных димеров TRKB, благоприятствующей передаче сигнала. Это, в свою очередь, способствует транслокации TRKB к плазматической мембране и его удержанию в ней, где рецептор становится доступным для BDNF. Специфическое связывание было показано не только для флуоксетина и имипрамина, представляющих собой типичные СИОЗС и TЦАДП соответственно, но также и для быстродействующего метаболита кетамина — R,R-HNK. Связывание меченого флуоксетина замещалось самим флуоксетином и имипрамином, моклобемидом, RR-HNK, кетамином и эскетамином, вследствие чего можно предположить, что эти препараты взаимодействуют с по крайней мере частично перекрывающимися участками. Полученные данные говорят о том, что прямое взаимодействие с ТМД димера TRKB может указывать на сайт связывания для нескольких различных, если не всех, АДП.
С помощью метода моделирования молекулярной динамики (МД) удалось идентифицировать участок связывания для флуоксетина на внешней стороне перекрещенной части димера трансмембранного домена TRKB. Экспериментальная индукция ряда мутаций, предсказанных и проверенных с помощью МД, подтверждает наличие данного сайта связывания. Исходя из сведений, полученных авторами, можно предполагать, что в плотных, богатых холестерином, мембранах, обычно встречающихся в участках синапсов и липидных рафтов, димеры ТМД TRKB расположены почти параллельно, предположительно — нестабильно. Это приводит к исключению TRKB из синаптических мембран и ограничивает синаптическую передачу сигнала от TRKB [9]. Связывание флуоксетина с участком, образованным перекрещенными ТМД, работает как клин, поддерживая более стабильную структуру в синаптических мембранах и тем самым аллостерически облегчая сигнальный путь BDNF в синапсах. С помощью моделирования удалось предсказать, что в связывании флуоксетина с TRKB участвуют и липиды мембран. Поскольку TRKB существует в виде мультибелкового комплекса, в состав которого входят трансмембранные белки [16], возможно, что в связывании АДП с TRKB у разных типов клеток и в различных субклеточных компартментах участвуют и другие белки и липиды. Более полная характеристика этого сайта связывания может дать важную информацию для открытия новых АДП с повышенной эффективностью относительно аспектов поведения, связанных с нейропластичностью.
В течение десятилетий было известно, что клинический ответ на классические АДП достигается только через несколько дней или недель лечения, но причина такой задержки остается загадкой. Одно из объяснений заключается в том, что для развития нейрональной пластичности, вызванной АДП, требуется время. Однако открытие быстрого действия кетамина, также основанного на пластичности, опровергло эту гипотезу. Флуоксетин и имипрамин связываются с 5HTT гораздо сильнее, чем с TRKB, в то время как сродство кетамина к TRKB сравнимо с его сродством к NMDA-рецепторам [17]. Примечательно, что концентрации классических АДП в мозге быстро достигают микромолярных значений в ходе хронического лечения, как было выявлено у людей на примере с флуоксетином [18], флувоксамином [15] и пароксетином [19] и в данном исследовании — для флуоксетина у мышей. Важно отметить, что классические АДП постепенно накапливаются в головном мозге, достигая концентрации плато после нескольких недель лечения [20]. Это позволяет предположить, что клинический ответ достигается только тогда, когда концентрация препарата в мозге становится достаточно высокой, чтобы провзаимодействовать с мишенью связывания, обладающей таким низким аффинитетом, как TRKB. Достаточные концентрации не могут быть достигнуты у пациентов с быстрым метаболизмом или у пациентов, недостаточно соблюдающих режим терапии. Это может привести к полному отсутствию клинического эффекта лечения. С другой стороны, кетамин легко проникает в мозг, и его концентрация в синапсах быстро достигает достаточных значений. Следовательно, постепенное увеличение концентрации препарата в мозге до уровня, необходимого для связывания с TRKB, может являться, по крайней мере, одним из объяснений того, почему классическим АДП требуется так много времени, чтобы начать действовать, в то время как быстрое проникновение в мозг кетамина обеспечивает его быстрый эффект. Тем не менее, маловероятно, что воздействие на TRKB опосредует все эффекты АДП, и что ингибирование рецепторов 5HTT и NMDA также имеет значение [21].
Вследствие влияния TRKB на выживаемость и пластичность нейронов ведется активный поиск низкомолекулярных агонистов TRKB [22]. Данные исследователей говорят о том, что АДП связываются с TRKB и аллостерически усиливают сигнальный путь BDNF, тем самым поддерживая т. н. «зависимость от использования», которая избирательно ограничивает действие TRKB активными синапсами, выделяющими BDNF. При этом можно избежать нежелательной стабилизации неактивных синапсов, что может происходить в случае полных агонистов TRKB. Такое действие АДП как «умных лекарств» согласуется с широким применением этих препаратов при многих неврологических и психических расстройствах помимо депрессии [23].
Взаимодействие TRKB и холестерина
Астроцитарный холестерин считается важным регулятором созревания нейронов и нейрональной пластичности [24], однако механизмы, которые вызывают эти эффекты, остаются неясными. В данном исследовании авторы продемонстрировали, что у ТМД TRKB существует домен CARC [25], а холестерин усиливает эффекты BDNF по отношению к TRKB-сигналингу. Холестерин регулирует сигнальный путь BDNF [9, 26], а BDNF, в свою очередь, способствует синтезу холестерина в нейронах [27]. Мембраны синапсов богаты холестерином, и этой характеристикой напоминают липидные рафты [28]. TRKB обычно расположен вне рафтов, но способен время от времени перемещаться в них под воздействием BDNF-стимуляции [9, 29]. Такая транслокация может быть связана с потоками TRKB к дендритным шипикам и его кластеризацией на плазматической мембране (в случае, когда обе эти структуры стимулируются посредством BDNF и АДП). Пребывание TRKB в липидных рафтах недолговечно [9], что может быть объяснено данными, полученными в ходе моделирования, предполагающими нестабильность крестообразной структуры ТМД TRKB в толстых, мембранах, богатых холестерином. Транслокация TRKB в липидные рафты зависит от FYN-киназы [9], и ученые отмечают, что BDNF усиливает взаимодействие FYN-киназы с TRKB дикого типа, а не с мутантными клетками TRKB.Y433F. Полученные данные предполагают сценарий, при котором взаимодействие между TRKB и BDNF или АДП способствует удержанию его в богатых холестерином мембранах синапсов.
Очевидно, что пространственная конфигурация ТМД — не единственная детерминанта сигнальной способности TRKB; тем не менее, открытия авторов исследования являются важным шагом в понимании взаимодействия TRKB с клеточными мембранами.
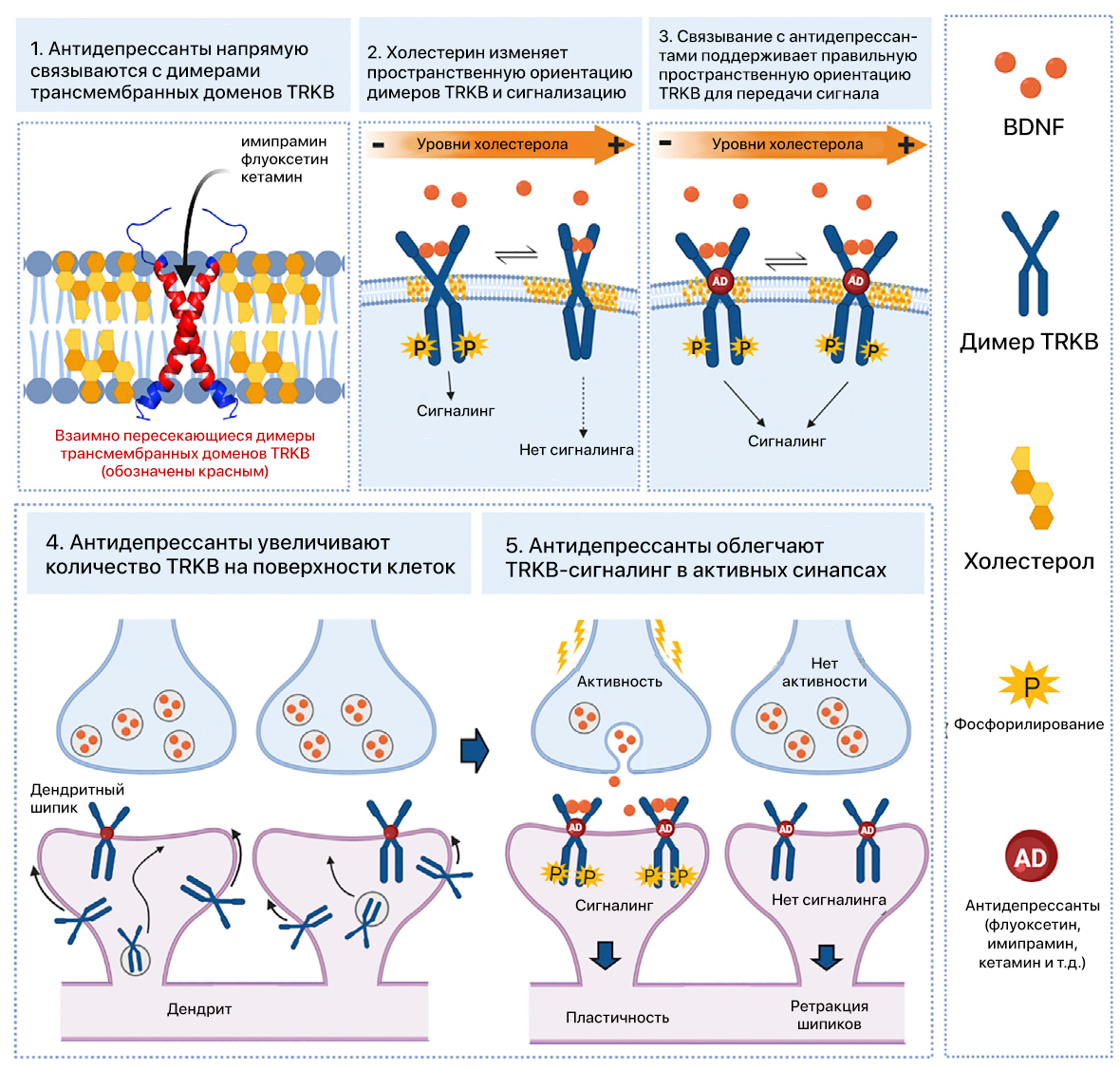
Рисунок 1. Графическое резюме.
TRKB, по-видимому, — единственный член семейства рецепторов нейротрофина TRK, чувствительный к холестерину. Хотя для представителей этого семейства характерна высокая гомология, TMД у TRKB отличается от такового у TRKA и TRKC, которые, в отличие от TRKB, выступают в качестве рецепторов зависимости, индуцирующих гибель клеток в отсутствие лиганда [30]; по-видимому, это свойство зависит от трансмембранного домена [31]. Опираясь на результаты исследователей, можно считать, что TRKB в ходе эволюции стал сенсором холестерина, что может быть важно для его функционирования в качестве медиатора пластичности, зависимой от активности.
Выводы, полученные в ходе данной работы, позволяют судить о том, что АДП связываются с TRKB и аллостерически усиливают BDNF-сигналинг. Таким образом, была выявлена прямая связь между эффектами АДП и нейрональной пластичностью. Сведения, полученные учеными, предлагают создать теоретическую основу, связывающую эффекты всех АДП с соответствующими терапевтическими рекомендациями для достижения клинического ответа на конкретный препарат.
