PHF7 управляет ремоделированием миокарда

Для повышения эффективности процессов ремоделирования миокарда после эпизодов ишемического повреждения необходимо справиться с препятствиями в сфере эпигенетики. Согласно одному новому исследованию, считыватель гистонового кода PHF7 усиливает ремоделирование сердечной мышцы за счет вовлечения в процесс комплекса SWI/SNF (ремоделятор хроматина) и ключевых факторов транскрипции для супер-энхансеров миокарда.
Определение оптимальных потенциальных факторов воздействия на клетки рубцовой ткани (не способной к сокращению) для непосредственного преобразования их в рабочие кардиомиоциты может способствовать формированию новой терапевтической парадигмы для миллионов пациентов с сердечной недостаточностью по всему миру. В соответствии с этой целью в текущем выпуске «Nature Cell Biology» Garry с соавт. определили центральную роль PHF7 в синергизме факторов транскрипции репрограммирования миокарда (ФТ) и факторов ремоделирования хроматина для достижения точного контроля регуляции экспрессии генов в миокарде, а также последующего преобразования фибробластов в кардиомиоцитоподобные клетки [1] (рис. 1, верхний ряд). Работа открывает новые горизонты, раскрывая ключевой молекулярный путь, управляющий прямым репрограммированием миокардиального синцития.
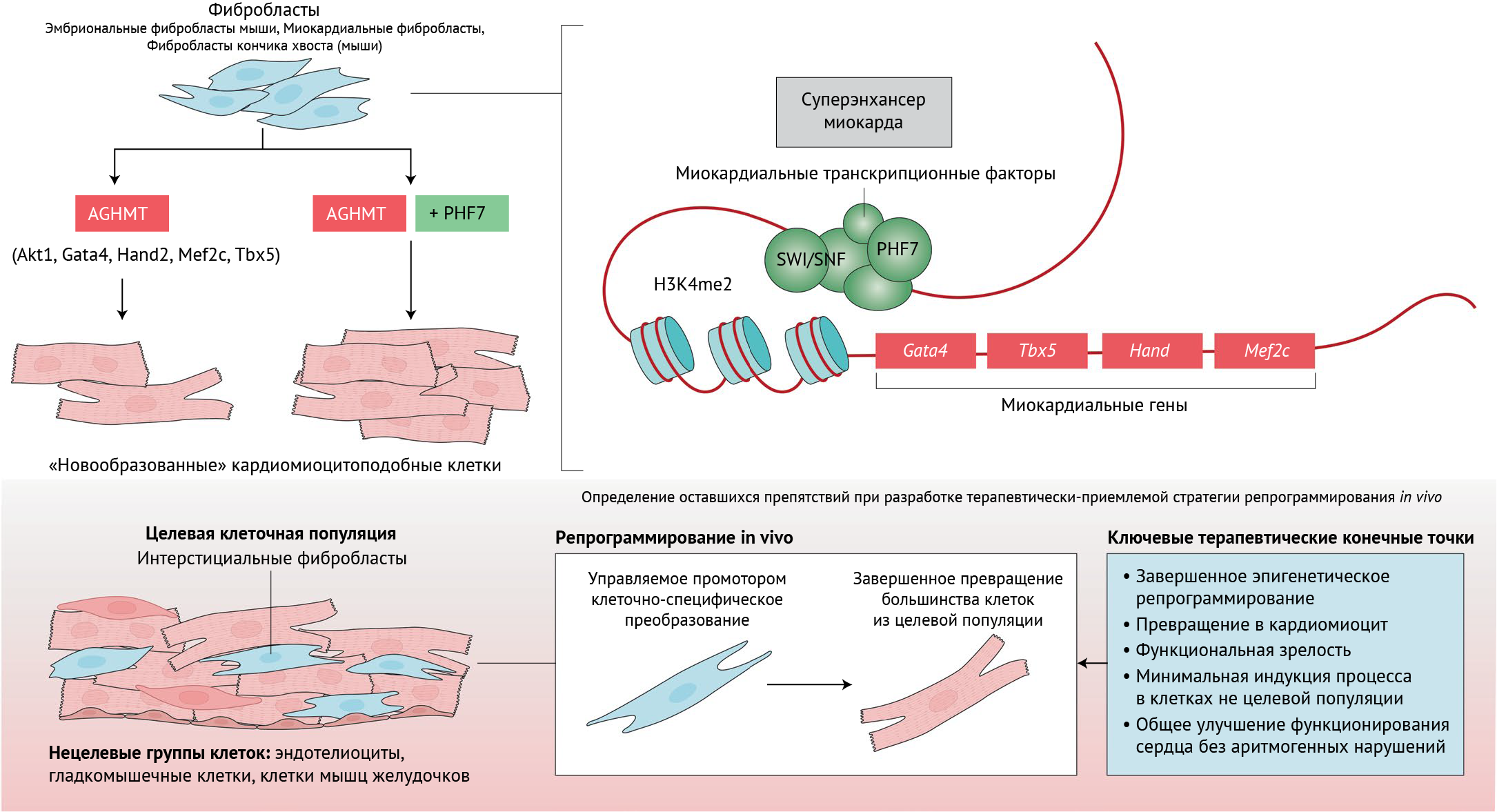
Прямое ремоделирование миокарда было впервые описано в результате выдающихся открытий ученых из лаборатории Шриваставы, документально подтвердивших, что благодаря принудительной экспрессии трех ФТ — Gata4, Mef2c и Tbx5 (GMT) — удалось осуществить трансдифференцировку фибробластов в кардиомиоцитоподобные клетки миокарда. Hand2 (Heart- and neural crest derivatives-expressed protein 2 — белок, выделенный из рубцов миокардиального и неврального происхождения 2 типа) и Akt1 (RAC-alpha serine/threonine-protein kinase, Protein kinase B alpha — альфа-протеинкиназа В), вместе называемые AGHMT, позже были добавлены в эксперимент для усиления репрограммирования. С тех пор продолжаются попытки выявления активаторов и непосредственных препятствий для этого многообещающего процесса, определенного ныне как «неэффективный». Как известно, эпигенетические изменения сопутствуют дифференцировке кардиомиоцитов и прямому репрогроммированию клеток. До сих пор не были обнаружены ключевые эпигенетические регуляторы, которые опосредуют данные изменения. В своем предыдущем исследовании по выявлению ФТ и эпигенетических регуляторов, стимулирующих индуцированное AGHMT репрограммирование миокарда, авторы определили PHF7, белок-считыватель гистонового кода, который ранее изучался как один из мощных активаторов сперматогенеза. Затем ученые установили, что PHF7 усиливает трансдифференцировку различных фибробластов, экспрессирующих AGHMТ, таких как эмбриональные мышиные фибробласты (ЭМФ), фибробласты кончика хвоста (ФКХ) и сердечные фибробласты взрослого человека, в кардиомиоцитоподобные клетки (iCLM). Добавление PHF7 к AGHMT привело к десятикратному увеличению числа iCLM по сравнению с таковым без PHF7, что выразилось в образовании ~ 20 % iCLM в экспериментальной популяции. Улучшение репрограммирования было в дальнейшем подтверждено посредством стандартных молекулярных и функциональных проб, таких как анализ кальциевого обмена, автоматического сокращения и функции структур саркомера. Также добавление PHF7 привело к значительному увеличению скорости и степени фенотипических преобразований. В исследовании применялись молекулярные анализы для демонстрации специфичной для сердца субъединицы комплекса SWI/SNF — SMARCD3 в качестве компонента связывания PHF. В точном перечне экспериментов по усилению и потере функции авторам удалось показать, что SMARCD3 оказалось недостаточно для увеличения обеспечиваемой AGHMT эффективности репрограммирования в отсутствие PHF7. Отключение SMARCD3, тем не менее, приводило к снижению повышенной эффективности репрограммирования, вызванной усиленной экспрессией PHF7. Это указывает на большую зависимость между считывателем гистонового кода и ремоделятором хроматина в управлении репрограммирования, опосредованного ФТ.
Хотя PHF7 — хорошо известный считыватель, распознающий гистон H3K4me2 mark [5], было показано, что его домен RING-finger опосредует убиквитинилирование гистона H2A, что указывает на то, что PHF7 является не только считывателем эпигенетического кода, но может и вносить в него свои «коррективы» [6]. Вероятно, что зависимое от PHF7 убиквитинилирование H2A является этапом репрограммирования миокарда, что требует дальнейших исследований. Более того, еще предстоит определить, повлияет ли добавление PHF7 на репрограммирование миокардиальных фибробластов in vivo.
Репрограммирование in vivo осуществлялось во многих органах в различных условиях, обычно проводилась усиленная экспрессия ключевых регуляторов этого процесса, специфичных для той или иной клеточной линии, или же введение малых молекул для повышения пластичности и облегчения клеточной конверсии [7]. Что касается эпигенома, стратегии репрограммирования часто основывались на глобальной эпигенетической модуляции с использованием ингибиторов гистондеацетилазы (ГДАЦ), таких как вальпроевая кислота или бутират натрия, однако эти методы явно игнорируют специфичность последовательности, и их физиологическое влияние часто может быть омрачено другими аспектами всеобщего гипометилирования [8]. Хотя описано несколько дополнительных факторов для увеличения эффективности репрограммирования [7], PHF7 явно является одним из самых сильных активаторов репрограммирования миокарда [1, 4].
Garry с соавт. показывают, что в отличие от ингибиторов ГДАЦ и других малых молекул, которые действуют по неспецифическому пути (разрушение хроматина), PHF7 — точный эпигенетический регулятор, локализация которого ограничена суперэнхансерными комплексами в миокарде, будучи связанным с H3K4me2, где он взаимодействует с кардиоспецифическим ремоделятором хроматина для увеличения доступности хроматина, тем самым запуская транскрипционный механизм в миокарде (рис. 1, верхний ряд) [1].
На сегодняшний день большая часть попыток репрограммирования in vivo направлена на активацию эндогенных путей развития для обновления или замещения поврежденных популяций клеток. В отличие от млекопитающих, некоторые виды земноводных сохраняют способность к регенерации на протяжении всей жизни и изучаются в качестве модельных организмов вследствие своей врожденной способности восстанавливать утраченные конечности и восстанавливать сильно поврежденные органы, включая сердце [9]. Дедифференцировка и трансдифференцировка являются процессами, связанными с естественной регенерацией [9]. Это поднимает вопрос об опосредовании подобным набором естественных эпигенетических механизмов преобразования клонов клеток не мышечной природы в рабочие, способные к сокращениям мышечные клетки. Таким образом, эти животные модели предоставляют неоценимые сведения о требованиях к окружающей среде и клеточной биологии, необходимых для восстановления поврежденных взрослых тканей in vivo, поскольку лишь выработка интересующих типов клеток в месте повреждения может оказаться недостаточной. Комплексный транскриптомный анализ, произведенный на примере одной клетки и призванный тщательно отслеживать регенерацию сердца у земноводных, может выявить уникальные гены, различные эпигенетические профили и иные типы клеток, которые могут оказаться ключевыми для выработки эффективных стратегий регенерации для лечения сердечной недостаточности. Также будет важно исследовать на примере земноводных, помогают ли белки, подобные PHF7, запускать и облегчать тканеспецифическую регенерацию, используя эпигенетические модификаторы для прямого точного восстановления.
Вопрос о том, является ли прямое репрограммирование сердца клинически управляемым методом восстановления сердечной мышцы, остается открытым. Терапевтические методы in vivo по замещению места повреждения регенеративными клетками в основном следовали двум стратегиям: использование резидентных для данной ткани клеток, которые способны либо дедифференцироваться, либо трансдифференцироваться, и использование экзогенных клеток для восстановления клеточных популяций поврежденных ниш [10]. Последнее было достигнуто в доклинических испытаниях путем дифференциации плюрипотентных стволовых клеток в ряд физиологически схожих типов клеток с высоким терапевтическим потенциалом [11]. Хотя эти усилия успешно преобразуют фенотип клеток in vivo для части целевой группы клеток, в этой области все еще отсутствуют строгие критерии молекулярной оценки, чтобы отличать неполное репрограммирование и ложные (побочные) трансформации, приводящие к нефизиологической экспрессии генов и вызывающие обоснованные опасения по поводу безопасности [7] (рис. 1, нижний ряд). Чтобы решить этот вопрос, следует использовать высокопроизводительные методы биомики на материале одной клетки для оценки эффективности репрограммирования и нецелевых конверсий как in vitro, так и in vivo. В контексте регенерации миокарда серьезные побочные эффекты в виде потенциально летальных аритмий наблюдались у нечеловекообразных обезьян, которым трансплантировали кардиомиоциты, полученные из эмбриональных стволовых клеток человека по причине незрелых фенотипически собственных клеток миокарда [12]. Нарушение регуляции многочисленных генов мокардиальных ионных каналов в различных типах сердечных и иных клеток может привести к сложным электрофизиологическим нарушениям. Успешное репрограммирование сердца in vivo требует специфического воздействия на интерстициальные фибробласты с минимальной степенью вмешательства в нормальные функции других типов резидуальных клеток, таких как эндотелиоциты, гладкомышечные клетки и клетки мышцы желудочков (рис. 1, нижний ряд). Недавние успехи по достижению тканеспецифической экспрессии посредством генетического проектирования белков капсида аденоассоциированного вируса являются многообещающими в этом отношении [13]. Наконец, новые системы доставки кардиологических устройств in vivo будут неоценимы для облегчения клинической реализации и уже скоро появятся. Недавние достижения в использовании введения мРНК для повышения экспрессии белка в мышечной ткани во всем организме и в сердце, в частности, могут оказаться особенно полезными [14].
Научно обоснованные подходы к регенерации сердца, о которых сообщается в текущих и более ранних исследованиях, являются многообещающими для пациентов с тяжелой сердечной недостаточностью, ожидающих трансплантации сердца. Существует надежда, что открытие ключевых молекулярных механизмов регенерации сердца и разработка новых технологий для улучшения приемлемости применения, доставки препаратов и устройств, безопасности и эффективности приведут к их использованию в клинических испытаниях. Такие научные работы, как исследование Garry с соавт. [1], в конечном итоге укажут на претендентов на звание «лучшего дирижера» сложного оркестра под названием «регенерация миокарда».
