MeCP2 и механизмы долговременного действия антидепрессантов

Применение кетамина, способного быстро облегчать симптомы, преобразило лечение депрессии (назальный спрей «Справато» [эскетамин] был одобрен FDA США в 2019 году с рядом ограничений в использовании. В большинстве стран, включая РФ, он по-прежнему не доступен для применения — прим. перев.). Однако механизмы, лежащие в основе долгосрочного действия данного препарата, до сих пор мало изучены.
В недавно опубликованной работе Ким с соавторами показали, что для этого необходима активация сигнального пути MeCP2 в гиппокампе.
Открытие, сделанное два десятилетия назад, — что кетамин обладает антидепрессивным действием [1, 2], — и разрешение FDA применять его при лечении резистентных депрессий стали переломным моментом в истории психиатрии по двум причинам.
Во-первых, кетамин относится к новому типу антидепрессантов, и молекулярные механизмы его действия коренным образом отличаются от работы традиционных препаратов, мишенью которых являются моноамины [3, 4]. Это открывает новые перспективы для изучения механизмов действия антидепрессантов и для понимания патофизиологии депрессии.
Во-вторых, применение кетамина в терапии открывает возможности, недоступные для традиционных антидепрессантов: быстрое (в пределах нескольких часов) облегчение симптомов депрессии.
Важно, однако, что у одних пациентов облегчение симптомов после введения кетамина сохраняется на более или менее долгое время, в то время как у других подобного эффекта не наблюдается [1, 2]. Механизмы, лежащие в основе этих различий, до сих пор мало изучены.
В статье, опубликованной в «Nature Neuroscience», Ким с соавторами описали общий молекулярный механизм, лежащий в основе долгосрочного эффекта двух антидепрессантов быстрого действия [5], обратив внимание на ключевой фактор, обладающий еще не раскрытым терапевтическим потенциалом.
В своей работе авторы использовали тест вынужденного плавания у мышей: эту поведенческую модель часто используют в скрининге препаратов с потенциальным антидепрессивным действием. Ким с соавторами начали с проверки предположения, что в поддержании долгосрочного поведенческого эффекта, вызываемого введением кетамина, участвуют механизмы транскрипции.
Оказалось, сочетание кетамина с ингибитором транскрипции актиномицином D препятствует сохранению долгосрочного антидепрессивного действия, что было показано в поведенческом тесте у мышей через семь дней после введения препаратов.
Ранее в поведенческих моделях у мышей было показано, что ключевую роль в формировании антидепрессивного поведения после введения кетамина играет нейротрофический фактор мозга (brain-derived neurotrophic factor, BDNF) [3].
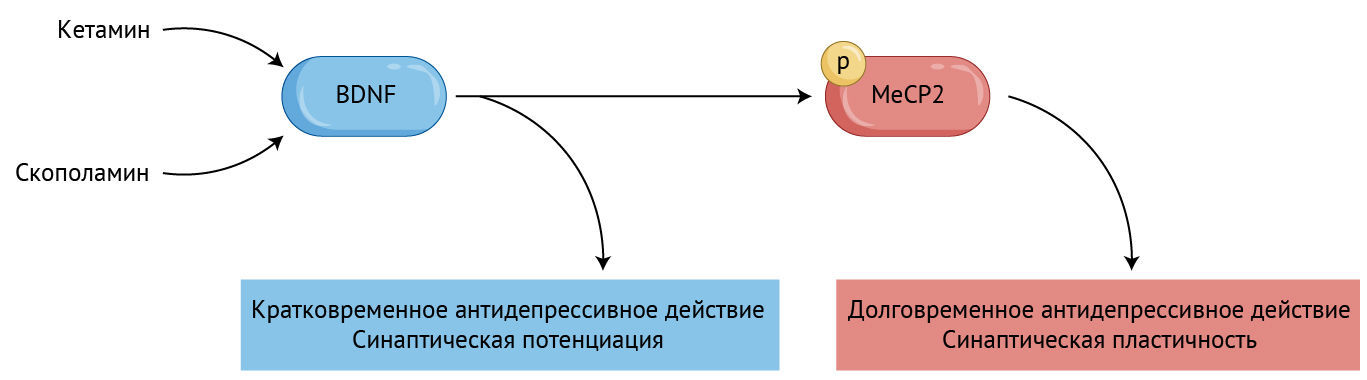
Кетамин и скополамин через некоторое время после введения вызывают значительное увеличение уровня фосфорилированной формы MeCP2, что необходимо для поддержания долгосрочного действия, которое эти препараты оказывают на поведение и синаптическую пластичность.
В своей работе авторы протестировали три наиболее вероятные молекулы, которые влияют на изменение транскрипции и активируются BDNF, а именно MeCP2, CREB и MEF2C. Роль этих транскрипционных факторов, которые запускают долговременную экспрессию генов в зависимости от синаптической активности и возникающих кальциевых потенциалов, достаточно хорошо изучена.
Как и ожидалось, уровень самого BDNF значительно возрастал в гиппокампе мышей через 30 минут, но не через семь дней после введения кетамина.
Наоборот, активированная форма MeCP2 (pMeCP2) показывала противоположную картину. Уровень pMeCP2 оставался неизменным через 30 минут после процедуры, но показывал высокие значения через семь дней.
Уровни CREB и фосфорилированного CREB оставались без изменений и в том, и в другом случаях. Кроме того, нокаут MEF2C в переднем мозге мышей никак не влиял на формирование антидепрессивного поведения после введения кетамина.
Эти результаты говорят о том, что быстрый подъем уровня BDNF играет важную роль в формировании антидепрессивного поведения после введения кетамина, тогда как отложенный во времени подъем уровня MeCP2 имеет большое значение для его поддержания.
Чтобы более детально изучить роль MeCP2, Ким с соавторами вводили кетамин трансгенным мышам с нокином нефосфорилируемой, инактивированной формы MeCP2 и изучали их поведение.
У таких животных можно было наблюдать быстрое антидепрессивное действие кетамина через 30 минут после инъекции, но через семь дней этого действия не наблюдалось. Таким образом, активная форма pMeCP2 необходима для поддержания изменений поведения, вызванных инъекцией кетамина.
Кроме того, авторы показали, что и уровень pMeCP2, и поведение не менялись у мышей, нокаутных по гену BDNF, семь дней спустя после введения кетамина. Это говорит о том, что BDNF необходим для формирования поведенческого эффекта, долговременное поддержание которого зависит от экспрессии pMeCP.
Чтобы узнать, существуют ли другие антидепрессанты, долговременность действия которых зависит от сигнального пути pMeCP2, авторы использовали скополамин — антихолинергический препарат, оказывающий быстрое, сходное с антидепрессантами действие в поведенческих моделях у грызунов [6]. Существуют доказательства, полученные в клинических исследованиях, что этот препарат обладает терапевтическим потенциалом [7].
Было обнаружено, что скополамин обладает действием, сходным с антидепрессивным, в тесте вынужденного плавания; оно появлялось через 8 и через 24 часа после введения препарата.
Действие скополамина напоминало действие кетамина: уровень pMeCP2 в гиппокампе также поднимался через 24 часа. Кроме того, подъем уровня pMeCP2, так же как и поведенческие изменения, зависел от уровня BDNF.
Вдобавок у трансгенных мышей с нокином pMeCP2 (заменой гена MeCP2 на нефосфорилируемую форму) поведенческий эффект от введения скополамина не был постоянным: он наблюдался только через 8 часов после инъекции, но не через 24.
В довершение всего Ким с соавторами выясняли, зависит ли долговременный эффект введения обоих препаратов (скополамина и кетамина) от сигнального пути MeCP2, используя регистрацию долговременных потенциалов на срезах гиппокампа, в коллатералях Шаффера (аксонах пирамидных клеток, расположенных в области СА3 и идущих в область СА1).
Нанесение кетамина на гиппокампальные срезы усиливало активность в коллатералях Шаффера.
Интересно, что этот эффект был более выражен у мышей, которые получали инъекцию кетамина за семь дней до подготовки срезов, что позволяет говорить о долговременной синаптической пластичности.
У мышей с нокином активируемой формы MeCP2 подобного эффекта не наблюдалось.
Схожим образом скополамин через 8 и 24 часа после введения повышает вероятность высвобождения синаптических медиаторов на срезах гиппокампа. Подобного эффекта не наблюдалось у мышей, нокаутных по гену Bdnf, а у мышей с нокином инактивированной формы MeCp2 этот эффект обнаруживался только через 8 часов, но не через 24 после введения скополамина, что еще раз указывает на важность активации pMeCP2 для долгосрочного действия антидепрессантов.
Работа Кима с соавторами не только подчеркивает ранее недооцененную роль сигнального пути MeCP2 в поддержании антидепрессивного действия как кетамина, так и скополамина, но также поднимает ряд интересных вопросов.
Чтобы выяснить, как антидепрессанты влияют на системные функции мозга, авторы в своем эксперименте элегантно воспользовались моделью гиппокампальных срезов. Однако, согласно имеющимся данным, антидепрессивный эффект кетамина связан с воздействием не только на гиппокамп, но также на самые разные области мозга, включая префронтальную кору, латеральные ядра поводка, вентральную область покрышки и другие [4, 8–10].
Как между собой взаимодействуют эти области мозга, запуская и поддерживая переход из депрессивного состояния в ремиссию?
Интересно отметить, что, согласно данным Кима с соавторами, хотя кетамин и скополамин приводят к увеличению уровня pMeCP2 в гиппокампе, уровень экспрессии pMeCP2 в префронтальной коре не меняется.
В другом недавно опубликованном исследовании было показано, что инактивация проекций из гиппокампа в префронтальную кору предотвращает долгосрочное проявление антидепрессивного действия кетамина, но не препятствует его формированию [11].
Учитывая все вышеизложенное, полученные данные позволяют предположить, что антидепрессивное действие кетамина инициируется в гиппокампе, тогда как префронтальная система играет более важную роль в поддержании этого эффекта на долгое время.
Было бы важно узнать, влияет ли скополамин так же, как кетамин, на долговременную экспрессию pMeCP2: не только через 24 часа после введения препарата, но через семь дней и дольше.
Подводя итог, можно сказать, что Ким с соавторами провели великолепную серию экспериментов, результаты которых дают все основания полагать, что MeCP2 играет ключевую роль в поддержании долгосрочного действия двух быстродействующих антидепрессантов.
Кетамин, дающий быстрое облегчение симптомов, может оказаться спасительным для пациентов с резистентной депрессией. Тем не менее, в отсутствие дополнительных процедур у пациентов, получавших кетаминовую терапию, слишком часто случаются рецидивы.
Несмотря на то, что за последние два десятилетия мы стали лучше понимать молекулярные механизмы, лежащие в основе быстрого антидепрессивного действия, подобные исследования очень важны для выявления еще неизвестных молекулярных мишеней, способных достигать долгосрочных антидепрессивных эффектов и стабильных сдвигов эмоционального состояния.
