Редактирование генома на основе методики CRISPR снижает уровень холестерина у обезьян

Прицельное воздействие на ген, связанное с сердечно-сосудистыми заболеваниями, — перспективный метод терапевтического воздействия.
Редактирование генома на основе методики CRISPR получает стремительное развитие в сфере клинического применения. На примере двух работ данная методика демонстрирует успешное снижение уровня холестерина в крови у обезьян. В своих статьях в Nature Biotechnology и Nature Rothgangl с соавт. [1] и Musunuru с соавт. [2], соответственно, показали, что временная экспрессия основных редакторов оснований [CRISPR-Cas9] с целью выключения гена, связанного с сердечно-сосудистыми заболеваниями, эффективна и безопасна для приматов. Посредством транспортировки редакторов оснований в печень в виде липидных наночастиц удалось добиться нокаута целевого гена, кодирующего пропротеин-конвертазу субтилизин/кексин типа 9 (PCSK9), а также значительного снижения уровня холестерина в крови. Данные эффекты не сопровождались редактированием сторонних генетических последовательностей или же серьезными иммунными реакциями. Исходя из этого, терапия редактирования генов в кардиологической сфере может быстро стать реальностью, как только подход будет адаптирован для тестирования на людях.
Внеклеточный фермент PCSK9 экспрессируется в печени и необходим для гомеостаза холестерина. Связывание PCSK9 с рецептором липопротеинов низкой плотности (ЛПНП) приводит к эндоцитозу и деградации рецептора, что снижает захват частиц холестерина ЛПНП из крови [3]. Фенотипы, при которых существует усиленная функция PCSK9, оказались ассоциированы с семейной гиперхолестеринемией — состоянием, характеризующимся высоким уровнем холестерина ЛПНП в крови и высокой смертностью [4]. И наоборот, некоторые естественные мутации или нокауты гена PCSK9 снижают риск сердечно-сосудистых заболеваний [5].
Существующие на данный момент методы лечения пациентов с семейной гиперхолестеринемией включают прием статинов, терапию интерферирующей РНК (иРНК) и антителами к PCSK9. Тем не менее, у этих методов лечения есть недостатки в виде пожизненного и частого приема препарата, а также лекарственной непереносимости. Гепатоциты, основной тип клеток печени, характеризуются низкой скоростью обновления и способностью к делению. Таким образом, однократное введение компонентов редактирования генов для постоянного подавления функции PCSK9 в печени может оказаться эффективным в течение десятилетий, что улучшит качество жизни и сократит расходы в системе здравоохранения.
Методики редактирования генов дебютировали в клинической практике с нуклеаз «цинкового пальца» [6]. Но в отличие от нуклеаз «цинкового пальца», CRISPR-Cas9 можно легко перепрограммировать для нацеливания на необходимые геномные локусы, что позволяет многим академическим и коммерческим лабораториям разрабатывать методы лечения, основанные на редактировании генов [ответственных за развитие определенных заболеваний]. Соединение цитидин- и аденозиндезаминаз с Cas9 или с более безопасными вариантами никазы [надрезающая эндонуклеаза — фермент, разрезающий двойную спираль ДНК в специфических местах, называемых сайтами рестрикции — прим.перев.] Cas9 катализирует специфическое преобразование оснований (цитозина (Ц) в тимин (Т) и аденина (А) в гуанин (Г)) в условиях in vitro и in vivo [7]. В частности, редакторы адениновых оснований приводят к появлению нескольких заметных нецелевых событий [8,9]. Возможность создавать специфические изменения оснований без необходимости двухцепочечных разрывов ДНК открывает множество возможностей для исправления патогенных мутаций или модуляции экспрессии генов [7].
В своем исследовании Rothgangl с соавт. провели нокаут гена PCSK9, повредив донорский сайт сплайсинга Г-T в интроне 1. Авторы применили липидные наночастицы для внутривенного введения здоровым яванским макакам химически модифицированной однонаправленной РНК вместе с мРНК, кодирующей созданный in vitro редактор адениновых оснований (ABEmax) (см. рис.1). Целевая последовательность для однонаправленной РНК идеально сохраняется у людей и макак, что упрощает интерпретацию результатов, полученных от одних применительно к другим.
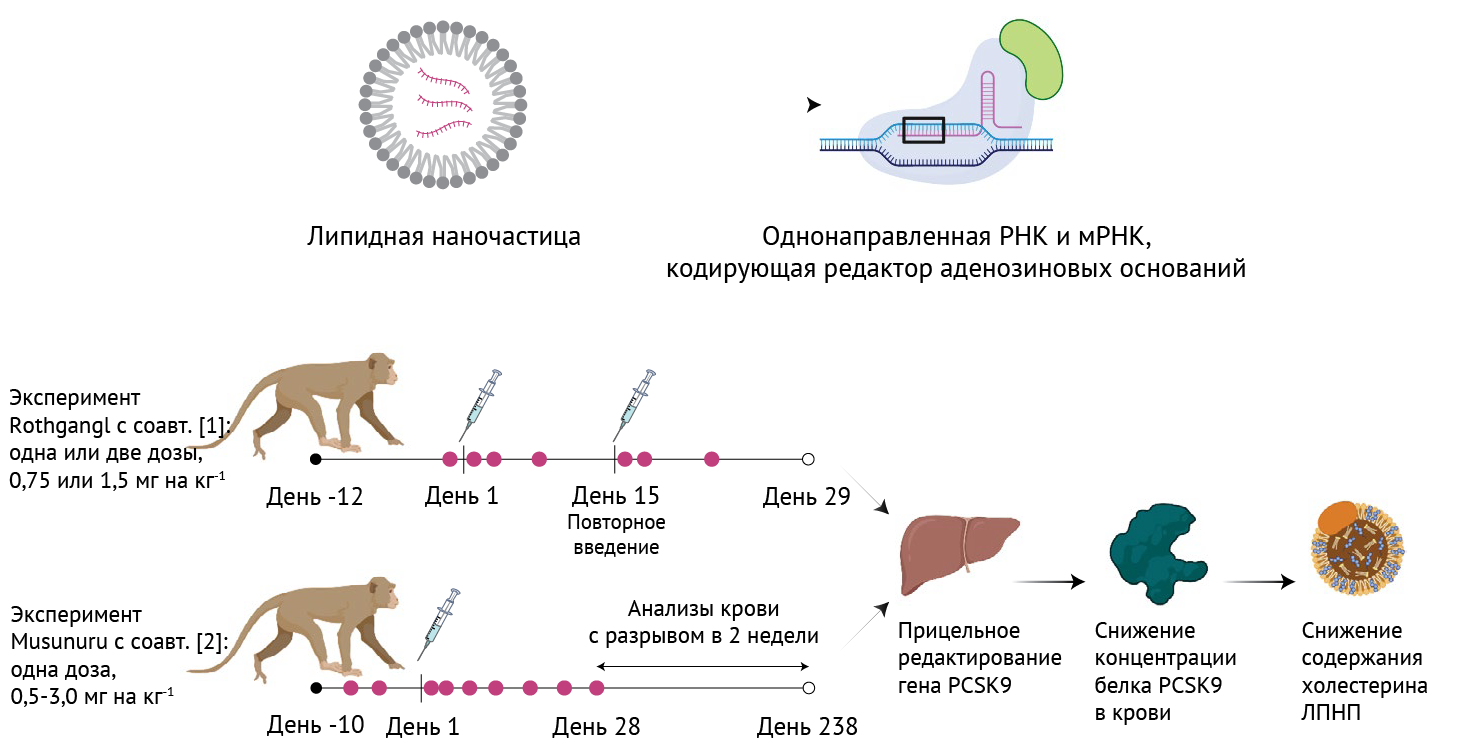
LNP — ЛНЧ — липидные наночастицы;
sgRNA — однонаправленная РНК;
мРНК -— информационная (матричная) РНК; PCSK9 -— пропротеин-конвертаза субтилизин/кексин типа 9;
ЛПНП -— липопротеиды низкой плотности.
Авторы протестировали РНК в двух концентрациях (0,75 мг/кг и 1,5 мг/кг) при введении одной или двух доз с интервалом в две недели. Целевое секвенирование ампликона из биоптатов печени, полученных спустя 29 дней из всех четырех долей органа, выявило, что необходимое основание редактировалось с эффективностью 2 % при низкой дозе и 28 % при высокой дозе. Анализ целевого редактирования в других тканях макак в группе высокой концентрации выявил низкие показатели редактирования генома. У животных, которым ввели один раз высокую концентрацию экспериментального препарата, обнаружилось снижение циркулирующего PCSK9 на 26 %, а также снижение уровня холестерина ЛПНП в сыворотке через 29 дней после введения. Два введения высокой концентрации препарата снизили уровень PCSK9 в крови на 39 % и уровень холестерина в сыворотке на 19 % через 29 дней. Углубленный анализ нецелевого редактирования (как зависимого, так и независимого от однонаправленной РНК) у животных, получивших высокую концентрацию, не выявил каких-либо заметных событий. Иммунные ответы, свидетельством которых были повышенные уровни сывороточных трансаминаз, провоспалительных цитокинов и иммуномодулирующих хемокинов, протекали мягко и оказались преходящими и, как было установлено, стимулировались составом липидных наночастиц. Кроме того, у обезьян, получивших две дозы, были обнаружены SpCas9- и TadA-специфические антитела к иммуноглобулину G (IgG), что предположительно повлияло на эффективность второй дозы.
Соответствующее исследованиие Musunuru с соавт. основано на предыдущей работе, в которой было продемонстрировано редактирование PCSK9 на мышах [10]. Как и Rothgangl с соавт., ученые на примере здоровых яванских макак провели нокаут гена PCSK9 путем создания мутации сайта сплайсинга в последовательности, идентичной как у человека, так и у обезьян, используя редактор оснований, вводимый посредством липидных наночастиц. В качестве редактора оснований был применен один из последних редакторов адениновых оснований (ABE8.8) [11]. Однократная внутривенная инфузия терапевтического препарата вызвала эффективное редактирование генома в печени, что сопровождалось стойким снижением уровней белка PCSK9 в крови и холестерина-ЛПНП. Максимальное целевое редактирование наблюдалось в селезенке, а минимальное — в других тканях. Введение одной дозы (3,0 мг/кг) привело к 66 %-ному редактированию необходимых оснований (в биоптатах из печени, собранных через 2 недели после инфузии). В результате, через 8 месяцев концентрация PCSK9 в крови снизилась на 90 %, а холестерин-ЛПНП в крови снизился на 60 %. Как и Rothgangl с соавт., исследователи выявили умеренное временное повышение сывороточных трансаминаз, что было непосредственным следствием введения липидных наночастиц. Оценка нежелательного нецелевого редактирования в печени обезьян при введении более низких доз (1,0 и 1,5 мг/кг) выявила низкоуровневое редактирование (< 1 %) на одном прогнозируемом, но плохо сохраненном участке, который не был идентифицирован в исследованиях in vitro первичных гепатоцитов человека.
Одно очевидное различие между двумя исследованиями заключается в эффективности целевого редактирования, значения которого оказались выше в работе Musunuru с соавт. Как отмечают Rothgangl с соавт., вполне возможно, что их стратегия повторного введения (т.е. введение второй дозы) через две недели стимулировала иммунный ответ, о чем свидетельствовали антитела IgG против Cas9 и ABEmax, что привело к элиминации части гепатоцитов. Данное обстоятельство подчеркивает необходимость оптимизации режима введения дозировок у крупных млекопитающих для достижения максимизации целевого редактирования перед клиническими испытаниями на людях. Использование более совершенного препарата ABE8.8 также могло способствовать более высокой эффективности редактирования, зафиксированной Musunuru с соавт.
В обеих статьях сообщается о быстром выведении однонаправленной РНК, мРНК редактора оснований и липидных наночастиц. Это резко контрастирует с методом внутриклеточной доставки компонентов CRISPR посредством аденоассоциированных вирусов, для которых характерны интеграция в геном и растянутая во времени экспрессия [12]. С клинической точки зрения, длительное сохранение компонентов редактирования нежелательно, поскольку это повышает вероятность нецелевого редактирования и иммунных реакций против клеток, экспрессирующих бактериальный CRISPR-Cas. Это предполагает явное преимущество доставки CRISPR-Cas посредством липидных наночастиц (являющейся преходящей по своей природе). Однако липидные наночастицы обладают выраженной тропностью к гепатоцитам, что ограничивает их применение для воздействия на иные органы. Необходимы дальнейшие разработки новых методов, позволяющих осуществлять доставку компонентов CRISPR к любому необходимому органу и типу клеток с быстрым выведением.
Исследования Rothgangl с соавт., а также Musunuru с соавт. — удивительные примеры того, каким огромным терапевтическим потенциалом обладает методика редактирования оснований CRISPR. Конечно, остались нерешенными проблемы, связанные с побочными мутациями, иммуногенностью и целевыми органами воздействия. Несмотря на это, благодаря быстрому развитию систем редактирования на основе CRISPR, достижение момента, когда преимущества точного редактирования генома перевесят недостатки, остается лишь вопросом времени; это обеспечит окончательное утверждение этого метода в клинической практике.
