Натуральные киллеры, вероятно, помогают контролировать COVID-19
Натуральные киллеры (NK-клетки) способны уничтожать клетки, инфицированные вирусом SARS-CoV-2, однако у людей с тяжелой формой COVID-19 такая иммунная защита нарушается. Станет ли это открытие стимулом для поисков способов придать натуральным киллерам новые силы в такой ситуации?
Большинство случаев инфекции SARS-CoV-2 протекает в легкой форме, однако у части людей по не совсем понятным причинам наблюдается развитие тяжелой формы COVID-19. Известно несколько факторов, связанных с развитием тяжелой формы. Например, эти люди часто страдают хроническими заболеваниями, такими как ишемическая болезнь сердца, артериальная гипертензия и сахарный диабет [1]. Неудивительно, что нарушение противовирусной защиты также может привести к опасному для жизни состоянию, как это происходит у примерно 15 % людей с тяжелой формой COVID-19, у которых наблюдается так называемая недостаточность сигнального пути интерферона I типа [2]. Действительно, с момента открытия этого пути в 1957 году стало известно, что он напрямую препятствует репликации вируса в инфицированной клетке [3].
Также в противовирусной защите могут быть задействованы иные механизмы, такие как натуральные киллеры (NK-клетки) иммунной системы. В своей статье в Nature Витковски с соавт. [4] сообщают, что у людей с тяжелой формой COVID-19 концентрация трансформирующего фактора роста β1 (TGFβ1, от англ. transforming growth factor-β1 — вещество, обладающее противовоспалительными свойствами) в крови выше нормы, что связано с нарушением противовирусной защиты, формируемой NK-клетками, и контроля иммунной системы над вирусом SARS‑CoV-2 в организме.
Натуральные киллеры — это лейкоциты, которые относятся к звену врожденной иммунной системы. Противовирусный иммунитет во многом зависит от их правильного функционирования, а эффективный контроль над развитием нескольких типов вирусных инфекций зависит от быстрой активации этих клеток [5]. NK-клетки способны уничтожать инфицированные вирусом клетки различными способами: путем выделения содержимого цитотоксических гранул (т. н. дегрануляции), которое напрямую убивает зараженные клетки, или с помощью формирования как врожденных, так и приобретенных механизмов иммунной защиты посредством синтеза молекул, называемых цитокинами и хемокинами, которые модулируют поведение других иммунокомпетентных клеток. В ходе предыдущих исследований [6–10] была изучена реакция NK-клеток у людей с COVID-19; были сделаны выводы об их более низком по сравнению с нормой количестве у лиц с этим заболеванием, однако точная функция таких клеток при тяжелой форме COVID-19 оставалась неясной.
Витковски с соавт. проанализировали образцы биоматериала, полученные от пациентов, и выявили корреляцию между быстрым снижением титра вируса (т. е. вирусной нагрузки) и высоким содержанием NK-клеток в крови в начале инфекции. Такая корреляция не наблюдалась в случае Т- или В-лимфоцитов. Резкое уменьшение количества NK-клеток в кровотоке в ходе инфекции может быть связано с их гибелью в результате апоптоза [7] или их привлечением из кровотока в легочную ткань.
Важно отметить, что Витковски с соавт. сообщают о способности NK-клеток у здоровых людей напрямую уничтожать клетки, инфицированные SARS-CoV-2 в условиях in vitro, но у NK-клеток людей с умеренно выраженной или тяжелой формой COVID-19 эта способность снижена (рис. 1). Такие дефектные NK-клетки экспрессируют цитотоксические молекулы на уровне, превышающем норму, однако способность этих клеток связываться с клетками-мишенями и выделять свои цитотоксические гранулы на их поверхность оказалась нарушена. Кроме того, NK-клетки людей с тяжелой формой COVID-19 в худшей степени синтезировали цитокины и хемокины, чем таковые у здоровых лиц или людей, у которых COVID-19 протекал в бессимптомной форме или с незначительными симптомами.
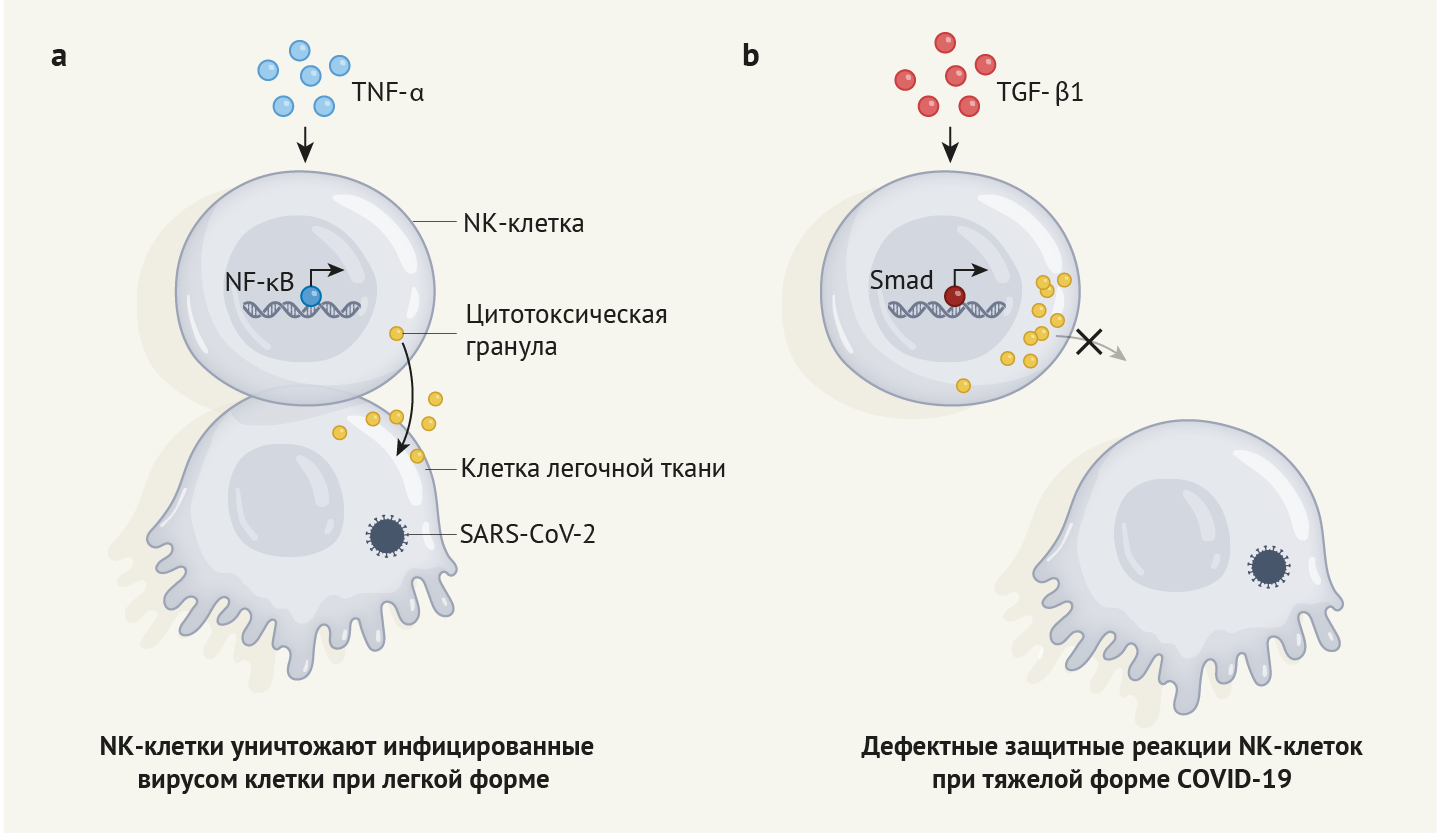
а. В предыдущей работе [7] авторы указывают, что в случае легкой формы COVID-19 в NK-клетках наблюдается экспрессия генов, которая обычно индуцируется посредством сигнального пути TNF-α. Данный тип профиля экспрессии генов развивается под действием факторов транскрипции, таких как белок NF-κB, и способствует восстановлению функции NK-клеток [7].
b. Витковски с соавт. [4] провели анализ образцов NK-клеток от людей с тяжелой формой COVID-19. Авторы сообщают, что эти клетки характеризовались такой же картиной экспрессии генов, какая наблюдается под действием TGF-β1. Экспрессия генов, опосредованная этим путем, зависит от факторов транскрипции, в число которых входят белки Smad. Авторы сообщают, что NK-клетки людей с тяжелой формой COVID-19 не способны связываться с инфицированными клетками и выделять цитотоксические гранулы. Данный вывод дает представление о факторах, служащих причинами тяжелой формы COVID-19.
Для анализа механизмов, лежащих в основе дисфункции NK-клеток, Витковски с соавт. провели оценку экспрессии генов путем секвенирования РНК единичных клеток, полученных из образцов крови людей с COVID-19 разной степени тяжести. Авторы обнаружили, что в этих клетках характер экспрессии генов был сходным с таковым под действием интерферонов типа I. Это хорошо согласуется с выводами другого исследования [7], в котором сообщается об аналогичном транскрипционном анализе NK-клеток, полученных от людей с COVID-19. Такая сигнатура экспрессии генов была выражена преимущественно в NK-клетках людей с тяжелой формой COVID-19. Более того, для легких форм COVID-19 описан паттерн экспрессии генов в ответ на белок TNF-α в NK-клетках. Также в NK-клетках, выделенных из крови или из легочной ткани людей, зараженных SARS-CoV-2, Витковски с соавт. обнаружили усиление экспрессии генов, находящихся под контролем TGF‑β1. По-видимому, это усиление коррелирует с более тяжелым течением COVID-19 у пациентов, у которых более распространена экспрессия генов, управляемых TGF‑β1.
TGF-β1 — это цитокин, являющийся ключевым в процессе ремоделирования тканей, но также он подавляет функционирование NK-клеток [11]. Как было показано в условиях in vitro, TGF-β1 ограничивает способность NK-клеток контролировать репликацию SARS-CoV-2. Когда NK-клетки здоровых людей in vitro были обработаны TGF-β1, они не могли связываться с инфицированными клетками-мишенями, осуществлять дегрануляцию и выделять цитокины.
Витковски с соавт. сообщают о высоком уровне TGF-β1 в крови людей с тяжелой формой COVID-19; напротив, подобное не наблюдалось в образцах, полученных от людей с бессимптомной или малосимптомной формой заболевания. Примечательно, что авторы сообщают о способности сыворотки людей с тяжелой формой COVID-19 до некоторой степени ограничивать дегрануляцию NK-клеток и контролировать репликацию вируса в условиях in vitro (что было опосредовано NK-клетками от здоровых доноров). Также, по сообщениям авторов, такие эффекты можно предотвратить, добавив антитела, блокирующие TGF-β1. В совокупности эти результаты указывают на корреляцию между тяжелой формой COVID-19, наличием высокого титра TGF-β1 в крови и нарушением защитной функции NK-клеток.
Тем не менее, без ответов остаются несколько вопросов. Во-первых, а так ли важна функция NK-клеток в контексте борьбы организма с инфекцией SARS‑CoV-2? Несколько исследований, проведенных на мышиных моделях респираторных вирусных инфекций, вызываемых такими вирусами как вирус гриппа A, респираторно-синцитиальный вирус и вирус Сендай, демонстрируют, что NK-клетки помогают контролировать вирус и способствуют выживанию макроорганизма [5]. В соответствии с этим, единственная характеристика, присущая людям с различными типами дефицита NK-клеток, — это предрасположенность к вирусным инфекциям, в особенности к герпесвирусу [12]. Тот факт, что интерфероны I типа являются мощными активаторами NK-клеток, также предполагает наличие связи между дефицитом интерферонов I типа и нарушением противовирусного иммунитета, опосредованного NK-клетками. Все эти результаты, вместе с отрицательной корреляцией между количеством функционирующих NK-клеток и тяжестью COVID-19, подтверждают роль этих клеток в контроле течения инфекции SARS-CoV-2, однако окончательные доказательства этой гипотезы еще только предстоит получить.
Второй вопрос, который требует ответа — каковы механизмы, лежащие в основе усиленной продукции TGF-β1 при COVID-19? SARS‑CoV-2 содержит шипиковый белок, который взаимодействует с рецептором АПФ2 на поверхности клеток человека [1]. Этот рецептор представляет собой фермент, превращающий белок ангиотензин II в пептид, называемый ангиотензин 1-7. При заражении SARS-CoV-2 ферментативная активность АПФ2 нарушается, что приводит к повышению концентрации ангиотензина II и способствует экспрессии TGF-β1 [1]. Таким образом, чрезмерное повреждение легочной ткани вследствие высокой вирусной нагрузки способно стимулировать синтез TGF-β1 в высоких концентрациях, что может влиять на NK-клетки. Кроме того, известно, что TGF-β1 способствует типу повреждения тканей, называемому фиброзом и характерному для тяжелой формы COVID-19. Повышение титра ангиотензина II cлужит общим признаком ишемической болезни сердца, артериальной гипертензии и сахарного диабета [13], а высокая концентрация TGF-β1 наблюдается при ожирении [14]. Таким образом, важно исследовать, участвует ли в такой связи между перечисленными патологиями с тяжелой формой COVID-19 дисфункция NK-клеток, опосредованная TGF-β1.
Пути управления активностью NK-клеток вызывают все больший интерес в контексте противоопухолевой терапии при использовании, например, ингибиторов иммунных контрольных точек, активаторов NK-клеток и промышленных препаратов NK-клеток для инфузии [15]. Также знание о важности роли NK-клеток в противовирусном иммунитете должно побудить к разработке инновационных методов лечения, основанных на управлении такими клетками в борьбе с вирусными инфекциями. В случае тяжелой формы COVID-19 высокий уровень присутствующего TGF-β1 может представлять угрозу стратегии повышения активности NK-клеток. Вместо этого применение блокаторов TGF-β1 [16] может оказаться способом усилить противовирусную защиту, опосредованную NK-клетками, и предотвратить фиброз легких. Однако в этом контексте безопасность такого метода лечения представляет открытый вопрос, требующий пристального внимания. Кроме того, мониторинг уровня TGF-β1 в плазме и TNF-α-опосредованной генной экспрессии в NK-клетках [7], может помочь предсказать исход инфекции и надлежащим образом скорректировать уход за пациентами.
